
- •1! Предмет технической термодинамики и ее задачи
- •2! Основные термодинамические параметры состояния
- •25! Компрессор – машина для сжатия и последующего перемещения какого-либо газа (воздуха).
- •39! Топливо. Основные определения. Состав топлив
- •40! Процесс горения топлив. Коэффициент избытка воздуха. Высшая и низшая теплопроводная способность топлива
- •41! Котельные установки. Классификация котельных установок
- •42! Топки котельных установок. Тепловые характеристики топок
- •43! Основные элементы парового котла. Тепловой баланс котельного агрегата
- •44! Классификация паровых котлов
- •49! Правила эксплуатации котельного агрегата
- •50! Методы очистки котлов
- •51! Техническое освидетельствование парового котла
- •52! Применение теплоты в сельском хозяйстве
- •54! Способы сушки продуктов сх производства
- •58! Водяные системы отопления с естественной циркуляцией
- •59! Водяные системы отопления с естественной циркуляцией
- •60! Воздушные системы отопления
- •61! Паровые системы отопления применение
- •62! Горячее водоснабжение
1! Предмет технической термодинамики и ее задачи
Техническая термодинамика рассматривает закономерности взаимного превращения теплоты в работу. Она устанавливает взаимосвязь между тепловыми, механическими и химическими процессами, которые совершаются в тепловых и холодильных машинах, компрессорах и т. п., изучает процессы в газах и парах, а также свойства этих тел при различных физических условиях. В основу термодинамики положены три экспериментальных закона и уравнение состояния: первый закон (первое начало термодинамики) – закон сохранения и превращения энергии; второй закон (второе начало) указывает направление, по которому протекают естественные явления в природе; третий закон (третье начало) утверждает, что абсолютный нуль температуры недостижим.
Характерным методом является идеализация – рассмотрение процесса изолированно от окружающей среды.
Идеальный газ – условно представлен как газ у которого отсутствуют силы взаимодействия между молекулами и лишенный объема
Равновесные системы-системы, состояние и свойства которых не изменяются с течением времени.
2! Основные термодинамические параметры состояния
Рабочими телами называются макроскопические тела (газы, водяной пар, воздух, смесь газов, образующихся при сгорании топлива и др.), между которыми осуществляется обмен энергией в форме теплоты и работы.
В тепловых двигателях преобразование теплоты в работу осуществляется с помощью рабочего тела. Например, в двигателях внутреннего сгорания, а также в газотурбинных установках рассматриваются процессы, в которых рабочим является газ. В паровых двигателях рассматриваются процессы, в которых рабочим телом является газ, легкопереходящий из парообразного состояния в жидкое и, наоборот, из жидкого в парообразное.
Интенсивными термодинамическими параметрами называются термодинамические параметры, значения которых не зависят от размеров и массы системы.
Экстенсивными (аддитивными) термодинамическими параметраминазываются параметры, пропорциональные количеству вещества или массе.
Термодинамическое состояние системы определяется совокупностью интенсивных параметров.
Внешние параметры характеризуют положение (координаты) системы во внешних силовых полях и ее скорость.
Внутренние параметры характеризуют изучаемую систему. Например, для газа, находящегося в цилиндре, объем – это внешний параметр (он зависит от размеров цилиндра), а давление газа на стенки цилиндра – внутренний параметр.
Известна еще одна классификация. Параметры подразделяются на термические и калорические свойства (величины).
К термическим свойствам (величинам) относятся: давление p, объем v, температура T, а также термические коэффициенты: изотермический коэффициент сжимаемости αT, коэффициент объемного расширения β и термический коэффициент давления γ.
К калорическим свойствам относятся следующие основные термодинамические величины: теплоемкость, энтропия S, внутренняя энергия U, энтальпия H, эксергия и др.
Если состояние всех тел, входящих в термодинамическую систему, длительное время не изменяется, то говорят, что система находится в термодинамическом равновесии.
Для определения физических условий, при которых рассматривается рабочее тело, и для однозначного определения его состояния вводятся характеристики состояния, называемые параметрами состояния.
При отсутствии силовых полей (гравитационного, электромагнитного и др.) состояние однородного тела может быть однозначно определено тремя параметрами, в качестве которых в технической термодинамике принимают удельный объем, абсолютную температуру и давление.
Удельный объем вещества – объем, занимаемый единицей массы данного вещества
v = V / M , м3/кг. (1.1)
Плотность вещества ρ – величина, обратная удельному объему
ρ =1/ v = M /V , кг/м3. (1.2)
Плотность и удельный объем рабочих тел зависят от температуры и
давления.
3! pV = NRµ T . (2.13)
Уравнение (2.13) называется уравнением Клапейрона – Менделеева. Оно связывает три закона идеальных газов (Бойля – Мариотта, Гей-Люссака и Авогадро) и включает универсальную газовую постоянную, не зависящую от природы газа. Уравнение состояния (2.13) получено для идеального газа, у которого силы взаимодействия между молекулами отсутствуют, а объем, занимаемый молекулами, незначителен по сравнению с объемом газа.
В этих уравнениях: Rµ = 8314 Дж/(кмоль.К) – универсальная газовая постоянная. Rµ – есть работа 1 кмоль идеального газа в процессе при постоянном давлении при изменении его температуры на один градус. Между удельной газовой постоянной и универсальной существует связь R = Rµ/ µ .
V – объем произвольного количества газа, м3
N-кол-во вещества, кмоль
4! Расчет термических параметров газовых смесей
Примерами газовых смесей являются воздух, природный газ, продукты сгорания топлива и т. д. Ниже рассматривается расчет механических газовых смесей (химически не реагирующих) при условии, что газовая смесь – идеальный газ.
В этом случае:
1. Каждый компонент имеет температуру, равную температуре смеси, и занимает весь объем смеси.
2. Сумма парциальных давлений компонентов равна давлению смеси
3. Сумма парциальных объемов компонентов равна объему смеси
Парциальное давление компонента – это давление, которое оказывает компонент на стенки сосуда с газовой смесью.
Парциальный объем компонента – это объем, который бы занимал компонент, имея давление и температуру смеси. Параметры газовой смеси рассчитываются по уравнению состояния идеального газа
pV = MRT ,
Параметры компонентов рассчитываются по уравнениям:
piV = MiRiT ,
pVi = MiRiT .
Чтобы воспользоваться этими формулами, необходимо знать мольную массу газовой смеси (µ), парциальные давления (pi ) или парциальные объемы (Vi).
Существует три способа задания газовой смеси:
1. По массовому составу.
2. По объемному составу.
3. По мольному составу.
Закон Дальтона — Давление смеси газов, не взаимодействующих друг с другом химически, равно сумме парциальных давлений этих газов.
![]()
Так же, закон Дальтона описывает связь растворимости компонентов газовой смеси, которая пропорциональна их парциальному давлению.
![]()
В Формуле мы использовали :
![]() —
Давление смеси
газов
—
Давление смеси
газов
![]() —
Масса растворимого
газа
—
Масса растворимого
газа
![]() —
Давление окружающей
среды
—
Давление окружающей
среды
5! Теплоемкостью рабочего тела (или системы) называют отношение элементарного количества полученной им теплоты δQ в каком-либо процессе к соответствующему изменению температуры dT в этом процессе
C = δQ / dT , Дж/К. (3.1) -истинная теплоемкость
Теплоемкость численно равна количеству теплоты, которое необходимо подвести к системе, чтобы при заданных условиях повысить ее температуру на 1 градус.
При различных температурах, а в общем случае и при различных давлениях, теплоемкость данного рабочего тела принимает различные значения и, значит, в течение процесса изменяется. Теплоемкость зависит от условий термодинамического процесса.
Средней теплоемкостью называется отношение количества теплоты Q1,2, полученное рабочим телом в течение процесса, к изменению температуры ∆T
Cc = Q 2,1/ ∆T .
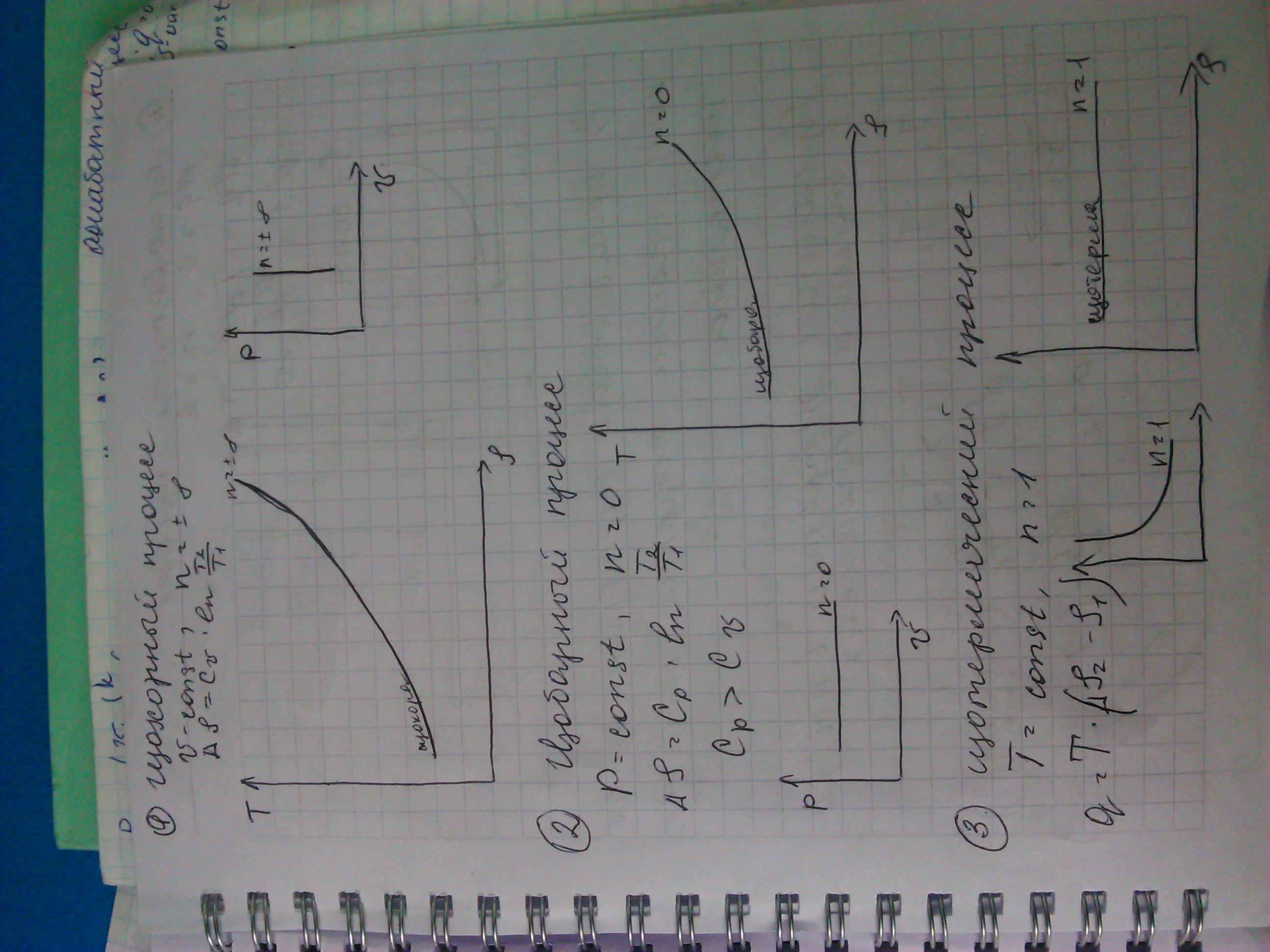
6! Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Теплота подведенная к термодинамической системе расходуется на изменение внутренней энергии системы и на совершение механической работы против внешних сил. формулировка Второго Закона Термодинамики: "При прохождении в изолированной системе самопроизвольных процессов энтропия системы возрастает". Или: "Энтропия изолированной системы стремится к максимуму" - так как самопроизвольные процессы передачи тепла всегда будут происходить, пока есть перепады температур.
7! Теплота подведенная к термодинамической системе расходуется на изменение внутренней энергии системы и на совершение механической работы против внешних сил.
dq=dU+ dl
изохорный процесс V-const (dV=0)
dq=dU dl=0
изобарный процесс
dq=dU+P*dv dl=P*dV
изотермический процесс
dq=dl=(mRT*ln(V2/V1))/M
8! Энтальпия-параметр состояния рабочего тела. Характеризует полный запас энергии рабочего тела.
U+PV=i- энтальпия
dq=dU-P*dV=dU+P*dV+V*dP-V*dP=dV+d(PV)-V*dP=di-VdP
dq=di-V*dP !!!!!! –первый закон термодинамики через энтальпию!
9! В круговых термодинамических процессах работа циклов равна разности подведенной и отведенной теплоты.
Второй закон термодинамики: в круговом термодинамическом процессе (цикле) не вся тепловая энергия подведенная от горячего источника превращается в механическую работу, часть ее отдается холодному источнику и оказывается потерянной.
Термодинамический цикл, в котором часть тепловой энергии превращается в механическую работу, в процессе передачи ее от горячего источника холодному называется ПРЯМЫМ.
Все прямые циклы отображаются на графике по часовой стрелке, по прямым циклам работают все тепловые двигатели.
Термодинамический цикл состоящий из обратимых процессов называется идеальным.
10! Энтропия – мера рассеивания энергии
dS=dq/T
энтропия отражает степень необратимости реального процесса.
Рост энтропии в необратимых процессах характеризует ту часть энергии тел, которая не может быть превращена в работу, а рассеивается в виде теплоты.
Сообщение телу теплоты сопровождает увеличение энтропии, а отнятие - уменьшение. В замкнутой термодинамической системе энтропия всегда возрастает в результате протекания в ней необратимых процессов.
В адиабатном термодинамическом процессе энтропия остается постоянной.
Энтропия зависит только от параметров состояния газа поэтому сама является параметром состояния газа.

11!


12!
dq=dU – первый закон термодинамики в изохорном процессе
13!

dq=dU+P*dV - первый закон термодинамики для изобарного процесса
14!

dq=dl=P*dv - первый закон термодинамики для изотермического процесса
15!

Адиабати́ческий, или адиаба́тный проце́сс — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством
16!
Второй закон термодинамики: в круговом термодинамическом процессе (цикле) не вся тепловая энергия подведенная от горячего источника превращается в механическую работу, часть ее отдается холодному источнику и оказывается потерянной.

17! Цикл Карно (1724 г)



18!


18!


20!


22!


23!
 На
рис. 11.14 дана схема ГТУ со сгоранием
топлива при постоянном объеме. В этой
установке сжатый в турбокомпрессоре 6 воздух
поступает из ресивера (сосуда большой
емкости для выравнивания давления) 7
через воздушный клапан 8 в
камеру сгорания 1, Сюда же топливным
насосом 5 через топливный клапан 9подается
жидкое топливо. Продукты сгорания,
пройдя через сопловой клапан 2, расширяются
в сопле 3 и
приводят во вращение ротор газовой
турбины 4.
На
рис. 11.14 дана схема ГТУ со сгоранием
топлива при постоянном объеме. В этой
установке сжатый в турбокомпрессоре 6 воздух
поступает из ресивера (сосуда большой
емкости для выравнивания давления) 7
через воздушный клапан 8 в
камеру сгорания 1, Сюда же топливным
насосом 5 через топливный клапан 9подается
жидкое топливо. Продукты сгорания,
пройдя через сопловой клапан 2, расширяются
в сопле 3 и
приводят во вращение ротор газовой
турбины 4.
![]()
![]()
 На
рисунке 11.15 и 11.16 на
На
рисунке 11.15 и 11.16 на ![]() –
и Ts – диаграммах изображен идеальный
цикл ГТУ с подводом теплоты при
–
и Ts – диаграммах изображен идеальный
цикл ГТУ с подводом теплоты при ![]() =
const. Рабочее тело с начальными
параметрами Р1,
=
const. Рабочее тело с начальными
параметрами Р1, ![]() 1,
Т1 сжимается
по адиабате 1-2 до
точки 2, давление
в которой определяется степенью повышения
давления. Далее по изохоре 2-3 к
рабочему телу подводится некоторое
количество теплоты q1,
затем рабочее тело расширяется по
адиабате 3-4 до
начального давления (точка 4) и
возвращается в первоначальное состояние
по изобаре 4-1, при
этом отводится теплота q2.
1,
Т1 сжимается
по адиабате 1-2 до
точки 2, давление
в которой определяется степенью повышения
давления. Далее по изохоре 2-3 к
рабочему телу подводится некоторое
количество теплоты q1,
затем рабочее тело расширяется по
адиабате 3-4 до
начального давления (точка 4) и
возвращается в первоначальное состояние
по изобаре 4-1, при
этом отводится теплота q2.
Характеристиками
цикла являются степень повышения
давления в компрессоре ![]() и
степень добавочного повышения давления
и
степень добавочного повышения давления ![]() .
.
Количество подводимой теплоты определяется по формуле
![]() ,
,
а количество отводимой теплоты – по формуле
![]() .
.
24!
3.4. Многовальные ГТУ
Основная идея - деление турбины на две и более ступеней с их независимым друг от друга числом оборотов, что позволяет регулировать мощность ГТУ при частичных нагрузках, не снижая эффективности изменением расхода и топлива, и воздуха.
В настоящее время существует тенденция к увеличению единичной мощности ГТУ. Наиболее просто вопрос о повышении единичной мощности решается в замкнутых ГТУ. Там это достигается путем соответствующего увеличения давления, а, следовательно, и массового расхода газа, циркулирующего в замкнутом контуре.
Вопрос о повышении единичной мощности, а такие экономичности в открытых ГТУ в настоящее время решается путем применения многовальных схем. Многовальные ГТУ дают возможность повысить эффективность ГТУ особенно при работе на частичных (неполных) нагрузках.
Пример

Рис. 1. Многовальная газотурбинная установка (ГТУ).
На рисунке представлена трёхвальная установка, широко используемая на компрессорных станциях ОАО «Газпром». Её особенностью является наличие двух ступеней компрессора и турбины, которые образуют газогенератор – компрессора низкого давления (КНД), компрессора высокого давления (КВД), турбины низкого давления (ТНД), турбины высокого давления (ТВД). Через входное устройство воздух поступает в КНД, частично сжимается в нём, затем поступает в КВД, где сжимается уже до требуемых параметров. Из КВД воздух поступает в камеру сгорания, в которой сжигается топливо, подводимое через форсунки. В ней воздух частично участвует в процессе горения, частично смешивается с продуктами горения топлива. Образовавшаяся газовоздушная смесь поступает в турбину двигателя, где её энергия преобразуется в механическую работу ТВД, ТНД, СТ, которые развивают мощность, необходимую для привода нагнетателя.
