
Биохимия растений
.pdf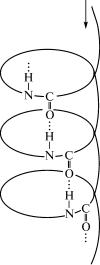
ную структуру, которую обычно называют конформацией белковой молекулы.
Пространственное же строение каждого отдельного участк˝а
полипептидной цепи представляет собой вторичную структуру белка.
Формирование вторичной структуры белковых молекул зави˝-
сит от физико-химических параметров аминокислотных оста˝тков
и их последовательности в полипептидной цепи. Как уже был˝о
отмечено, атомные группировки пептидной связи располага˝ются в одной плоскости, а каждая такая плоскостная структура сое˝диня-
ется с соседней через α-углеродные атомы аминокислотных ради-
калов ковалентными связями, вокруг которых возможно вращ˝е-
ние плоскостных структур пептидных связей. Угол поворота˝ по
каждой из этих связей для каждого аминокислотного остатк˝а вполне определенный, зависящий от строения аминокислотн˝ого
радикала. Если на конкретном участке молекулы полипептид˝а
группируются аминокислотные остатки с близкими углами в˝ра-
щения по указанным связям, то и формируется однотипная вт˝о-
ричная структура.
В стабилизации вторичной структуры полипептида важную роль играют водородные связи, возникающие между группировками пептидных
связей по следующей схеме:
=N—H.....O=C=
Одна из разновидностей вторичной
структуры белка — α-спираль, которая была установлена в 1951 г. Л. Полингом и Р. Кори методом рентгеноструктурного анализа. При формировании α-спирали
происходит спиралевидное закручивание
полипептидной цепи, которое стабилизируется за счет образования водородных связей, возникающих в определенном порядке между NH- и CO-группами пеп-
тидных связей, находящихся в соседних
витках спирали (рис. 5.2). NH-группа пептидной связи каждого аминокислотного остатка соединяется водородной
связью с CO-группой пептидной связи
другого аминокислотного остатка, удаленного в полипептидной цепи от перво-
го на четыре аминокислотных остатка,
считая назад по направлению цепи.
Рис. 5.2. Образование водородных связей при формировании α-структуры полипеп-
тидной цепи (стрелкой показано направление полипептидной цепи)
81
Водородные связи ориентированы вдоль оси спирали, при это˝м атомы кислорода, соединенные двойной связью с атомами угл˝ерода, обращены от них по спирали вперед, а атомы водорода, сое˝диненные с атомами азота, обращены от них по спирали назад. Бо˝-
ковые радикалы аминокислот также ориентированы вдоль ос˝и спирали по направлению, противоположному направлению по˝ли-
пептидной цепи (направление полипептидной цепи принято с˝чи- тать от N-конца к C-концу). Внутри α-спирали не образуется по-
лости, так как все пространство полностью занято группиро˝вками
пептидных связей и α-углеродных атомов. На поверхности α-ñïè-
рали находятся боковые радикалы аминокислот, которые мог˝ут
взаимодействовать как между собой, так и с веществами окр˝ужающей среды.
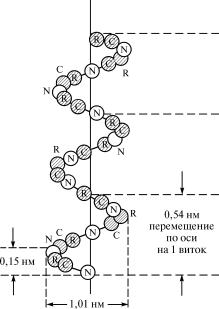
Большинство известных белков образуют α-спираль, у которой
спиралевидное закручивание полипептидной цепи происход˝ит по
направлению движения часовой стрелки. Расчеты показываю˝т,
что на каждый виток спирали приходится 3,6 аминокислотных о˝с- татка, а ход спирали при удлинении цепи на один аминокисло˝т-
ный остаток равен 0,15 нм. Диаметр условной цилиндрической
поверхности, на которой находятся α-углеродные атомы амино-
кислотных радикалов, составляет 1,01 нм (рис. 5.3).
Рис. 5.3. Структура α-спирали Полинга—Кори
82
Спиралевидная конфигурация вторичной структуры являетс˝я основной для фибриллярных белков, например белка волос, ш˝ерсти, перьев, рогов — кератина. Однако длина спирализованн˝ых участков глобулярных белков небольшая и обычно составля˝ет не-
сколько витков (3—4 оборота α-спирали). Спирализация полипептидной цепи возникает в том случае, когда на определен˝ном ее
участке группируются остатки α-аланина, лейцина, фенилалани-
на, тирозина, триптофана, цистеина, метионина, гистидина, ас˝парагина, глутамина, валина.
Довольно часто в структуре глобулярных белков встречают˝ся
изгибы и петли, поворачивающие пептидную цепь на определе˝н- ный угол. Наиболее характерной формой такой структуры явл˝яет-
ся так называемый β-изгиб, поворачивающий пептидную цепь
на 180°. Обычно β-изгиб включает 3—4 аминокислотных остатка, ключевым из которых является остаток аминокислоты гли˝-
öèíà.
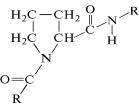
Остатки аминокислоты пролина вызывают излом образующей˝- ся α-спирали с отклонением от ее оси на угол 20—30°. Это объяс-
няется тем, что азот пролина, входящий в структуру пептидн˝ых
группировок, не связан с атомом водорода и поэтому не обра˝зует водородной связи. Изгиб полипептидной цепи при образован˝ии
пептидной связи с участием иминокислоты пролина можно пр˝едставить следующим образом:
Есть аминокислоты (серин, изолейцин, треонин, лизин, аргинин, аспарагиновая и глутаминовая кислоты), которые в соот˝ветствии со строением радикала формируют другой тип вторичн˝ой структуры, его называют β-структурой. В этой структуре водород-
ные связи образуются между CO- и NH-группами, находящимися в соседних отрезках полипептидной цепи, которые имеют пар˝ал-
лельную или противоположную направленность; в соответст˝вии с
ýòèì è β-структуры называют параллельными èëè антипараллельными.
83

(стрелками показаны направления полипептидных цепей)
84
В двух соседних цепях, формирующих β-структуру, в образовании водородных связей участвует половина CO- и NH-групп, что связано с чередованием пространственного расположения ˝аминокислотных радикалов. Боковые радикалы соседних аминокис˝лотных остатков находятся в транс-положении по отношению к пептидной группировке, поэтому в образовании водородных свя˝зей с соседней полипептидной цепью участвует каждая вторая пе˝птид-
ная группа. Оставшиеся свободными СО- и NН-группы могут образовывать водородные связи с аналогичными группами еще˝ одной цепи с противоположной стороны, а она со следующей пеп˝-
тидной цепью и т. д. Таким образом, с помощью водородных свя˝- зей могут быть соединены несколько пептидных цепей (2—10) протяженностью до восьми аминокислотных остатков вдоль˝ каждой из цепей, а у некоторых даже больше.
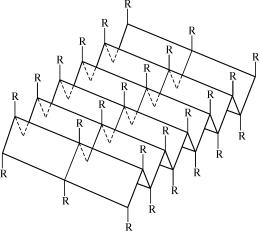
Отходящие в противоположные стороны от каждой полипептидной цепи радикалы аминокислотных остатков образуют п˝оверхности, имеющие складчатое строение. Складки этих поверхно˝стей
определяются углами связей α-углеродных атомов аминокислотных остатков (рис. 5.4). Очень часто поверхность β-структуры закручивается под определенным углом, образуя уже супервтор˝ичную структуру.
Вторичная структура полипептидов в виде α-спирали и β-струк-
тур относится к структурам, которые периодически повторяют в пространстве свои конфигурации, в связи с чем их называют˝регулярными структурами. Однако практически в каждой белковой молекуле имеются участки с вполне определенной простран˝ствен-
Рис. 5.4. Схематическое изображение трех полипептидных цепей, образующих β-структуру в виде складчатого слоя (над и под поверхностью˝ складчатого слоя нахо-
дятся радикалы аминокислотных остатков)
85
ной конфигурацией, но она не повторяется в других участка˝х. Такие разновидности вторичной структуры белка принято наз˝ывать
нерегулярными структурами.
Каждый белок в зависимости от первичной структуры, опреде˝-
ляющей набор и последовательность аминокислотных остат˝ков в его полипептидных цепях, содержит вполне определенные гр˝уп-
пировки аминокислот на отдельных участках молекулы, кото˝рые в зависимости от их физико-химических параметров способны˝ фор-
мировать тот или иной тип вторичной структуры. Поэтому в д˝ан-
ном белке в соответствии с последовательностью соединен˝ия ами-
нокислотных остатков на каждом участке реализуется сове˝ршенно
определенный тип вторичной структуры.
Известно очень мало белков с одинаковой вторичной структ˝у-
рой на всех участках молекулы. К таким белкам относятся ке˝ратин
(структурный белок шерсти, перьев, рогов) и коллаген (белок˝ су-
хожилий), имеющие конфигурацию молекулы в виде α-спирали,
а также белки шелка (фиброин) и семян канавалии (конканавалин А), образующие преимущественно β-структуры. Большинство
же белков формируют смешанный тип вторичной структуры,
включающий на конкретных участках молекулы и α-спираль, и
β-структуры, и нерегулярные структуры. Так, например, в белке˝
миоглобине 79 % составляющих его аминокислотных остатков ˝образуют вторичную структуру в виде α-спирали, 16 % приходится
на участки с нерегулярной структурой и 5 % участвуют в обра˝зова-
íèè β-изгибов. В растительном белке папаине 28 % вторичной
структуры представлено α-спиралями, 14 — β-структурами, 17 —
β-изгибами и 41 % — нерегулярными структурами.
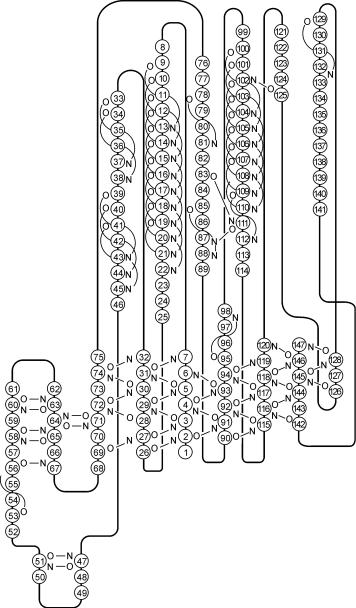
На рисунке 5.5 показана схема возможного образования вторичных структур на одном из участков полипептидной цепи ф˝ер-
ментного белка глицеральдегидфосфатдегидрогеназы. Как ˝видно из представленной схемы, последовательности аминокисло˝тных остатков 9 → 22, 33 → 45, 78 → 81, 85 → 88, 95 → 98, 100 → 112, 129 → 133 образуют спиралевидную вторичную структуру, тогда
как аминокислотные последовательности 1 → 7, 26 → 32, 56 → 75,
90 → 94, 115 → 120, 126 → 128, 142 → 147 — β-структуры, другие аминокислотные остатки участвуют в формировании изгибо˝в и нерегулярных структур.
Третичная структура белков. Порядок размещения в простран-
стве всех атомных группировок полипептидной цепи принят˝о на-
зывать третичной структурой белковой молекулы. Впервые понятие о третичной структуре белков было сформулировано в 1958 ˝г. Д. Кендрью на основе рентгеноструктурного анализа прост˝ран-
ственной конфигурации белка миоглобина, в результате чег˝о уда-
лось выяснить трехмерную структуру этого белка.
В процессе дальнейших исследований было установлено, что˝ в
86
связываюбелка
толстой линией показано направление полипептидной цепи, тонкими˝ линиями — водородные связи в α-спиралях и β-структурах
87

построении третичной структуры белка важную роль играют˝ нековалентные взаимодействия между радикалами аминокислотн˝ых остатков, находящимися на поверхности вторичных структу˝р, а также дисульфидные связи, возникающие в результате взаим˝одей-
ствия сульфгидрильных групп (—SH) остатков аминокислоты ци˝- стеина. При формировании третичной структуры реализуютс˝я три
типа нековалентных взаимодействий: образование водород˝ных связей, электростатические и гидрофобные взаимодействи˝я.
Водородные связи соединяют между собой функциональные
группы боковых цепей аминокислотных остатков:
Насыщенность белковой молекулы водородными связями вес˝ь-
ма велика — не менее 90 % от возможного их образования. Важн˝ое
значение для стабилизации третичной структуры белков им˝еют также водородные связи, которые образуют группировки пол˝и-
пептидов с молекулами воды, формирующими жидкую фазу бел-˝
кового раствора.
Между заряженными группировками аминокислотных остат-
ков возникают силы электростатического взаимодействия:˝
R—COO–....Í3+N—R
Формированию компактной пространственной структуры в
значительной степени способствуют гидрофобные взаимоде˝й-
ствия между неполярными группировками боковых радикало˝в аминокислот, входящих в состав полипептидной цепи. В резу˝льтате гидрофобных взаимодействий происходит отталкивани˝е молекул воды от поверхности гидрофобных группировок и сбли˝же-
ние последних, вследствие чего полипептидная цепь сверты˝вается
в виде глобулы. При этом большая часть гидрофобных радика˝лов оказывается внутри глобулы и таким образом защищается от˝ контакта с молекулами воды, а гидрофильные радикалы, наоборо˝т, находятся на поверхности белковой глобулы, они образуют в˝одо-
родные связи с молекулами воды и стабилизируют пространс˝твен-
ную структуру белка.
К аминокислотам, имеющим гидрофобные радикалы, относятся глицин, лейцин, изолейцин, валин, аланин, фенилаланин, ци˝с-
теин, метионин. Гидрофильные радикалы содержат аминокисл˝от-
ные остатки треонина, серина, триптофана, тирозина, аспара˝гина
и аспарагиновой кислоты, глутамина и глутаминовой кислот˝ы,
лизина, гистидина.
88
Образующаяся в результате гидрофобных взаимодействий п˝ространственная структура полипептида имеет довольно пло˝тную упаковку, вследствие чего ее очень часто называют гидрофобным ядром белковой молекулы. Вокруг ядра формируется оболочка из
гидрофильных аминокислотных остатков, в которые могут бы˝ть включены и гидрофобные радикалы, образующие гидрофобные˝
выходы на поверхность белковой глобулы. За счет формирова˝ния таких структур обеспечивается специфичность взаимодейс˝твия
белковой молекулы с веществами окружающей среды. В состав˝
гидрофильной оболочки, окружающей гидрофобное ядро, вход˝ят
также молекулы воды, связанные водородными связями с поля˝р-
ными группировками белковой молекулы.
У многих белков важным фактором стабилизации третичной
структуры служат дисульфидные связи, которые образуются˝ при
взаимодействии остатков цистеина по такому же механизму˝, как и
при формировании димеров глютатиона (см. с. 78). Однако обра-˝
зование дисульфидных связей не является обязательным ус˝ловием стабильности третичной структуры белка, так как известно˝ до-
вольно много белков, формирующих устойчивую пространств˝ен-
ную структуру только за счет нековалентных взаимодействий.
При формировании третичной структуры белка может возни-
кать не одно, а два гидрофобных ядра и более, включающих дос˝таточно большие участки одной и той же полипептидной цепи.
Между этими ядрами образуются впадины и полости, играющие˝
важную роль в функционировании белка.
Третичная структура полипептидов складывается из элеме˝нтов
вторичной структуры. Так, в составе ряда белков третичная˝ структура представлена только α-спиралями, которые размещаются в пространстве в виде параллельных участков. Вместе с тем и˝звест-
ны белки, построенные в основном из β-структур, свернутых в пространстве под определенным углом. Однако у многих белк˝ов пространственная конфигурация молекулы формируется в в˝иде смешанных структур, включающих определенные сочетания α-ñïè-
ралей и β-структур. При этом довольно часто внутренняя часть
молекулы полипептида представлена β-структурами, которые на поверхности окружены α-спиралями.
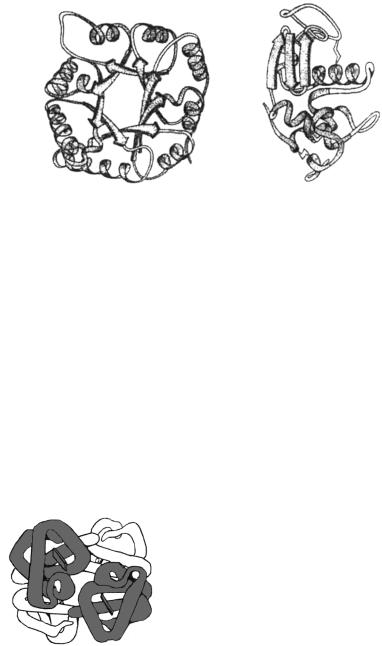
На рисунке 5.6 показана третичная структура ферментных белков триозофосфатизомеразы и лизоцима. В молекуле триозофосфат-
изомеразы в центральной части представлены β-слои, которые
окружены α-спиралями. В лизоциме часть третичной структуры (в верхней части рисунка) образована в виде β-структур, а другая часть (в нижней части рисунка) представлена α-спиралями.
Для существующих в природе белков установлено строгое со˝от-
ветствие между первичной и третичной структурами полипе˝пти-
дов. Последовательность аминокислотных остатков в полип˝ептид-
89
1 2
Рис. 5.6. Схема третичных структур ферментных белков триозо˝фосфатизомеразы 1() и лизоцима (2)
ной цепи предопределяет ее пространственную конфигурац˝ию. Этот принцип подтверждается в опытах по конструированию˝ ами-
нокислотных последовательностей полипептидов, способны˝х
формировать пространственную структуру заданного типа.˝
Четвертичная структура белков. Многие белки представляют
собой сложные молекулы, образующиеся при нековалентном взаимодействии двух или нескольких полипептидов, каждый из
которых имеет свою третичную структуру. Такие белки приня˝то
называть олигомерами, а образующие их полипептиды — полипептидными субъединицами белка. Способ совместной упаковки и раз-
мещения в пространстве полипептидных субъединиц олигом˝ер-
ных белков называют четвертичной структурой белка.
Впервые четвертичную структуру белка установили методо˝м рентгеноструктурного анализа при изучении пространстве˝нной
конфигурации молекул гемоглобина (Перутц М., 1959). В этих ис-
следованиях было определено, что молекула гемоглобина со˝стоит из четырех субъединиц: двух α-полипептидных цепей по 141 аминокислотному остатку в каждой и двух β-цепей по 146 аминокис-
|
|
лотных остатков в каждой. Субъеди- |
|
β2 |
β1 |
ницы гемоглобина размещаются в |
|
пространстве симметрично, занимая |
|||
|
|
||
|
|
вершины тетраэдрической структуры |
|
|
|
(ðèñ. 5.7). |
|
α2 |
α1 |
Рис. 5.7. Схема четвертичной структуры |
|
молекулы гемоглобина: |
|||
|
α1, α2, β1, β2 — отдельные полипептиды, образующие молекулу гемоглобина
90
