
Биохимия растений
.pdf
В молекуле гемоглобина наблюдается более сильное взаимо˝- действие между разными субъединицами и относительно сла˝бее выражена связь между одноименными субъединицами, вследс˝твие чего образуются довольно устойчивые димеры разных субъе˝диниц
(αβ), из которых уже формируется структура тетрамерной молек˝у- лы за счет более слабых взаимодействий. Такой порядок вза˝имо-
действия субъединиц гемоглобина приводит к образованию˝ совершенно однотипных молекул α2β2, тогда как другие сочетания
субъединиц неустойчивы.
Если характер взаимодействия между всеми субъединицами˝
олигомерного белка одинаковый, то возможно возникновени˝е мо-
лекул с разным набором полипептидов. Так, например, у тетра˝мера, молекулы которого образуются из двух типов субъединиц˝ А и
Б, формируются олигомеры следующего состава: А4, À3Á, À2Á2,
ÀÁ3, Á4. Все они представляют собой близкие по структуре белки,
выполняющие одну и ту же функцию в организме. Молекулы оли˝-
гомерного белка, построенные из разных полипептидных суб˝ъединиц и выполняющие одну и ту же биологическую функцию,
принято называть множественными молекулярными формами èëè
изоформами данного белка.
Соединение полипептидных субъединиц в олигомерные моле˝-
кулы происходит за счет нековалентных взаимодействий. Ва˝жную роль играют водородные связи, которые образуются между на˝кла-
дывающимися элементами β-структур, входящих в состав белко-
вых субъединиц, а также в результате взаимодействия радик˝алов
аминокислот, имеющих группировки:
При рассмотрении третичной структуры белков было показа˝но, что в поверхностной оболочке, окружающей гидрофобное ядр˝о, также содержится много гидрофобных радикалов аминокисл˝от, которые в результате сближения поверхностей третичных с˝трук-
тур двух субъединиц вступают в гидрофобные взаимодейств˝ия, что
вносит существенный вклад в формирование четвертичной с˝труктуры белков. Причем у некоторых белков гидрофобные взаимодействия являются главными факторами формирования их че˝т- вертичной структуры. Так, у ряда регуляторных белков имею˝тся
характерные последовательности аминокислотных остатко˝в, в которых с определенной частотой встречается гидрофобный ради-
кал лейцина (в одном и том же положении через каждые два ви˝т- ка α-спирали). В результате взаимодействия двух субъединиц пр˝о-
исходит гидрофобное совмещение их спиралевидных конфиг˝ура-
ций и образование двойной спирали, соединяющей данные
91
субъединицы в одну молекулу. Такой тип гидрофобного взаим˝о- действия между полипептидами белка получил название лейциновых петель.
Важными факторами формирования четвертичной структуры
белков служат электростатические взаимодействия между ˝заряженными группировками соседних субъединиц, представлен˝ными
радикалами дикарбоновых (аспарагиновая и глутаминовая к˝ислоты) и диаминомонокарбоновых (лизин, аргинин) кислот. Таким˝
образом, в результате совместного действия всех указанны˝х фак-
торов образуется достаточно устойчивая пространственна˝я струк-
тура олигомерной молекулы белка.
Наиболее часто четвертичная структура белков представл˝ена димерами, тримерами, тетрамерами и гексамерами, хотя изве˝стны
белки, содержащие в молекуле 8, 12, 24 и более субъединиц. Био-
логическая роль четвертичной структуры белков заключае˝тся в
том, что путем соединения сравнительно небольших структу˝рных
элементов оказывается возможным формирование более сло˝жных структур, обеспечивающих белку большую лабильность, спос˝об-
ность выполнять конкретную биологическую функцию, возмо˝ж-
ность совмещать в одной пространственной структуре неск˝олько
функционально активных центров.
5.2.КОНФОРМАЦИЯ БЕЛКОВЫХ МОЛЕКУЛ
Âклетках живого организма при определенных температуре˝, pH и концентрации физиологической среды белковые молекулы˝
образуют термодинамически наиболее устойчивую в этих ус˝ловиях пространственную структуру, обеспечивающую выполнение белком его биологической функции. Такую пространственну˝ю структуру называют нативной конформацией белковой молекулы.
При изменении физиологических условий молекулы белков
могут обратимо модифицировать свою нативную конформаци˝ю, при этом меняется и их биологическая активность. Обратимые изменения нативной конформации белков (перестройка их про-˝ странственной структуры) имеют важное значение для регул˝яции
ферментативной активности, транспорта ионов и метаболит˝ов
через мембраны, регулирования проницаемости клеточных м˝ембран.
Как указывалось ранее, образование пространственной стр˝ук-
туры белков определяется генетически детерминированной˝ после-
довательностью соединения аминокислотных остатков в по˝липептидных цепях. Следовательно, нативная конформация бел˝ка
зависит от его первичной структуры. Но вместе с тем для фор˝ми-
рования нативной конформации белка требуется и весь набо˝р
92
факторов внутренней физиологической среды данной клетк˝и (определенное значение pH, присутствие тех или иных ионов и дру˝-
гих кофакторов).
Построение пространственной структуры белковой молекул˝ы происходит в процессе ее синтеза по мере удлинения полипе˝птидной цепи, что, вероятно, и предопределяет последовательно˝сть
взаимодействия группировок при формировании вторичной ˝и
третичной структуры синтезируемого полипептида. В специ˝альных опытах показано, что в белковой молекуле присутствуют˝ ами-
нокислотные остатки, которые являются активными инициат˝ора-
ми нековалентных взаимодействий, облегчающих формирова˝ние промежуточных структур в процессе перехода белка к натив˝ной
конформации.
В правильном построении пространственной структуры бел˝ковых молекул участвуют специализированные белки — шапероны.
Особенно много таких белков синтезируется в стрессовых у˝слови-
ях. Они образуют комплексы с полипептидными цепями, предо˝т- вращая их агрегацию в процессе формирования вторичной и т˝ре-
тичной структуры. Один из участков белка-шаперона нековал˝ент-
но связывается с развернутой полипептидной цепью, а друго˝й присоединяет АТФ. При гидролизе АТФ шаперон переходит в
другое конформационное состояние и его комплекс с формир˝ую-
щим пространственную структуру полипептидом распадаетс˝я. Известны и другие белки — катализаторы формирования пр˝о-
странственной структуры полипептидов. Так, в клетках высш˝их
организмов обнаружен фермент протеиндисульфидизомераза, катализирующий правильное образование дисульфидных связей ˝при
формировании третичной структуры полипептидов. Он предс˝тавляет собой димерный белок, содержащий в активном центре о˝с- татки аминокислоты цистеина.
Лимитирующей стадией в построении нативной конформации˝ белка может быть переход группировок пептидных связей из˝öèñ- â транс-конфигурацию. Особенно медленно проходит öèñ-транс- изомеризация группировок пептидных связей, образованны˝х иминогруппой пролина. Для ускорения таких превращений в клет˝ках организмов имеется специальный фермент пролил-öèñ-транс-èçî- мераза.
Характерные особенности пространственной конфигурации˝ гомологичных белковых молекул, выполняющих одну и ту же
функцию у разных организмов, определяются наличием одина˝ко-
вых аминокислотных остатков в ключевых положениях, сильн˝о
влияющих на конформацию молекулы, тогда как в других поло˝жениях могут находиться разные аминокислотные остатки. Но о˝ни
слабее влияют на конформацию молекулы.
93
Весьма характерное строение имеют мембранные белки, кото˝- рые, как правило, содержат трансмембранные фрагменты в ви˝де α-спиралей; от них отходят внемембранные полипептиды, обес˝пе- чивающие связь с окружающей физиологической средой. Тран˝с-
мембранные полипептидные фрагменты могут быть образова˝ны и в виде β-структур. Основные функции мембранных белков —
транспорт молекул и ионов через мембрану, межклеточные вз˝аимодействия, образование ионных каналов, передача внешних˝ сиг-
налов в клетку и др.
Под влиянием сильнодействующих факторов (высокая темпе-
ратура, экстремальные значения pH, присутствие катионов тя˝же-
лых металлов, применение органических растворителей и де˝тергентов) может происходить разупорядочивание системы вод˝ород-
ных связей, электростатических и гидрофобных взаимодейс˝твий в
молекулах белков, что вызывает существенное изменение их˝ вто-
ричной и третичной структуры, приводящее к утрате нативно˝й
конформации. При этом белок уже не может выполнять свойст˝- венную ему биологическую функцию. Необратимое изменение˝
пространственной структуры белковых молекул, которое со˝про-
вождается потерей их нативных свойств, называют денатурацией
белков.
Наглядным примером денатурации является тепловая денат˝у- рация белков. При повышении температуры возрастает ампли˝туда
колебаний атомов, что приводит к разрыву водородных связе˝й и
ослаблению электростатических взаимодействий в молекул˝ах бел-
ков, в результате чего происходит необратимое свертывани˝е и
осаждение белков из раствора. Большинство белков подверг˝аются денатурации при температуре 70—80 °C. Однако некоторые белки˝ отличаются довольно высокой термостабильностью. Так, нап˝ри-
мер, ферменты термофильных бактерий сохраняют каталитич˝ескую активность при температуре 80 °C.
Известны вещества, стабилизирующие нативную структуру белковых молекул, и их присутствие в растворе повышает те˝мпе-
ратуру денатурации белков. К таким веществам относятся во˝дорас-
творимые соли, содержащие катионы кальция (Ca2+). Денатурация белков может происходить в сильнокислой или˝
сильнощелочной среде. В сильнокислой среде практически п˝олностью подавляется диссоциация карбоксильных групп ами˝но-
кислотных радикалов дикарбоновых кислот и заряд белково˝й мо-
лекулы определяется положительными зарядами радикалов ˝диаминомонокарбоновых кислот, взаимное отталкивание котор˝ых вызывает разрыв водородных связей и ослабление электрос˝тати-
ческих взаимодействий, стабилизирующих третичную струк˝туру
молекулы. В результате белки утрачивают нативную конформ˝а-
цию и подвергаются коагуляции (осаждению).
94
В сильнощелочной среде (pH > 11) утрачивается положительный заряд радикалов диаминомонокарбоновых кислот и заря˝д белковой молекулы определяется отрицательными зарядами˝ карбоксильных групп дикарбоновых аминокислот, взаимное отт˝алки-
вание которых вызывает разрыв водородных связей и ослабл˝ение электростатических взаимодействий в молекуле, вследств˝ие чего
происходят существенное изменение пространственной структуры и денатурация белка.
Сильным денатурирующим действием обладают катионы тяже˝-
лых металлов, трихлоруксусная, хлорная, вольфрамовая и не˝кото-
рые другие кислоты, которые образуют с белками нераствори˝мые
ñîëè.
Некоторые органические растворители (спирт, ацетон, форм˝а-
мид) способны взаимодействовать с гидрофобными радикала˝ми
аминокислотных остатков белков и с молекулами воды, вызыв˝ая
ослабление гидрофобных взаимодействий и разрыв водород˝ных
связей, стабилизирующих третичную структуру полипептид˝ов, в результате чего происходит денатурация белковых молеку˝л.
Для изучения структуры белков используют специальные ве˝-
щества, вызывающие нарушение пространственной структур˝ы по-
липептидов — высокие концентрации мочевины (6—8 М) и соля˝-
нокислого гуанидина (6 М), ионные детергенты, β-меркаптоэта- нол, янтарный ангидрид.
При повышении концентрации мочевины в растворе белка
усиливается конкуренция CO- и NH2-групп мочевины за образо-
вание водородных связей с пептидными и другими функциона˝ль-
ными группами белка, что дестабилизирует систему внутрим˝олекулярных водородных связей и инициирует переход белково˝й молекулы от нативной к денатурированной структуре. Группир˝овки
мочевины могут также образовывать водородные связи с мол˝екулами воды и таким образом ослаблять гидрофобные взаимоде˝й- ствия в молекуле белка, стабилизирующие его третичную стр˝уктуру. Выяснено, что для денатурации конкретного белка необх˝одима
определенная концентрация мочевины.
Солянокислый гуанидин [H2N+=C(NÍ2)2]Cl–, как и мочевина, нарушает в белке систему внутримолекулярных водородных˝ связей и ослабляет гидрофобные взаимодействия между радика˝лами аминокислотных остатков. Кроме того, являясь сильным осно˝ва-
нием, он ослабляет электростатические взаимодействия, ст˝абили-
зирующие третичную структуру молекулы белка.
Гидрофобная цепь ионного детергента — додецилсульфата˝ натрия H3(CH2)11OSO3Na взаимодействует с гидрофобными радика-
лами аминокислотных остатков полипептидов и при концент˝рации
не менее 0,5 мМ практически полностью развертывает третич˝ную
структуру белка, образуя палочковидные денатурированные комп-
95
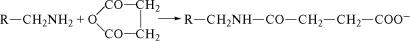
лексы с равномерной плотностью отрицательного заряда су˝льфатных групп (с 1 г белка связывается 0,4 г детергента). При этом о˝лигомерные белки распадаются на составляющие их полипепти˝дные субъединицы. Для разрыва дисульфидных связей их подверга˝ют
восстановлению β-меркаптоэтанолом или дитиотрейтолом. С целью усиления действия детергента к белковому раствору до˝бавляют
мочевину и проводят денатурацию белков при температуре 10˝0 °C. Янтарный ангидрид присоединяется к аминным группам лизи˝-
на, заменяя их положительный заряд на отрицательный:
При этом на контактирующих поверхностях полипептидных
субъединиц концентрируется одноименный отрицательный з˝аряд,
вызывая их разъединение за счет электростатического отт˝алкивания. В результате олигомерный белок диссоциирует на соста˝вляю-
щие его полипептидные субъединицы.
При денатурации белков очень часто происходит химическа˝я
модификация аминокислотных остатков. Так, под воздействи˝ем
мочевины наблюдается карбомилирование аминогрупп лизин˝а (R—CH2NH—CO—NH2). В кислой среде происходит гидролиз
амидных связей аспарагина и глутамина, в щелочной среде —˝ рас-
щепление остатков цистина с образованием дегидроаланин˝а.
В денатурированном состоянии происходит ухудшение или п˝о-
теря белками растворимости, снижаются гидрофильность и в˝одопоглотительная способность, а также их способность к набу˝ха-
нию, в результате чего белки уже не могут выполнять свою би˝ологическую функцию. Например, при длительном хранении семен˝-
ного материала уменьшается гидрофильность белков, вслед˝ствие
чего понижается способность семян к прорастанию.
Установлено, что денатурация белков в растворе или во вла˝ж- ном состоянии происходит значительно легче и быстрее, чем˝ в высушенном, и это используется при разработке технологий˝ суш-
ки биологического материала и различных растительных пр˝одук-
тов (зерна, макарон, овощей и фруктов). Сведения о денатурац˝ии белков также учитывают при выпечке хлеба и кондитерских и˝зделий, производстве консервов и других пищевых продуктов.
5.3. РАЗМЕРЫ И ФОРМЫ БЕЛКОВЫХ МОЛЕКУЛ
Определенные представления о пространственном строении˝ и
форме белковых молекул были получены в исследованиях с ис˝-
пользованием электронного микроскопа. У многих белков фо˝рма
96
молекул компактна. Они представляют шарообразные или выт˝я- нутые в виде эллипсоида частицы диаметром 10—30 нм. Кроме того, белковые молекулы могут быть вытянуты в виде нитей д˝иаметром 5—15 нм и длиной несколько сотен нанометров или обра-˝
зуют палочковидные структуры диаметром 10—20 нм и длиной 100—300 нм.
Для определения формы молекул белков в растворе чаще всег˝о измеряют вязкость белкового раствора, о которой судят по ˝умень-
шению скорости истечения белкового раствора через капил˝ляр-
ную трубку по сравнению с аналогичным показателем раство˝рите-
ля. Если форма белковых молекул близка к сферической, то ск˝о-
рости истечения белкового раствора и растворителя через˝ капилляр мало отличаются друг от друга. Однако для белков с
удлиненной формой молекул вязкость раствора заметно воз˝раста-
ет, что может быть использовано в качестве меры асимметри˝и мо-
лекулы.
О форме белковых молекул в растворе можно также судить по˝ скорости их диффузии в растворителе или по способности мо˝ле-
кул белков рассеивать свет.
Наиболее точные сведения о пространственном строении бе˝л-
ков были получены методом рентгеноструктурного анализа˝, с по-
мощью которого изучают структуру белковых молекул в крис˝таллическом состоянии. Оказалось, что в белковых кристаллах ˝пол-
ностью сохраняется нативная конформация молекулы, котор˝ая
стабилизируется большим |
количеством |
|
кристаллизационной воды. |
|
|
Длинные белковые молекулы нитевид- |
|
|
ной формы принято называть фибрилляр- |
|
|
ными белками. Они содержат длинные па- |
|
|
раллельные полипептидные цепи, скреп- |
|
|
ленные поперечными связями (рис. 5.8). |
|
|
Эти белки отличаются высокой механи- |
|
|
ческой прочностью и обычно выполняют |
|
|
структурную функцию. К фибриллярным |
|
|
белкам относятся коллаген |
сухожилий, |
|
миозин мышц, фиброин шелка, кератин |
|
|
волос и перьев. |
|
|
Молекулы со сферической формой на- |
|
|
зывают глобулярными белками. Èõ ïîëè- |
|
|
пептидные цепи свернуты в глобулы, име- |
|
|
ющие форму эллипсоида вращения разной |
|
|
степени вытянутости. К глобулярным бел- |
Рис. 5.8. Схема строения |
|
кам относятся ферменты, регуляторные и |
фибриллярного белка: |
|
транспортные белки, запасные раститель- |
двойная спираль кератина — |
|
ные белки. |
|
основного структурного белка |
|
волос и перьев |
|
|
|
|
97
На поверхности молекул глобулярных белков имеются склад˝ки и довольно глубокие полости, и низкомолекулярные веществ˝а мо-
гут проникать в них и взаимодействовать с внутримолекуля˝рными
группировками, что очень важно для выполнения белком его ˝биологической функции. Хотя гидрофобное ядро белковой молек˝улы плотно упаковано, возможны обратимые локальные изменени˝я
вторичной и третичной структуры, в результате которых бел˝ок
приобретает необходимую лабильность. Аминокислотные ос˝татки на поверхности белковой молекулы более подвижны, чем в ги˝дро-
фобном ядре, и поэтому легко смещаются при взаимной подго˝нке
поверхностей глобул в процессе формирования четвертичн˝ой структуры белков.
Между глобулярными и фибриллярными конформациями бел-
ковых молекул имеется много переходных форм, характерных˝ для многих белков.
В связи с большими различиями форм белковых молекул и вы-
сокой степенью их полимерности при определении молекуля˝рных масс белков возникают существенные трудности, поэтому дл˝я
этих целей разработаны специальные методы исследований˝. Мо-
лекулярные массы хорошо растворимых и очищенных от приме˝- сей белков могут быть определены с довольно высокой точно˝стью
по изменению осмотического давления белкового раствора˝. На-
блюдается обратная зависимость между молекулярной массой белков и осмотическим давлением их растворов.
Молекулярные массы кристаллических форм хорошо очищен-
ных белков с высокой степенью точности определяют методо˝м рентгеноструктурного анализа.
При определении молекулярных масс белков очень часто используют седиментационный анализ, основанный на измерен˝ии скорости седиментации (осаждения) молекул белков под дей˝ствием центробежной силы, возникающей при высокоскоростном центрифугировании белкового раствора. Первая установка˝ для высокоскоростного центрифугирования (ультрацентрифуга˝) была сконструирована Т. Сведбергом и Д. Б. Никольсом в 1923 г. В современных ультрацентрифугах можно создавать центробежн˝ое ускорение более 500 000 g. Под действием центробежной силы молекулы белка, равномерно распределенные в растворе, начинаю˝т перемещаться в направлении ее действия с определенной скор˝остью, образуя удаляющуюся от центра вращения границу разде˝ла
между осаждающимися белками и чистым растворителем. Поло˝-
жение границы раздела через определенные промежутки вре˝мени
регистрируется с помощью оптической системы, и на основе ˝этих измерений определяется коэффициент седиментации, который и
выражает скорость седиментации белков.
98
По мере возрастания молекулярной массы белка коэффициен˝т седиментации увеличивается, однако строго прямой зависи˝мости
между этими показателями не наблюдается, так как скорость˝ се-
диментации зависит также от формы молекул.
Коэффициент седиментации выражают в единицах сведбергах, которые обозначают символом S. Один сведберг (1 S) численно
равен 1 · 10–13 с. Для большинства растительных белков коэффи-
циенты седиментации находятся в пределах 1—20 S.
На основе коэффициентов седиментации и диффузии белко-
вых молекул рассчитаны молекулярные массы многих белков˝, вы-
деленных из различных объектов:
Рибонуклеаза |
12 640 |
α-Амилаза |
97 600 |
Гемоглобин |
64 500 |
Каталаза |
247 500 |
Глиадин пшеницы |
27 500 |
Эдестин конопли |
300 000 |
Альбумин яйца |
44 000 |
Уреаза сои |
483 000 |
Зеин кукурузы |
50 000 |
Пепсин |
35 500 |
Для определения молекулярных масс полипептидов, входящи˝х
âсостав олигомерных белков, широко применяют метод элект˝рофореза заряженных частиц в полиакриламидном геле, которы˝й
позволяет проводить очень точное разделение полипептид˝ов под
воздействием электрического поля.
Под влиянием электрического поля заряженные молекулы по˝-
липептидов движутся к аноду или катоду через пористый нос˝и-
тель — полиакриламидный гель, образующийся при совмест˝ной полимеризации акриламида и бисакриламида в определенно˝й бу-
ферной среде. Этот гель сильно гидратирован и имеет поры определенных размеров в зависимости от соотношения акрилами˝да и бисакриламида. Скорость движения заряженных частиц в пор˝истом носителе зависит от величины заряда, молекулярной мас˝сы и пространственной конфигурации молекул, поэтому в резуль˝тате электрофореза разделяемые частицы, различающиеся по эле˝ктри- ческому заряду и пространственным параметрам, распредел˝яются
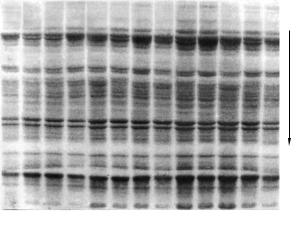
âполиакриламидном геле в виде узких зон, которые окрашив˝ают специальным красителем. Размеры окрашенных зон точно ука˝зывают концентрацию выделенных при электрофорезе полипеп˝тидов, а их общее число — наличие в изучаемой смеси разных п˝олипептидов (рис. 5.9).
Выделение из белков полипептидов осуществляют под возде˝й-
ствием анионного детергента — додецилсульфата натрия и восста-
новителя дисульфидных связей β-меркаптоэтанола. Под влиянием этих денатурирующих агентов олигомерные белки распадаю˝тся на
составляющие их полипептидные субъединицы, превращаясь˝ в
99
–
+
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
Рис. 5.9. Разделение полипептидов водо- и солерастворимых бе˝лков зерна пшеницы методом электрофореза в полиакриламидном геле (стрелкой показано направление движения полипептидов при электрофорезе):
1—13 — образцы полипептидов разных сортов пшеницы
отрицательно заряженные палочковидные структуры, длина˝ которых зависит от длины полипептидной цепи и, следовательно,˝ в
этих условиях является характеристикой молекулярной ма˝ссы по-
липептидов.
Гидрофобные радикалы детергента, взаимодействуя с радика-
лами гидрофобных аминокислот, равномерно связываются с п˝о-
липептидной цепью, которая за счет анионных групп детерге˝нта приобретает довольно высокий отрицательный заряд, много˝крат-
но превышающий собственный заряд полипептида, вследстви˝е
чего при электрофорезе он существенной роли не играет. По˝этому в присутствии додецилсульфата натрия общий заряд полипе˝птида определяется зарядом детергента и длиной полипептидной цепи, с которой равномерно связывается заряженный детергент. В с˝вою
очередь, длина полипептидной цепи определяет величину ее˝ мо-
лекулярной массы.
Таким образом, при электрофорезе полипептидов в присутствии анионного детергента додецилсульфата натрия прои˝сходит их разделение в зависимости от величины молекулярной мас˝сы. Полипептиды с меньшей молекулярной массой движутся в эле˝кт-
рическом поле быстрее, так как при прохождении через поры˝ но-
сителя испытывают меньшее сопротивление, чем более крупн˝ые полипептиды. Чтобы рассчитать точную величину молекуляр˝ной
массы изучаемого полипептида, электрофорезу подвергают˝ смесь
100
