
- •Министерство образования и науки Российской Федерации
- •Общие методические указания
- •Студент, не сдавший ргр, до экзамена (зачёта) не допускается.
- •1.1.1 Теоретические пояснения
- •1.1.2 Примеры решения типовых задач
- •1.1.3 Варианты задач по теме 1.1
- •1.2. Основные законы химии
- •1.2.1 Стехиометрические законы
- •1.2.2 Газовые законы химии
- •1.2.3 Варианты задач по теме 1.2
- •2.1.1 Химическая кинетика
- •2.1.1.1 Теоретические пояснения
- •2.1.1.2 Примеры решения типовых задач
- •2.1.1.3 Варианты задач по теме 2.1.1
- •2.1.2 Химическое равновесие
- •2.1.2.1 Теоретические пояснения
- •2.1.2.2 Примеры решения типовых задач
- •2.1.2.3 Варианты задач по теме 2.1.2
- •2.2. Растворы
- •2.2.1 Теоретические пояснения
- •II. Концентрационный способ:
- •2.2.2 Примеры решения типовых задач
- •2.2.3 Варианты задач по теме 2.2
- •Рекомендуемая литература
1.2.2 Газовые законы химии
Объединенный газовый закон - объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта, уравнение, которое можно записать так: P1V1 / T1 = P2V2 / T2
И, наоборот, из объединенного газового закона при P = const (P1 = P2) можно получить Уравнение Клайперона-Менделеева: Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клайперона-Менделеева: pV= (m / M) RT
где m - масса газа, г;
M - молекулярная масса г/моль;
p – давление, Па;
V – объем, м3;
T - абсолютная температура, К;
R - универсальная газовая постоянная (8,314 Дж/(моль • К) или 0,082 л атм/(моль • К)).
Пример. Какой объем займет при температуре 17°C и давлении 250 кПа оксид углерода (II) массой 84 г?
Решение. Количество моль CO равно: n(CO) = m(CO) / M(CO) = 84 / 28 = 3 моль,
Объем CO при н.у. составляет 3 • 22,4 л = 67,2 л
Из объединенного газового закона Бойля-Мариотта и Гей-Люссака:
(P • V) / T = (P0 • V0) / T0
Следует: V(CO) = (P0 • T • V0) / (P • T0) = (101,3 • (273 + 17) • 67,2) / (250 • 273) = 28,93 л
Относительная плотность газов показывает, во сколько раз 1 моль одного газа тяжелее (или легче) 1 моля другого газа.
Средняя молекулярная масса смеси газов равна общей массе смеси, деленной на общее число молей:
Пример 1. Плотность некоторого газообразного вещества по водороду равна 17. Чему равна его плотность по воздуху (Мср.=29).
Решение. DH2 = Mв-ва / MH2 = Мв-ва / 2; Мв-ва= 2DH2 = 34; Dвозд = Mв-ва / Mвозд. ср = 34 / 29 = 1,17
Пример2.Определите плотность по воздуху смеси азота, аргона и углекислого газа, если массовые доли компонентов составляли 15, 50 и 35% соответственно.
Решение. Dсмеси(по воздуху) = Mсмеси / Mвозд. = Мсмеси / 29
Mсмеси = (15 • 28 + 50 • 40 + 35 • 44) / 100 = (420 + 2000 + 1540) / 100 = 39,6
Dсмеси(по воздуху) = Mсмеси / 29 = 39,6 / 29 = 1,37
Закон Авогадро и следствие из него
Среди веществ с различным агрегатным состоянием необходимо выделить газы, которые играют огромную роль не только в нашей жизни, но в различных технологических процессах. Необходимо помнить, что для количественной характеристики любого газа используют давление, температуру и занимаемый объем. Наиболее часто применяют так называемые нормальные условия (н.у.), которые соответствуют давлению Р=105 Па и температуре Т=273 К.
Согласно закону Авогадро: одинаковые объемы различных газов при одинаковых условиях (давлении и температуре) содержат одинаковое число молекул.
Большое практическое значение имеет следствие из закона Авогадро: при нормальных условиях (н.у.) один моль любого газа занимает объем, равный 22,4 л.
Объем 22,4 л называют молярным (мольным) объемом газа и обозначают соответственно VM = 22,4 л/моль.
Пример: углекислый газ CO2. Имеем М(CO2) = 44 г/моль. Значит, один моль CO2 имеет массу 44 г и занимает объем (при н.у.), равный 22,4 л, а также содержит в этом объеме 6,02·1023 молекул газа.
Связь между массой m и объемом V конкретного газа при н.у. определяется формулой:
![]()
Если условия, в которых находится газ отличается от нормальных, то используют уравнение Менделеева-Клапейрона, которое связывает все основные параметры идеального газа:
![]() RT
RT
Закон Дальтона
Объемы реагирующих газов и продуктов их реакций относятся друг к другу как небольшие целые числа (коэффициенты уравнения реакции).
Закон парциальных давлений
Общее давление газовой смеси равно сумме парциальных давлений отдельных газов, составляющих данную смесь, то есть Робщ = Р1 + Р2 + .. + Рп
Из формулировки закона следует, что парциальное давление представляет собой частичное давление, создаваемое отдельным газом. ТО есть, парциальное давление - это такое давление, которое бы создавал данный газ, если бы он один занимал весь объем.
Пример: определить давление газовой смеси, если в объеме 11,2 л при н.у. содержится 4 г Н2, 14 г СО и 56 г N2.
Решение: Определим с помощью уравнения Менделеева-Клапейрона парциальные давления каждого из газов, составляющих данную газовую смесь:
Р(Н2) = (m/M)RT/V = (4г/2г/моль)·8,31·273К/0,0112мз = 4·105 Па,
Р(СО) = (14г/28г/моль)·8,31·273К/0,0112мз = 105 Па,
Р(N2) = (56г/28г/моль)·8,31·273К/0,0112мз = 4·105 Па.
Общее давление газовой смеси равно: Робщ = Р(Н2) + Р(СО) + Р(N2) = 9·105 Па
Величина парциального давления определяется несколькими способами, но наиболее часто встречающийся практически способ основан на использовании формулы:
Парциальным давлением газа в смеси называют давление, которое оказывал бы газ, если бы занимал объем, предоставленный всей смеси, при отсутствии всех других компонентов.
Если смесь представляет собой идеальную смесь идеальных газов, то парциальное давление каждого газа (Pi) можно вычислить из соотношений:
![]()
где А - содержание данного газа в газовой смеси в объемных %.
Пример: определить массу кислорода О2, содержащегося в 1 м3 воздуха при нормальных условиях, если процентное содержание кислорода в воздухе составляет 21% об.
Решение:
Парциальное давление О2 в воздухе определяем по формуле Р(О2) = 105Па·21%/100% = 0,21·105Па. Отсюда, согласно уравнения Менделеева - Клапейрона: m(O2) = PVM/RT = (0,21·105Па·1м3·32г/моль)/8,31·273К = 297 г
Ответ: 297 г.
Рассмотрим возможность учета изменения объема или давления при протекании химической реакции, в которой участвуют или образуются газообразные продукты. Для учета этого необходимо вспомнить, что коэффициенты в уравнении химической реакции прямо пропорциональны числу молей реагирующих и образующихся веществ.
Применительно к газам необходимо учесть также, что: 1 моль любого газа при н.у. занимает объем, равный 22,4 л;
объем 1 моля любого газа значительно превышает объем 1 моля жидкого или твердого вещества (сравните: 1 моль жидкой воды - 18 смз(0,018 л), 1 моль водяного пара - 22,4 л) и в общем объеме системы объемом жидких и твердых веществ можно пренебречь.
Таким образом, сравнивая коэффициенты исходных веществ и продуктов реакции, можно сделать вывод об изменении объема (давления) в ходе химической реакции.
Например, в химической реакции 2СО + О2 = 2СО2 все вещества являются газами, Видно, что до реакции имелось 3 моля газа (2 моля СО и 1 моль О2), а после реакции осталось 2 моля СО2. Ясно, что объем 3 молей газа (22,4·3=67,2л) больше объема 2 молей (22,4·2=44,8л), то есть Vнач> Vкон. Значит, данная реакция протекает либо с уменьшением объема (изобарный процесс), либо с уменьшение давления (изохорный процесс).
В случае химической реакции СО2 + С = 2СО имеем газообразные вещества СО2 и СО и твердое вещество С. Сравниваем коэффициенты только для газообразных веществ и имеем для исходных веществ 1 и конечных веществ 2. Так как 1 < 2, то объем системы в ходе химической реакции увеличивается (либо увеличивается давление при изохорном процессе).
Пример 1. Приведение объема газа к нормальным условиям.
Какой объем (н.у.) займут 0,4·10-3 м3 газа, находящиеся при 50 0С и давлении 0,954·105 Па?
Решение. Для
приведения объема газа к нормальным
условиям пользуются общей формулой,
объединяющей законы Бойля-Мариотта и
Гей-Люссака:
![]()
Объем газа (н.у.)
равен
![]() ,
гдеТ0=273
К;
P0=1,013·105
Па;
Т=273+50=323
К.
,
гдеТ0=273
К;
P0=1,013·105
Па;
Т=273+50=323
К.
![]()
Пример 2. Определение средней молекулярной массы смеси газов по относительной плотности.
Вычислите среднюю молекулярную массу смеси газов, состоящей на 80% из метана и 20% кислорода (по объему), используя значения относительной плотности этих газов по водороду.
Решение. Часто
вычисления производят по правилу
смешения, которое заключается в том,
что отношение объемов газов в
двухкомпонентной газовой смеси обратно
пропорционально разностям между
плотностью смеси и плотностями газов,
составляющих эту смесь. Обозначим
относительную плотность газов через
![]() .
Она будет больше плотности метана, но
меньше плотности кислорода:
.
Она будет больше плотности метана, но
меньше плотности кислорода:
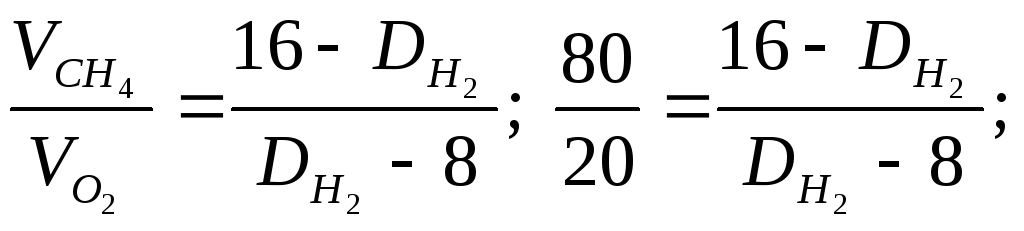
![]()
Плотность этой
газовой смеси по водороду равна 9,6.
средняя молекулярная масса газовой
смеси![]() равна
удвоенной ее плотности по водороду:
равна
удвоенной ее плотности по водороду:![]()
Пример 3. Определение давления газовой смеси.
В сосуде объемом 0,05 м3 при 25 0С содержится смесь из 0,020 м3 этилена под давлением 83950 Па и 0,015 м3 метана под давлением 95940 Па. Найдите общее давление газов в сосуде.
Решение. Сначала определяем парциальное давление каждого из газов:
![]() и
и
![]()
Общее давление
газовой смеси равно сумме парциальных
давлений ее компонентов:
![]()
Пример 4. Вычисление химических эквивалентов.
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода, измеренного при (н.у.). Вычислить молярные массы металла и оксида. Чему равна относительная масса металла?
Решение. По закону
эквивалентов массы веществ m1
и m2,
вступающих в реакцию, пропорциональны
молярным массам их эквивалентов
![]()
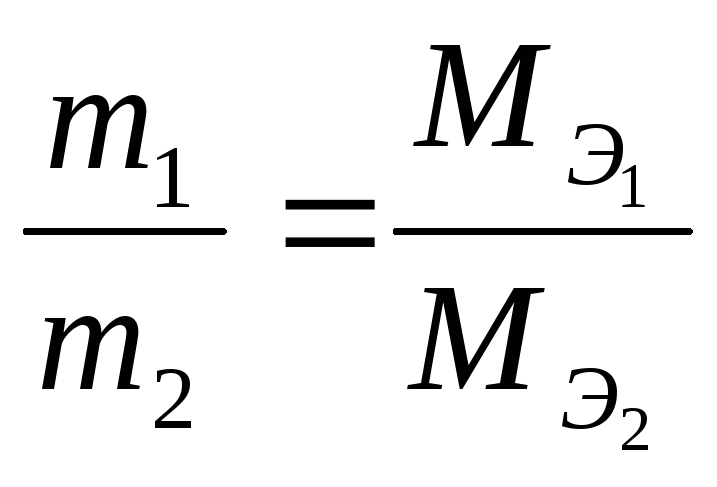 ;
(1)
;
(1)
![]() (2)
(2)
Если одно из веществ находится в газообразном состоянии, то как правило, его количество измеряется в объемных единицах (см3, л, м3).
Формулу (2) преобразуем
относительно объема водорода:
![]()
Находим молярную
массу эквивалента металла (г/моль):
![]()
По закону
эквивалентов:

Относительную атомную массу металла определяем из соотношения:
![]()
![]()
