
2л5
.pdf
Кислотно-основные свойства метагидроксида Со3+ выявить практически невозможно из-за высокой активности в ОВ-процессах
2СоО(ОН) + 6HCl →2CoCl2 + Cl2↑ + 4H2O
4СоО(ОН) + 4H2SO4 →4CoSO4 + O2 + 6H2O
или
4Со(ОН)3 + 4H2SO4→4CoSO4 + O2 + 10H2O
Аналогичные реакции характерны для NiO(OH). NiO(OH) и СоО(ОН) не реагируют с растворами щелочей, но FeO(OH) заметно растворяется в концентрированных растворах щелочей, образуя гексагидроксоферраты (III)
H2O + FeO(OH) + 3NaOHk → Na3[Fe (OH)6] При сплавлении: Fe(OH)3 + NaOH NaFeO2 + 2H2O
Феррит натрия

в) Соли Ме3+ Окислители. Соединения Со3+ самые
сильные окислители, окисляют воду. |
|
|
|
||||
4Со3+ + 2Н О → 4Со2+ + 4Н+ |
+ О |
||||||
|
|
2 |
или |
|
|
|
2 |
|
|
|
|
|
|
|
|
4CoCl3 + 2H2O → 4CoCl2 + 4HCl + O2 |
|||||||
Соли Fe3+ – FeCl |
3 |
· 6H O, |
NН Fe(SO |
) |
2 |
· 12H O – |
|
|
2 |
4 |
4 |
|
2 |
||
– железоаммонийные квасцы |
|||||||
Соли Fe3+ подвергаются гидролизу (сильнее, чем соли Fe2+)
Fe3+ +HOH |
|
Fe(OH)2+ + H+; |
|
||||
2+ +H O |
|
Fe(OH)+ + H+; |
|||||
Fe(OH)+ |
2 |
|
Fe(OH) |
|
2 |
+ |
|
Fe(OH)2+H2O |
|
|
+ H . |
||||
|
|
3+ |
3 |
|
|
||
Качественная реакция на Fe |
: |
|
|
|
|||
FeCl3 + K4[Fe(CN)6] → KFe[Fe(CN)6]↓ + 3KCl
«желтая кровяная соль» берлинская лазурь


Качественная реакция на Fe3+
KSCN + Fe3+ → ряд комплексных ионов
от |
[Fe(SCN)]2+ до [Fe(SCN)6]3– |
В упрощенном виде: |
|
FeCl3 + 3KSCN |
Fe(SCN)3 + 3KCl |
Качественная реакция на Fe2+
K3[Fe(CN)6] + Fe2+ → KFe[Fe(CN)6] + 2K+
Турнбуленова синь = Берлинская лазурь

СОЕДИНЕНИЯ ЖЕЛЕЗА СО СТЕПЕНЬЮ ОКИСЛЕНИЯ +6, ФЕРРАТЫ
Степень окисления +6 характерна лишь для железа.
FeO3 и железная кислота Н2FeO4 не получены, но выделены ферраты:
2Fe(OH)3+4NaOH+3NaClO = 3NaCl + 5H2O + 2Na2FeO4
Fe + KClO3 + 2KOH = KCl + К2FeO4 + H2O.
2Fe(OH)3+10NaOH+3Br2 → 2Na2FeO4 + 6NaBr + 8H2O
или
2FeO(OH)+10NaOH+3Br2 →2Na2FeO4+6NaBr+6H2O

Ферраты - это красно-фиолетовые кристаллические
вещества, нагревание: |
|
|
|
|
|
4K FeO |
100 – 2000С |
4KFeO |
2 |
+ 2K O + 3O |
2 |
2 |
4 |
|
2 |
||
феррит калия
H2FeO4 мгновенно разлагается
4H2FeO4 → 2Fe2O3 + 3O2 + 4H2O
Ферраты - сильные окислители, особенно в кислой среде. Окисляют воду сильнее, чем KMnO4 или
K2Cr2O7.
4Na2FeO4 + 6H2O → 4FeO(OH) + 8NaOH + 3O2
или
2Na2FeO4 + 10H2O → 4Fe(OH)3 + 4NaOH + O2
Аммиак окисляется ферратами до нитратов
3NH3+8K2FeO4+14H2O = 3KNO3 + 8Fe(OH)3 + 13 KOH

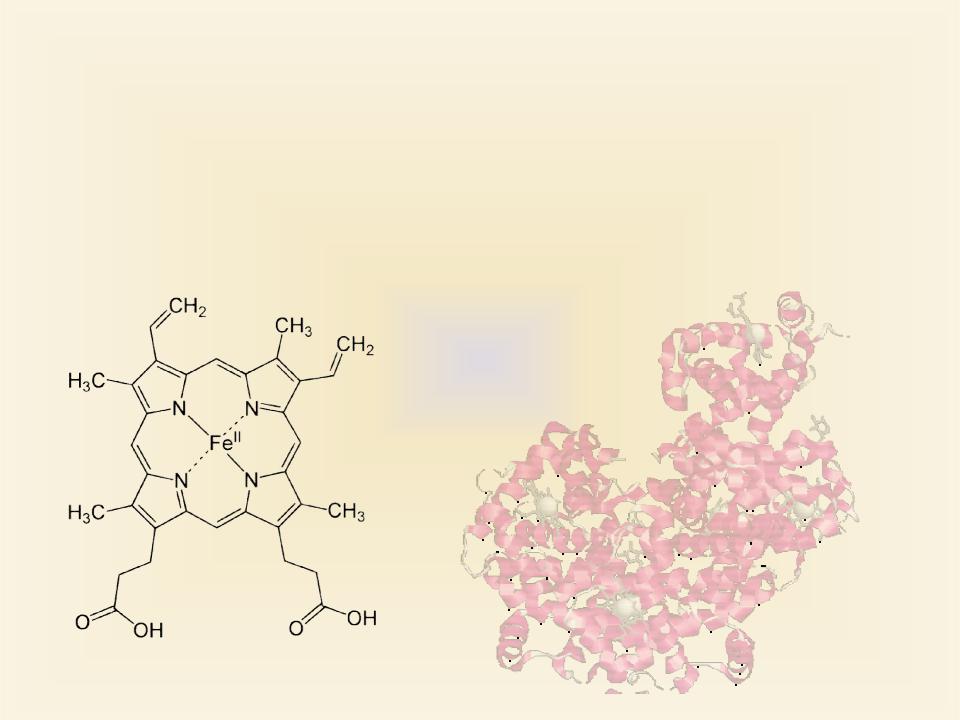
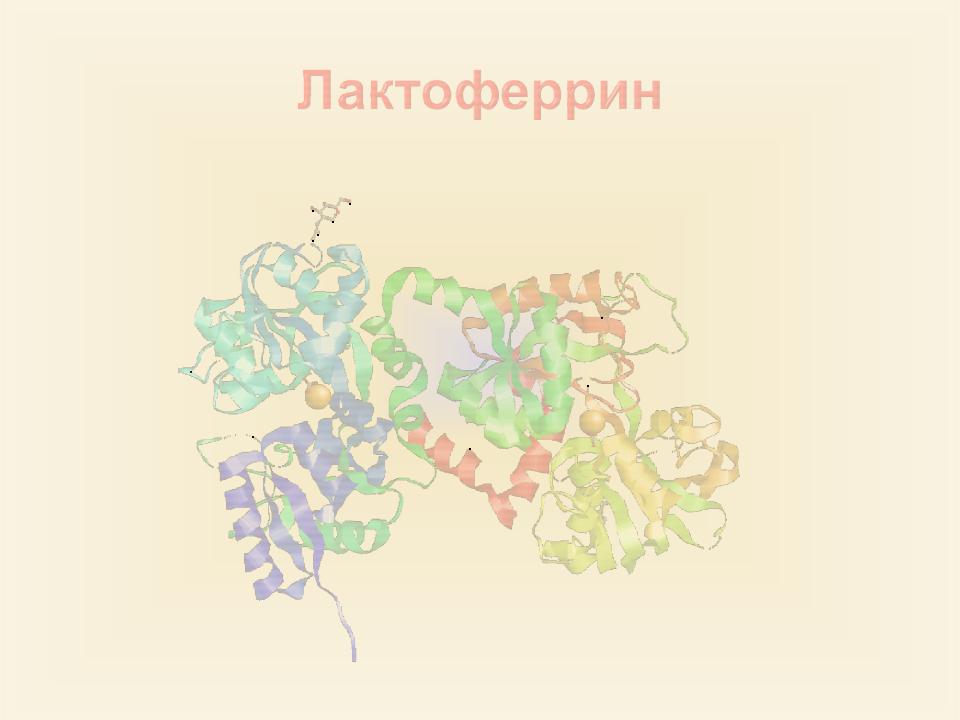
Fe – ЭССЕНЦИАЛЬНЫЙ ЭЛЕМЕНТ Железосодержащие белки – гемоглобин,
миоглобин, |
ферритин, |
трансферин, |
лактоферрин. |
|
|
Ферменты |
– цитохромы, |
каталаза, |
пероксидаза. |
|
|
Избыток – гиперсидероз – профессиональное заболевание (физическая слабость, потеря веса, печеночная недостаточность, тошнота, рвота).
Недостаток Fe – гипосидероз , железодефицитная анемия (малокровие). Утомляемость, одышка при нагрузке, сильное сердцебиение.
Лечение – введение солей Fe2+(FeCl2, FeSO4, FeCO3);
аскорбат, лактат, сахарат, сорбат, ферроцерон, FeSO4.

1.Гемостимулин – сухая пищевая кровь + лактат железа (II) + CuSO4
2.Фитоферролактол – лактат железа (II) + фитин
3.Cоль FeSO4∙ 7H2O
4.Драже «ферроплекс» FeSO4 + аскорбиновая кислота
5.Сироп алоэ с железом - сок алоэ + раствор FeCl2 + HCl кислоты разведенной + лимонная кислота
6.Гемофер жидкость (в 1 мл 157 мг FeCl2∙ 4H2O)
