
Методичка7_Praktikum_lech_fak_2014-2_chast
.pdfБИОХИМИЯ ПЕЧЕНИ. БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ДЕТОКСИКАЦИИ
С биохимических позиций особенность печени можно обозначить как своеобразный «биохимический альтруизм». Печень синтезирует вещества «на экспорт», обеспечивая ими другие органы и ткани (белки крови, кетоновые тела, холестерин). Печень – главный орган обезвреживания токсических веществ, как экзогенных (аммиак, билирубин и др.), так и поступающих извне (лекарственных ксенобиотиков).
Работа № 115. Пробы на коллоидоустойчивость белков сыворотки крови.
А. Тимоловая проба.
Принцип метода. Метод основан на образовании плохо растворимых глобулино- тимол-липидных комплексов при взаимодействии сыворотки крови с тимоловероналовым буфером.
Оборудование: ФЭК, кюветы толщиной слоя 13 мм или 5 мм, штатив с пробирками, пипетки объемом 10 мл, 0,1 мл и 0,2 мл.
Реактивы:
1.Спиртовый раствор тимола: 10 г очищенного тимола растворяют в 100 мл этанола;
2.Вероналовый буфер: 2,76 г веронала и 2,06 г натриевой соли диэтилбарбитуровой кислоты (мединал) растворяют в мерной колбе вместимостью 1 л и доводят дистиллированной водой до метки (хранить в холодильнике);
3.Тимолово-вероналовый буфер рН 7,55-7,6: к 99 мл вероналового буфера добавляют 1 мл спиртового раствора тимола.
Исследуемый материал: негемолизированная сыворотка крови.
Ход работы. К 6 мл тимоло-вероналового буфера в пробирке прибавить 0,1 мл негемолизированной сыворотки крови, содержимое перемешать и через 30 мин колориметрировать на ФЭКе при длине волны 630-690 нм в кювете с длиной оптического пути 3 мм или 5 мм против тимолово-вероналового буфера.
Расчет результата. Расчет производят по калибровочному графику, для построения которого готовят ряд разведений суспензии BaSO4, приготовленной при смешивании растворов хлорида бария и серной кислоты.
61
Нормальные величины пробы соответствуют интенсивности помутнения в пределах 0-4 условных единиц.
Б. Проба Вельтмана.
Принцип метода. Белки сыворотки крови в результате нагревания и действия раствора хлористого кальция определенной концентрации выпадают в осадок в виде хлопьев.
Оборудование: спиртовки, держатели для пробирок, штатив с пробирками, пипетки объемом 5 или 10 мл, 0,1 мл или 0,2 мл.
Реактивы: 1. Хлорид кальция (СаСI2), 0,5 % раствор, учитывая его гигроскопичность раствор готовят путем измерения относительной плотности с помощью аэрометров, учитывая, что относительная плотность 5 % раствора безводного (или 10 % водного) хлорида кальция составляет 1,040. Из этого раствора путем разведения в 10 раз готовят 0,5 % раствор СаСI2.
Исследуемый материал: негемолизированная свежая сыворотка крови.
Ход работы. В пробирку прилить 4,9 мл дистиллированной воды и 0,1 мл негемолизированной сыворотки крови. Содержимое пробирки перемешать и затем прилить 0,1 мл 0,5 % раствора хлорида кальция. Содержимое пробирки встряхнуть и нагреть над пламенем спиртовки до однократного вскипания смеси. Пробирку охладить и смотреть через нее на свет. Если хлопья в пробирке не обнаруживаются, то в нее добавить еще 0,1 мл раствора СаСI2 и вновь раствор нагреть до кипения. Процедуру повторять до выпадения хлопьевидного осадка.
В норме образования осадка наблюдается при добавлении 0,4-0,5 мл раствора СаСI2.
При уменьшении объема раствора СаСI2, говорят об «укорочении» или «сужении» коагуляционной ленты, при увеличении объема раствора СаСI2 - об ее «удлении» или «расширении».
Клинико-диагностическое значение. Коллоидо-осадочные пробы широко распространены в клинической практике. Они основаны на исследовании коллоидной устойчивости белков сыворотки крови при патологии, сопровождаемой диспротеинемией (заболевания печени, почек и др.). Лабильность сывороточных белков определяется соотношением мелко- и крупнодисперсных белков (альбумина/глобулины) и помутнения в пробах при добавлении меньшего объема реагентов, чем при исследовании сыворотки здоровых лиц может свидетельствовать об относительном увеличении содержания глобулинов.
Так, более высокие цифры единиц помутнения в тимоловой пробе могут косвенно указывать на диспротеинемию.
Удлинение или расширение коагуляционной ленты Вельтмана свидетельствует о паренхиматозном поражении печени или развитии хронического воспалительного процесса.
Вывод:
Работа № 116. Определение содержания общего и конъюгированного билирубина в сыворотке крови.
Принцип метода. Модификация метода Йендрашека-Грофа. Основан на реакции диазотирования билирубина диазосульфаниловой кислотой в присутствии ускорителя (общий билирубин) и в отсутствии ускорителя (неконъюгированный билирубин) реакции кофеина-бензоата натрия. В
62
результате реакции образуется соединение розового цвета, интенсивность окраски которого пропорциональна концентарции билирубина в пробе.
Оборудование: ФЭК, кюветы на 3 или 5 мм, микропипеты-дозаторы, наконечники, штатив с пробирками, пипетки объемом 1-2 мл.
Реактивы: Набор реагентов «Билирубин-Ново» ЗАО «Вектор-Бест» Состав:
Реагент 1 (Р1)- раствор кофеина-бензоата натрия и сульфаниловой кислоты. Реагент 2 (Р2)- раствор натрия азотнокислого.
Реагент 3 (Р3)- раствор сульфоновой кислоты для определения конъюгированного билирубина.
Реагент 4 (Р4)- раствор азотнокислого натрия для определения конъюгированного билирубина.
Калибратор - лиофильно высушенный раствор билирубина с концентрацией в интервале 20-40 мкмоль/л. Точное значение концентрации билирубина (Ск) указано на флаконе с калибратором.
Стабильность реагентов после вскрытия банок и флакона в плотно закрытом виде в темном месте не более 3 месяцев.
Приготовление калибратора. Во флакон с калибратором добавить 1 мл дистиллированной воды, растворить при осторожном помешивании. Хранить в защищенном от света месте в замороженном состоянии не более трех недель.
Исследуемый материал: негемолизированная сыворотка крови.
Ход работы. В пять пробирок: 1-калибровочная проба, 2- билирубин
Отмерить |
Калибровоч |
Билирубин |
Билирубин |
Контроль |
Контроль |
мл |
ная проба |
общий |
конъюгиро- |
для пробы |
для калибра- |
|
|
|
ванный |
|
тора |
Реагент 1 |
1,0 |
1,0 |
- |
- |
- |
Реагент 2 |
0,05 |
0,05 |
- |
- |
- |
Реагент 3 |
- |
- |
1,0 |
1,0 |
1,0 |
Реагент 4 |
- |
- |
0,05 |
- |
- |
Проба |
- |
0,1 |
0,1 |
0,1 |
- |
Калибра- |
0,1 |
- |
- |
- |
0,1 |
тор |
|
|
|
|
|
общий, 3 - билирубин конъюгированный, 4 - контроль для пробы, 5 - контроль для калибратора добавить микропипеткой реагенты в мкл согласно таблице:
Содержимое пробирок перемешать, выдержать при комнатной температуре конъюгированный билирубин (пробирка 3) и контроль для пробы (пробирка 4) - 7 минут, остальные пробирки: общий билирубин (2), калибровочную пробу (1) и контроль для калибратора (5) - 20 мин. Измерить оптическую плотность растворов в пробирках против дистиллированной воды на ФЭКе при длине волны 546 (520-560) нм в кюветах с длиной оптического пути 3 или 5 мм.
63
Расчет. Концентрацию билирубина (С) в мкмоль/л рассчитать по формуле:
С= А/ Ак х Ск, где А-разность оптических плотностей опытной и контрольной проб;
Ак- разность оптических плотностей калибровочной и ее контрольной проб; Ск- концентрация билирубина во флаконе с калибратором.
Нормальные величины содержания билирубина (общего) в крови составляет 8,5-20,5 мкмоль/л, для конъюгированного – 2,2-5,1 мкмоль/л.
Клинико-диагностическое значение.
Гипербилирубинемия обуславливается следующими причинами:
1.Увеличение интенсивности гемолиза эритроцитов.
2.Поражение паренхимы печени с нарушением ее билирубинвыделительной функции.
3.Нарушение оттока желчи из желчных путей в кишечник.
4.Выпадение ферментного звена, обеспечивающего биосинтез билирубинаглюкуронида.
5.Нарушение печеночной секреции конъюгированного (прямого) билирубина в желчь.
При увеличении содержания билирубина в крови, превышающее 3035 мкмоль/л, появляется желтушная окраска склер, слизистых, кожи.
Содержание билирубина конъюгированного увеличивается при паренхиматозной желтухе, обтурационной (подпеченочной) желтухе.
Снижение содержания билирубина в крови наблюдается редко при постгеморрагических анемиях и алиментарной дистрофии.
Вывод:
Работа № 117. Определение активности каталазы (КФ1.11.1.6) крови методом А.Н. Баха и С.Р. Зубковой.
Принцип метода. Метод основан на титровании избытка пероксида водорода, не расщепленного каталазой, перманганатом калия в кислой среде.
5Н2О2+КMnO4+3H2SO4→8H2O+5O2+K2SO4+2MnSO4
Активность каталазы выражается каталазным числом, которое представляет собой количество Н2О2 в миллиграммах, разложенное 10-3 мл крови за 30 мин. Каталаза осуществляет распад пероксида водорода с образованием Н2О2 и молекулярного О2 :
2 Н2О2 → 2 Н2О2 + О2
Оборудование: стаканчики или колбочки для титрования, бюретки со штативами, пипетки на 1, 2, 5 и 10 мл.
Реактивы:
1.Пероксид водорода, 1 % раствор.
2.Серная кислота, 10 % раствор.
3.Перманганат калия, 0,1N раствор*.
Исследуемый материал: гемолизат крови, разведенный в 1000 раз.
Ход работы. В две колбочки или широкие пробирки отмерить по 7 мл дистиллированной воды и по 2 мл 1 % раствора пероксида водорода. В опытную пробу
64
прилить 1 мл разведенной в 1000 раз крови. Обе пробы (опыт и контроль) оставить на 30 мин при комнатной температуре. Затем в обе пробы добавить по 3 мл 10 % раствора серной кислоты, которая останавливает действие каталазы. Содержимое опытной и контрольной проб оттитровать из бюретки 0,1N раствором перманганата калия до появления устойчивой слаборозовой окраски.
Расчет. Разница между количеством мл 0,1N раствора КMnO4, пошедшего на титрование контрольной и опытной проб, укажет на количество мл 1% раствора Н2О2 , разрушенного каталазой крови. Для перевода количества разрушенного пероксида водорода в мг надо это число умножить на 1,7 (1 мл 0,1N раствора Н2О2 содержит 1,7 мг пероксида водорода).
Пример расчета: на титрование контрольной пробы пошло 12,5 мл 0,1N раствора перманганата калия, опыта – 4,5 мл. Следовательно, каталазное число соответствует:
(12,5-4,5)×1,7=13,6 ед.
Нормальная величина активности каталазы в каталазных числах в крови у людей колеблется в пределах 11-20 ед.
Клинико-диагностическое значение. Снижение активности каталазы в эритроцитах наблюдается при развитии интоксикации, действии химических поллютантов, ряда воспалительных заболеваний.
Вывод:
Работа № 118. Определение активности пероксидазы крови (КФ1.11.1.7) по методу Н.И. Симаковой.
Принцип метода. Метод основан на окислении индигокармина кислородом, выделяющемся при разложении Н2О2 под влиянием пероксидазы крови:
Н2О2 → Н2О + О
Активность пероксидазы измеряется временем, необходимым для окисления индигокармина, который меняет окраску от сине-зеленого в желто-розовый цвет.
Оборудование: секундомер, штатив с пробирками, пипетки объемом 1, 2 и 5 мл.
Реактивы:
1.Ацетатный буфер рН 4,7; 0,1М*.
2.Пероксид водорода, 0,2 % раствор.
3.Индигокармин, 0,001 % раствор.
Исследуемый материал: гемолизат крови, разведенный в 1000 раз.
Ход работы. В пробирку налить 2 мл 0,1М ацетатного буфера, прибавить 3 мл разбавленной в 1000 раз крови, 1 мл дистиллированной воды и 1 мл 0,01 % раствора индогокармина. Содержимое пробирки тщательно перемешать, быстро внести в нее 2 мл 0,2 % раствора Н2О2 и засечь по секундомеру время перехода сине-зеленой окраски содержимого пробирки в желто-розовую.
Расчет. Поскольку гемоглобин обладает пероксидазным эффектом, то для расчета индекса активности фермента необходимо знать процентное содержание гемоглобина, принимая 160г/л Нb за 100 %.
65
Пример расчета: допустим переход окрашивания жидкости произошел за 40 секунд, а количество Нb в исследуемой крови составляет 144 г/л или 90,0 %. Следовательно, индекс пероксидазной активности будет равен:
40 сек × 100 % / 90 %=44,4
Нормальная величина индекса пероксидазной активности крови у здоровых лиц колеблется в пределах 30-50.
Клинико-диагностическое значение. Снижение индекса пероксидазной активности в эритроцитах выявляется при развитии интоксикации и действии поллютантов хлорорганической природы.
Вывод:
Работа № 119. Качественная проба на индикан в моче.
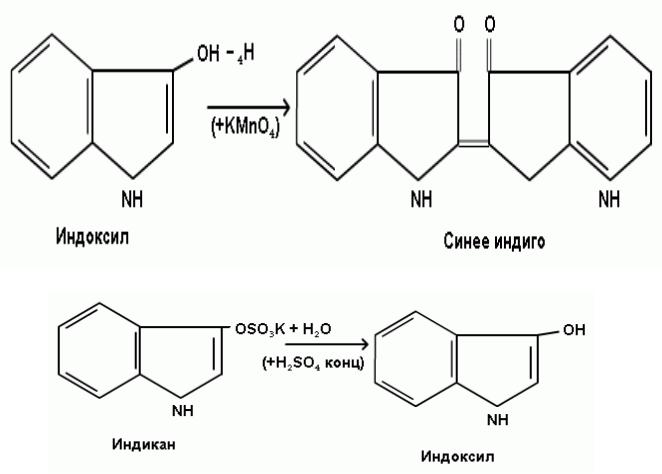
Индикан – калиевая или натриевая соль индоксилсерной кислоты, один из продуктов обезвреживания в печени индоксила, образуемого при гниении белков в толстом кишечнике. В норме в моче содержится в виде следов. Много индикана выделяется с мочой у человека при запорах, непроходимости кишечника.
Принцип метода. Реакция обусловлена гидролитическим расщеплением индикана в присутствии концентрированной серной кислоты на индоксил и сернокислый калий, окислением индоксила в синее индиго и растворением синего индиго в хлороформе.
Химизм реакции.
66
Оборудование: |
штатив |
с пробирками, пипетки объемом 1 и 5 мл, |
пипетки глазные. |
|
|
Реактивы: |
|
|
1.Серная кислота, концентрированная;
2.Хлороформ;
3.Перманганата калия, 1 % раствор.
Исследуемый материал: свежая моча.
Ход работы. В пробирку налить 2 мл исследуемой мочи и прибавить при встряхивании равный объем серной кислоты. Затем добавить 3-4 капли хлороформа и 1-2 капли раствора перманганата калия. Пробирку закрыть пробкой и несколько раз перевернуть, не встряхивая, поставить в штатив и наблюдать окрашивание верхнего хлороформного слоя в синий цвет при наличии индикана.
Вывод:
Работа № 120. Определение чувствительности эритроцитов к пероксидному гемолизу.
Принцип метода. Метод основан на определении оптической плотности при 540 нм внеэритроцитарного гемоглобина, поступающего в среду при спонтанном лизисе мембран эритроцитов, который вызван пероксидным окислением липидов кислородом воздуха.
Оборудование: штатив с пробирками, пробирки центрифужные, весы центрифужные, центрифуга лабораторная, термостат на 380С, пипетки объемом 0,1 мл, 5 мл и 10 мл, стеклянные палочки, ФЭК, кюветы толщиной слоя 3 мм или 5 мм.
Реактивы:
1. Рабочий раствор хлорида натрия, свежеприготовленный: смешать 25 мл 0,1 М фосфатного буфера с рН 7,4 с 25 мл 17 % раствора хлорида натрия (NaCl), перед употреблением объем смеси довести до 1 литра и насытить кислородом воздуха путем встряхивания.
2. Дистиллированная вода.
Исследуемый материал: кровь цельная.
Ход работы. В центрифужную пробирку внести 7,5 мл рабочего раствора NaCl и добавить 0,1 мл крови. Сполоснуть микропипетку, втягивая и выдувая жидкость. Образовавшуюся смесь центрифугировать 10 мин при 1000 об/мин. Надосадочную жидкость отсосать осторожно. К осадку добавить 7,5 мл рабочего раствора NaCl и вновь суспензировать осадок эритроцитов.
В три центрифужные пробирки налить по 1 мл приготовленной суспензии эритроцитов. В первые две пробирки прибавить по 4 мл рабочего раствора NaCl, а в третью – 4 мл дистиллированной воды (для полного гемолиза эритроцитов). Пробы перемешать стеклянной палочкой и поставить в термостат на 2 часа при 380С.
67
После инкубации содержимое пробирок перемешать стеклянной палочкой и цетрифугировать 10 мин при 100 об/мин. Измерить оптическую плотность всех трех пробирок против дистиллированной воды на ФЭКе при 540 нм (зеленый светофильтр).
Расчет. Произвести по формуле: Х = (Е1 + Е2) х 100 / 2 х Е3, где Х – степень гемолиза в %, Е1 и Е2 – экстинкции первой и второй проб,
Е3 – экстинкция третьей пробы.
Клинико-лабораторное значение. По степени гемолиза эритроцитов можно судить о состоянии антиокислительных систем клетки. В норме спонтанный гемолиз составляет 2 – 10%. Недостаток витамина Е, других антиоксидантов повышает этот показатель.
Вывод:
Работа № 121. Определение скорости пероксидного окисления липидов (ПОЛ) в гомогенатах тканей.
Принцип метода. Метод основан на определении содержания продукта пероксидного окисления липидов – малонового диальдегида, который при взаимодействии с тиобарбитровой кислотой образует окрашенный в розовый цвет триметиновый комплекс, который имеет максимум оптического поглощения при 530-532 нм. Окраска пропорциональна концентрации малонового диальдегида, молярный коэффицент экстинкции которого 1,56 х 105 л/моль х см.
Оборудование: штатив с пробирками, пробирки центрифужные, весы центрифужные, пипетки объемом 0,1 мл, 0,2 мл, 1 мл и 5 мл, водяная баня кипящая, гомогенизатор, центрифуга лабораторная, ФЭК, кюветы толщиной слоя 3 мм или 5 мм, термостат при 380С.
Реактивы:
1.Хлорид калия, 1,2 % раствор;
2.Трихлоруксусная кислота (ТХУ), 40 % раствор;
3.Тиобарбитуровая кислота, 0,8 % раствор свежеприготовленный;
4.Соль Мора – Fe(NH4)2(SO4)2, 4 х 10-5 М раствор свежеприготовленный*;
5.Аскорбиновая кислота, 1 % раствор;
6.Вода дистиллированная.
Исследуемый материал: ткань печени, почки или сердца.
Ход работы. Навеску 0,5 г ткани гомогенизировать в 19,5 мл охлажденного до 0 – 40С раствора KCl, поместить гомогенизатор в стаканы со снегом или воды со льдом. Полученный гомогенат слить в чистую пробирку.
В три центрифужные пробирки внести по 2 мл гомогената. В первую пробирку добавить 0,2 мл дистиллированной воды, во вторую – 0,1 мл раствора аскорбиновой кислоты и 0,1 мл соли Мора, в третью – 0,1 мл раствора аскорбиновой кислоты, 0,1 мл соли Мора и 1 мл 40 % раствора ТХУ.
68
Все пробирки поместить в термостат на 15 мин при 380С. после этого в первые две пробирки прилить по 1 мл 40 % раствора ТХУ, перемешать содержимое и центрифугировать 10 мин при 3000 об/мин.
По 2 мл надосадочной жидкости отобрать соответственно в три чистые пробирки. К ним прилить по 1 мл 0,8 % раствора тиобарбитуровой кислоты и поместить в кипящую водяную баню на 10 мин. пробирки охладить под струей холодной воды. Параллельно приготовить контрольный раствор, содержащий 2 мл раствора хлорида калия, 1 мл 40 % раствора ТХУ, 1 мл 0,8 % раствора тиобарбитуровой кислоты и также выдержать 10 мин в кипящей водяной бане.
Измерить оптическую плотность содержимых проб против контрольной пробы на ФЭКе при 532 нм (зеленый светофильтр) в кюветах толщиной слоя 10 мм.
Расчет. Произвести по формулам:
Х1 (Х2) = Е1 (Е2) ×3 ×3,2 ×4/0,156 × 2 и Х3 = Е3×3 × 3,2/0,156 × 2,
где Х1 – скорость спонтанного ПОЛ в гомогенате, измеряемого в нмоль малонового диальдегида в пробе за 1 час инкубации; Х2 – скорость аскорбит – зависимого неферментативного ПОЛ в нанамолях,
образовавшегося малонового альдегида в исходном гомогенате; Е1, Е2 и Е3 – экстинкции соответствующих проб; 3,2 - общий объем исследуемых проб в мл;
2 – объем надосадочной жидкости, взятой на определение малонового диальдегида в мл; 0,156 – экстинкция 1 нмоль малонового диальдегида в 1 мл при 532нм.
Клинико – диагностическое значение. Определение скорости пероксидного окисления липидов биомембран важно для оценки влияния на эту систему различных соединений, природных кленобиотиков, лекарственных веществ.
Увеличение ПОЛ возможно при недостатке витамина Е, действии ионизирующего излучения, гипоксии, гипербирической оксигенации, различных патологических состояниях.
Вывод:
Работа № 122. Определение в моче свободных и ацетилированных форм сульфаниламидов.
Процесс ацетилирования является одной из разновидностей реакций коньюгации ксенобиотиков. Ароматические амины, в том числе сульфаниламиды, подвергаются N-ацетилированию в организме и по выделению свободной и ацетилированной форм этих веществ можно оценить активность процесса ацетилирования.
Принцип метода. Основан на способности свободных (неацетилированных) сульфаниламидных препаратов образовывать окрашенный комплекс с нитритом натрия, ацетатом натрия и резорцином.
69
Оборудование: штатив с пробирками, пипетки глазные, пипетки объемом 1 мл, 2 мл, ФЭК, кюветы толщиной слоя 10 мм, баня водяная кипящая.
Реактивы:
1.Кислота соляная, 10 % раствор;
2.Нитрит натрия, 0,5 % раствор;
3.Ацетат натрия, насыщенный раствор;
4.Резорцин, 0,5 % раствор;
5.Вода дистиллированная.
Исследуемый материал: моча.
Ход работы. В две пробирки внести по 1 мл исследуемой мочи, в третью
– 1 мл дистиллированной воды (контрольная проба). Во все пробирки добавить по 1,5 мл дистиллированной воды и по 5 капель 10 % раствора соляной кислоты. Одну пробирку с мочой (проба на общее количество сульфаниламида) поставить в кипящую водяную баню на 15 мин для гидролиза ацетилированной формы. Пробирку охладить. Во все пробирки прилить по 1,5 мл насыщенного раствора ацетата натрия и по 5 капель 0,5 % резорцина. Содержимое пробирок тщательно перемешать и оставить при комнатной температуре на 15 мин для развития окраски.
Измерить оптическую плотность растворов при синем светофильтре в кюветах толщиной слоя 10 мм. В 1-й пробирке определить Е1 – общий сульфаниламид, во 2-й – Е2 – свободный сульфаниламид против контрольной пробы (3-я пробирка).
Расчет. Произвести рсчет содержания ацетилированной формы сульфаниламида (в %) по формуле: Х = (Е1 – Е2) × 100/Е, где Х – содержание ацетилированной формы сульфаниламидного препарата, %; Е - экстинкция общего сульфаниламида; Е2 – экстинкция свободного сульфаниламида.
Клинико – диагностическое значение. По количеству ацетилированного препарата оценивают детоксикационную функцию печени, поскольку конечной стадией биотрансформации сульфаниламидных препаратов является их коньюгация с образованием ацетилированных производных, которые выводятся с мочой. Поэтому степень ацетилирования сульфаниламидов указывает также на соотношение бактериостатически активной и неактивной форм препарата. Чем быстрее ацетилируется сульфаниламид, тем меньше его бактериостатичекая активность.
В нормальных условиях процент ацетилирования сульфаниламидов составляет до 52 %.
Вывод:
КОНТРОЛЬНЫЕ ВОПРОСЫ к разделам: Биохимия крови.
Биохимия печени. Биохимические механизмы детоксикации.
1. Какие преимущества и недостатки проб на холодоустойчивость белков в сыворотке крови?
70
