
- •1. Растворы
- •1.1.Тепловой эффект растворения
- •1.2. Растворимость
- •1.3. Концентрация растворов
- •1.4. Законы Рауля
- •Вопросы для самоконтроля.
- •1.6. Примеры решения задач
- •1.7. Задачи для домашнего задания
- •1.8. Варианты домашних заданий
- •1.9. Экспериментальная часть. Лабораторная работа
- •2.Рассчитайте, сколько миллилитров исходного раствора кислоты потребуется для приготовления определенного объема заданного раствора (по условию задачи 3 домашнего задания). Расчеты записать в отчет.
- •Полученное задание:
Вопросы для самоконтроля.
Что представляют собой растворы и какими признаками химических соединений и механических смесей они обладают?
От чего зависит тепловой эффект растворения?
Что такое растворимость и от чего она зависит?
Что называется концентрацией раствора? Дайте определение процентной, молярной, молярной концентрации эквивалента и моляльной концентраций, а также мольной доли.
Дайте определение закона Рауля.
Каковы следствия закона Рауля?
Что такое криоскопическая и эбулиоскопическая константы растворителя?
Литература.
Коровин Н.В. Общая химия.- М.: Высш. шк., 2002. Гл. 8, § 8.1.
Глинка Н.Л. Общая химия.- М.: Интеграл-Пресс, 2002, Гл. 7,
§ 7.1., 7.2.
1.6. Примеры решения задач
Пример 1. При растворении 10 г нитрата калия (KNO3) в 240 г воды температура раствора понизилась на 3,4 градуса. Определить теплоту растворения соли. Удельная теплоемкость (суд) раствора равна 4,18 Дж/г.К.
Решение:
1.Находим массу образовавшегося раствора (m):
m = 10 + 240 = 250 (г).
2.Определим количество поглощенной раствором теплоты:
Q = m . суд. T
Q = 250 . 4,18 . (-3,4 ) = - 3556,4 Дж = - 3,56 кДж.
3.Рассчитываем количество теплоты, поглощаемой при растворении одного моля KNO3 , т.е. его теплоту растворения (молярная масса KNO3 равна 101 г/моль):
при растворении 10 г соли поглощается 3,56 кДж
при растворении 101 г соли --------- х ,
х
=
![]() = 35,96 кДж
= 35,96 кДж
Ответ: теплота растворения KNO3 равна 35,96 кДж/моль.
Пример 2. Рассчитать титр Т, молярную, молярную концентрацию эквивалента Сэк и моляльную Сm концентрации 17,5%-ного раствора серной кислоты, плотность которого = 1,12 г/см3 .
Решение:
1.Находим весовое количество серной кислоты, содержащееся в 1 л 17,5 % - ного раствора:
а)находим массу литра (1000 мл) раствора:
m = . V = 1,12 . 1000 = 1120 г;
б)находим весовое количество серной кислоты:
в 100 г раствора содержится 17,5 г H2SO4;
в 1120 г раствора - х ,
x
=
![]() = 196 г.
= 196 г.
2.Находим титр раствора; для этого необходимо весовое количество кислоты, содержащееся в известном объеме раствора, разделить на объем раствора, выраженный в миллилитрах:
T
=
![]() = 0,196 г/мл.
= 0,196 г/мл.
3.Находим молярную конценнтрацию раствора; для этого необходимо весовое количество кислоты, содержащееся в 1 л раствора, разделить на молярную массу (MH2SO4 ), 98 г/моль:
[H2SO4]=
![]() = 2 моль/л.
= 2 моль/л.
4.Находим молярную концентрацию эквивалента раствора; для этого необходимо весовое количество кислоты, содержащееся в 1 л раствора (196 г), разделить на эквивалентную массу (ЭH2SO4).
Эквивалентная масса H2SO4 равна ее молярной массе, деленной на количество атомов водорода:
Э
=
![]() = 49 г.
= 49 г.
Следовательно,
Сэк
=
![]() = 4 мольэкв/л.
= 4 мольэкв/л.
Молярную концентрацию эквивалента также можно вычислить, используя формулу
![]() .
.
5.Рассчитываем моляльность раствора; для этого необходимо найти количество молей кислоты, содержащееся в 1000 г растворителя (воды).
Из предыдущих расчетов (см. пункт 3) известно, что в 1120 г (1 л) раствора содержится 196 г или 2 моля H2SO4, следовательно, воды в таком растворе:
1120 - 196 = 924 г.
Составляем пропорцию:
на 924 г воды приходится 2 моля H2SO4
на 1000 г воды - х.
Сm
= х =
![]() = 2,16 моль/1000 г воды.
= 2,16 моль/1000 г воды.
Моляльную
концентрацию можно также рассчитать
по формуле (1.3): Cm
=
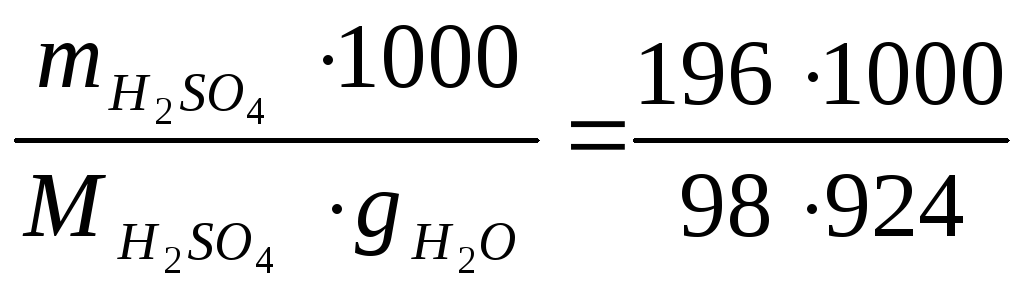 =
2,16 моль/1000 г воды.
=
2,16 моль/1000 г воды.
Ответ: Т = 0,196 г/мл; [H2SO4] = 2 моль/л; Cэк = 4 мольэкв/л;
Сm = 2,16 моль/1000 г воды.
Пример 3. Сколько миллилитров 96%-ного раствора H2SO4 ( = 1,84 г/см3) потребуется для приготовления 1л раствора ее с молярной концентрацией эквивалента, равной 0,5?
Решение.
1.Рассчитываем весовое количество H2SO4, необходимое для приготовления 1 л раствора с молярной концентрацией эквивалента, равной 0,5 ( эквивалент серной кислоты равен 49 г):
в 1000 мл 0,5 Н раствора содержится 49 . 0,5 = 24,5 г Н2SO4.
2.Определяем весовое количество исходного (96%но-го) раствора, содержащего 24,5 г Н2SO4:
в 100 г раствора содержится 96 г H2SO4,
в х г раствора - 24,5 г Н2SO4.
x
=
![]() = 25,52 г
= 25,52 г
3.Находим необходимый объем исходного раствора, разделив весовое количество раствора на его плотность ():
V
=
![]() = 13,87 мл.
= 13,87 мл.
Ответ: для приготовления 1л раствора серной кислоты с молярной концентрацией эквивалента 0,5, необходимо 13,87 мл 96%-го раствора Н2SO4.
Пример 4. Раствор, приготовленный из 2 кг (m) этилового спирта и 8 кг (g) воды, залили в радиатор автомобиля. Вычислить температуру замерзания раствора. Криоскопическая константа воды Kк равна 1,86.
Решение.
1.Находим понижение температуры замерзания раствора, используя следствие из закона Рауля:
тз
=
KкСm
= Kк![]() .
.
Молярная масса С2Н5ОН равна 46 г/моль, следовательно,
Тз
=
1,86
![]() = 10,1оС.
= 10,1оС.
2.Находим температуру замерзания раствора:
Тз = 0 - 10,1 = - 10,1 оС.
Ответ: раствор замерзает при температуре -10,1 оС.
