
- •Е. А. Михайлов, н. А. Мухин
- •150023. Ярославль, Московский пр., 88.
- •1. Атмосфера, погода, климат
- •2. Метеорологические наблюдения
- •3. Применение карт
- •4. Метеорологическая служба
- •5. Климатообразующие процессы
- •6. Астрономические факторы
- •7. Геофизические факторы
- •8. Метеорологические факторы
- •9. О солнечной радиации
- •До поступления в атмосферу (1) и в спектре абсолютно черного тела
- •10. Тепловое и лучистое равновесие Земли
- •11. Прямая солнечная радиация
- •12. Изменения солнечной радиации в атмосфере и на земной поверхности
- •13. Явления, связанные с рассеянием радиации
- •14. Цветовые явления в атмосфере
- •15. Суммарная и отраженная радиации
- •15.1. Излучение земной поверхности
- •15.2. Встречное излучение или противоизлучение
- •16. Радиационный баланс земной поверхности
- •17. Географическое распределение радиационного баланса
- •18. Атмосферное давление и барическое поле
- •19. Барические системы
- •20. Колебания давления
- •21. Ускорение воздуха под действием барического градиента
- •22. Отклоняющая сила вращения Земли
- •На север со скоростью ав
- •23. Геострофический и градиентный ветер
- •24. Барический закон ветра
- •25. Тепловой режим атмосферы
- •26. Тепловой баланс земной поверхности
- •27. Суточный и годовой ход температуры на поверхности почвы
- •28. Температуры воздушных масс
- •29. Годовая амплитуда температуры воздуха
- •30. Континентальность климата
- •В Торсхавне (1) и Якутске (2) [2]
- •31. Облачность и осадки
- •32. Испарение и насыщение
- •В зависимости от температуры [2]
- •33. Влажность
- •34. Географическое распределение влажности воздуха
- •35. Конденсация в атмосфере
- •36. Облака
- •37. Международная классификация облаков
- •38. Облачность, ее суточный и годовой ход
- •39. Осадки, выпадающие из облаков (классификация осадков)
- •40. Характеристика режима осадков
- •41. Годовой ход осадков
- •42. Климатическое значение снежного покрова
- •43. Химия атмосферы
- •Некоторых атмосферных компонентов (Суркова г.В., 2002)
- •44. Химический состав атмосферы Земли
- •45. Химический состав облаков
- •46. Химический состав осадков
- •В последовательных фракциях дождя
- •В последовательных равных по объему пробах дождя (по оси абсцисс отложены номера проб, с 1 по 6), Москва, 6 июня 1991 г.
- •В осадках разного вида, в облаках и туманах
- •47. Кислотность осадков
- •48. Общая циркуляция атмосферы
- •На уровне моря в январе, гПа [2]
- •На уровне моря в июле, гПа [2]
- •48.1. Циркуляция в тропиках
- •48.2. Пассаты
- •48.3. Муссоны
- •48.4. Внетропическая циркуляция
- •48.5. Внетропические циклоны
- •48.6. Погода в циклоне
- •48.7. Антициклоны
- •48.8. Климатообразование
- •Атмосфера – океан – поверхность снега, льда и суши – биомасса [2]
- •49. Теории климата
- •50. Климатические циклы
- •51. Возможные причины и методы изучения изменений климата
- •52. Естественная динамика климата геологического прошлого
- •Изученные различными методами (Васильчук ю.К., Котляков в.М., 2000):
- •Из скважины 5г 00:
- •На севере Сибири в течение ключевых моментов позднеплейстоценового
- •Криохрона 30-25 тыс. Лет назад (а) и – 22-14 тыс. Лет назад (б).
- •В точках опробования дробь: в числителе среднеянварская температура,
- •В знаменателе – средние значения 18o для данного временного интервала
- •Со ст. Кемп Сенчури за последние 15 тыс. Лет
- •На севере Сибири в течение оптимума голоцена 9-4,5 тыс. Лет назад
- •53. Климат в историческое время
- •54. События Хайнриха и Дансгора
- •55. Типы климатов
- •55.1. Экваториальный климат
- •55.2. Климат тропических муссонов (субэкваториальный)
- •55.3. Тип континентальных тропических муссонов
- •55.4. Тип океанических тропических муссонов
- •55.5. Тип тропических муссонов западных берегов
- •55.6. Тип тропических муссонов восточных берегов
- •55.7. Тропические климаты
- •55.8. Континентальный тропический климат
- •55.9. Океанический тропический климат
- •55.10. Климат восточной периферии океанических антициклонов
- •55.11. Климат западной периферии океанических антициклонов
- •55.12. Субтропические климаты
- •55.13. Континентальный субтропический климат
- •55.14. Океанический субтропический климат
- •55.15. Субтропический климат западных берегов (средиземноморский)
- •55.16. Субтропический климат восточных берегов (муссонный)
- •55.17. Климаты умеренных широт
- •55.18. Континентальный климат умеренных широт
- •55.19. Климат западных частей материков в умеренных широтах
- •55.20. Климат восточных частей материков в умеренных широтах
- •55.21. Океанический климат в умеренных широтах
- •55.22. Субполярный климат
- •55.23. Климат Арктики
- •55.24. Климат Антарктиды
- •56. Микроклимат и фитоклимат
- •57. Микроклимат как явление приземного слоя
- •58. Методы исследования микроклимата
- •58.1. Микроклимат пересеченной местности
- •58.2. Микроклимат города
- •58.3. Фитоклимат
- •58. Влияние человека на климат
- •За 1957–1993 гг. На Гавайских островах и Южном полюсе
- •60. Современные изменения климата
- •У поверхности Земли относительно температуры 1990 г.
- •61. Антропогенные изменения и моделирование климата
- •(Средних за год, глобально осредненных – черная линия) с результатами моделирования (серый фон), полученными при учете изменений [3]:
- •И воспроизведенными для этого же года модельными аномалиями [3]:
- •От температуры до индустриального состояния (1880–1889) за счет роста парниковых газов и тропосферных аэрозолей [3]:
- •62. Синоптический анализ и прогноз погоды
- •Заключение
- •Библиографический список
43. Химия атмосферы
В атмосфере различные вещества существуют в виде молекул, атомов, радикалов, ионов или их комплексов.
От момента поступления вещества в атмосферу до выведения его из атмосферы проходит некоторое время (Т), называемое временем пребывания вещества в атмосфере или временем выведения примесей из атмосферы.
Время пребывания различается от долей секунды для радикала гидроксила до 2 106 лет для гелия (рис. 8, таблица 2). Следовательно, на некотором отрезке времени атмосфера может рассматриваться как резервуар по отношению к рассматриваемому веществу.
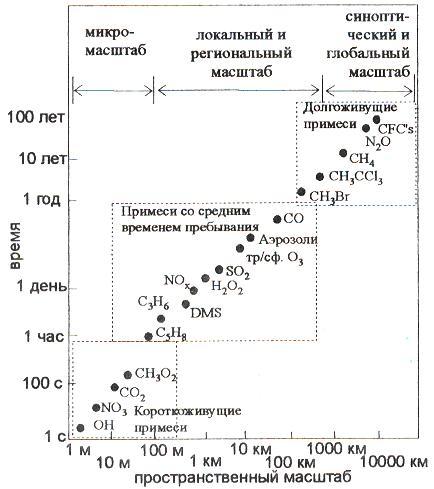
Рис. 8. Пространственные и временные масштабы изменчивости
Некоторых атмосферных компонентов (Суркова г.В., 2002)
Таблица 2 - Время пребывания веществ в атмосфере
|
Вещество |
Химическая формула |
Среднее время пребывания в атмосфере |
|
Гелий |
Не |
10 млн лет |
|
Азот |
N2 |
1…20 млн лет |
|
Кислород |
O2 |
5…10 тыс. лет |
|
Диоксид углерода |
CO2 |
5…10 лет |
|
Водород |
Н2 |
4…8 лет |
|
Метан |
CH4 |
4…7 лет |
|
Оксид азота (I) |
N2O |
2,5…4 года |
|
Озон |
O3 |
0,3…2 года |
|
Оксид углерода |
CO |
0,2…0,5 лет |
|
Вода |
H2O |
10 суток |
|
Сульфат-ион |
|
10 суток |
|
Оксид азота (II) |
NO |
9 суток |
|
Ион аммония |
|
6 суток |
|
Аммиак |
NH3 |
2…4 дня |
|
Нитрат-ион |
|
5 суток |
|
Диоксид серы |
SO2 |
5…6 суток |
|
Сероводород |
H2S |
0,5…4 суток |
Большие значения Т для некоторых веществ (аргона, гелия, азота и др.) не означают, что именно столько времени молекулы будут находиться в атмосфере. Они могут быть выведены из атмосферы и раньше. Величины Т, представленные на рис. 8, – это максимально возможное время пребывания вещества в резервуаре (в данном случае – в атмосфере) при данном объеме (А) вещества в резервуаре и данных интенсивностях источников и стоков (Суркова Г. В., 2002).
Величина, обратная времени пребывания Т-1 называется скоростью выведения газов из атмосферы.
44. Химический состав атмосферы Земли
Состав воздуха изучался с давних времен. Некоторые ученые древности (Анаксимен, VI в. до н.э.) даже полагали, что воздух – это перво-вещество, из разрежений и уплотнений которого состоит все: вода, камни, растения, животные, человек.
В XVII веке в связи с бурным развитием химии были выдвинуты новые гипотезы относительно происхождения и состава воздуха. Основной спор велся относительно того, является ли воздух смесью или же представляет собой химическое соединение. Последняя версия на некоторое время одержала верх. Объяснение было следующим: если воздух – смесь, а не вещество, то под действием силы тяжести должно происходить разделение газов по весу. Тогда атмосфера должна была бы напоминать слоеный пирог – тяжелые газы были бы внизу, а легкие – наверху. Ошибочностью этой теории был неучет процесса перемешивания газов.
В 80-е годы XVIII в. Генри Кавендишу удалось провести наиболее точный на тот период анализ состава воздуха и выделить кислород и азот. После взвешивания, правда, обнаружился некий остаток, но его сочли тогда ошибкой измерений. Лишь в конце XIX в. опыты Дж. Рэлея и У. Рамзая показали, что это – не ошибка. Инертным остатком оказался аргон.
Дальнейшие исследования выявили содержание в атмосфере и других газов (табл. 3, 4). Их содержание по сравнению с азотом, кислородом и аргоном очень мало. Но от этого не меньше важность их присутствия в атмосфере и роль в развитии географической оболочки в ходе всей истории формирования Земли.
Все газы и примеси, содержащиеся в атмосфере, можно разделить на пять групп.
1. Основные газовые составляющие воздуха – азот, кислород и аргон (см. табл. 3). На их долю приходится 99,96% массы атмосферы. Соотношение их содержания (N2 – 78,1%, О2 – 20,9% и Аr – 0,9%) сохраняется до высоты порядка 100 км.
Таблица 3 - Состав сухого воздуха у поверхности Земли
|
Газ |
Доля* по объему вблизи поверхности Земли, % |
Относительная молекулярная масса |
Плотность по отношению к плотности сухого воздуха |
|
Азот (N2) |
78,084 |
28,0134 |
0,967 |
|
Кислород (О2) |
20,946 |
31,9988 |
1,105 |
|
Аргон (Ar) |
0,934 |
39,948 |
1,379 |
|
Углекислый газ (СО2) |
0,033 |
44,00995 |
1,529 |
|
Неон (Ne) |
1,818 10-3 |
20,183 |
0,095 |
|
Гелий (He) |
5,239 10-4 |
4,0026 |
0,138 |
|
Криптон (Kr) |
1,14 10-4 |
83,800 |
2,868 |
|
Водород (Н2) |
5 10-5 |
2,01594 |
0,070 |
|
Ксенон (Хе) |
8,7 10-6 |
131,300 |
4,524 |
|
Озон (О3) |
10-6…10-5 |
47,9982 |
1,624 |
|
Сухой воздух |
– |
28,9645 |
1,000 |
Примечание:* Выраженное в процентах отношение объема, занимаемого данной газовой составляющей, к общему объему смеси при условии приведения их к одинаковым давлению и температуре.
Таблица 4 - Некоторые малые газовые составляющие в атмосфере, содержание которых наиболее подвержено антропогенному влиянию
|
Газ |
Название |
Концентрация у поверхности, млн-1 |
Тренд концентрации в атмосфере, % в год |
Время жизни в атмосфере, лет |
|
СО2 |
Диоксид углерода |
358 |
0,4 |
50…200 |
|
СН4 |
Метан |
1,72 |
0,6 |
10…12 |
|
СО |
Оксид углерода |
0,12 сев. п/ш 0,06 ю. п/ш 0,31 глоб. |
1 сев. п/ш 0 ю. п/ш 0,3 глоб. |
0,3 |
|
NO2 |
Оксид азота |
0,31 |
0,3 |
150 |
|
CFCl3 |
Фреон-11 |
2,6 10-4 |
4 |
70 |
|
CF2Cl2 |
Фреон-12 |
4,4 10-4 |
4 |
120 |
|
C2Cl3F3 |
Фреон-113 |
3,2 10-5 |
10 |
90 |
|
CH3CCl3 |
Метилхлороформ |
1,2 10-4 |
4,5 |
6 |
|
CF2ClBr |
На-1211 |
1 10-6 |
12 |
12…15 |
|
CF3Br |
На-1301 |
1 10-6 |
12 |
12…15 |
|
SO2 |
Оксид серы |
(1–20) 10-5 |
Неизвестно |
0,02 |
|
COS |
Карбонил серы |
5 10-4 |
Менее 3 |
2…2,5 |
2. Малые газовые составляющие (МГС). Эти газы в небольшом количестве всегда присутствуют в атмосфере, хотя это количество может варьировать в различных местах земного шара. Наиболее важные малые газы – озон О3, углекислый газ СО2, метан СН4, оксид углерода СО, закись азота N2О (см. табл. 3 и 4).
Малые газы активно участвуют в химических превращениях. Кроме того, они оптически активны и способны поглощать коротковолновую и длинноволновую радиацию на разных участках спектра. Это свойство делает их чрезвычайно важными с точки зрения климатообразования. Концентрация этих газов в атмосфере контролируется как природными процессами, так и антропогенной деятельностью.
К малым газовым составляющим можно отнести и водяной пар, также играющий важную роль в формировании радиационного баланса Земли и химических процессах в атмосфере.
3. Неустойчивые молекулы и атомы (свободные радикалы). Их число в атмосфере невелико. За счет своей высокой реакционной способности время их пребывания в атмосфере иногда достигает доли секунды. К ним относятся атомный кислород (О), гидроксил (ОН), пергидроксил (НО2), оксид хлора (ClO) и другие молекулы и частицы. Многие из них образуются в результате фотодиссоциации молекул под воздействием солнечного излучения, в особенности в его ультрафиолетовой части спектра.
4. Аэрозоли – твердые и жидкие мелкие частицы, взвешенные в воздухе. Их состав, размеры и происхождение довольно разнообразны. Они имеют большую площадь поверхности относительно своей массы, что, при достаточно длительном времени их пребывания в атмосфере, позволяет им активно участвовать в гетерогенных химических реакциях со следовыми газами и радикалами.
5. Антропогенные примеси, полностью или частично поступающие в атмосферу за счет хозяйственной деятельности человека. Среди них наибольшие концентрации в атмосфере имеют углекислый газ, метан, оксид углерода и оксиды азота.
