
экзамен физика
.docxТермодинамика.мкт.
1.Термодинамика
—
раздел физики,
изучающий соотношения и превращения
теплоты и других форм энергии.
Температура характеризует
термодинамическое равновесное состояние
системы и определяет направление
теплообмена между телами. МКТ идеал.газов:
1) V
молейкул газа приближимо мало по
сравнению с V
сосуда в котором они находятся. 2) Между
молейкулами газа отсутствует сила
взаимодействия. 3) Столкновения все
абсалютно упругие. Моль: содержит
столько же элементов сколько и 12грамм
изотопа
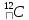 .
Закон
АВАГАДРО-
моли любых газов при одинаковой
температуре и давлении занимают
одинаковые объемы.
.
Закон
АВАГАДРО-
моли любых газов при одинаковой
температуре и давлении занимают
одинаковые объемы.
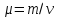 Закон
Дальтона
- давлении смеси газов равно сумме
порциальных давлений входящих в нее
газов.
Закон
Дальтона
- давлении смеси газов равно сумме
порциальных давлений входящих в нее
газов.
p-const, T-const, pV=const изотерма- Закон Бойля-Мариотто.
Имперические
законы Гей-Люсака:m=const
 при
V
const
- изохорда.
при
V
const
- изохорда.
 при p
const - изобара.
при p
const - изобара.
 V=P=0
V=P=0
2.
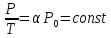 - Закон
Шарля
-
- Закон
Шарля
-
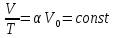 .
Уравнение
сост. идеал.газа:
.
Уравнение
сост. идеал.газа: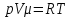 p1v1/T1=p2v2/T2
p=nkT
n=N(a)/V(m)=N/V
p1v1/T1=p2v2/T2
p=nkT
n=N(a)/V(m)=N/V
3.Основное
уравнение МКТ: ![]()
![]()
![]()
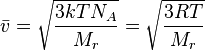
![]() ,
где
,
где ![]() — молярная
масса газа,
— молярная
масса газа, ![]() —
масса молекулы газа.
—
масса молекулы газа.
4.
Первое
начало термодинамики :
1)Изменение
внутренней энергии системы при переходе
её из одного состояния в другое равно
сумме работы внешних сил и количества
теплоты, переданного системе, то есть,
оно зависит только от начального и
конечного состояния системы и не зависит
от способа, которым осуществляется этот
переход.2) В любой изолированной системе
запас энергии остаётся постоянным.3)
Количество
теплоты,
полученное системой, идёт на изменение
её внутренней энергии и совершение
работы против внешних сил.
![]() .
.
![]()
Теплоемкость идеального газа: (отнош.Q сообщ.газу к изменению T )
5.
Политропный
процесс, — термодинамический
процесс,
во время которого удельная
теплоёмкость газа остаётся
неизменной. Для
идеального газа уравнение политропы
может быть записано в виде:
![]() n-показатель
политропы.
n-показатель
политропы.
![]()
6.
Работа(1 закон термодинамики).
![]() -элементарная.
δAвнеш.сил=-δAгаза=
-элементарная.
δAвнеш.сил=-δAгаза=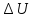 -
адиабата
Q=A'-
изотерма.
-
адиабата
Q=A'-
изотерма.
![]() -изобара
-изобара
![]() -изохорда.
-изохорда.
7.
Степень свободы - число независимых
координат определяющих положение
системы либо отдельных молейкул. 1 группа
- координаты задающие положение центра
масс молейкул., поступательные степени
свободы, они ограничивают степени
свободы одноатомных молейкул. 2 группа
- 2 степени свободы, вращат. степени
свободы в 2-х атомной молейкуле. 3 группа
- колебательные степени свободы 1
колебательная степень для 2-х атомной
молейкулы. 4 группа - если больше атомов
то больше степеней свободы. На каждую
степень свободы приходится 1/2кТ.
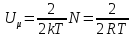
8.
Распределание Максвела: Df(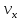 )
- функция распределения скоростей вдоль
оси Х. dPx
=
)
- функция распределения скоростей вдоль
оси Х. dPx
=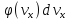 -
вероятность того что компонента некотрой
скорости некоторой молейкулы имеет
предел.
-
вероятность того что компонента некотрой
скорости некоторой молейкулы имеет
предел.
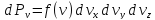 - вероятность того, что молейкула имеет
скорость лежащую в интервале
- вероятность того, что молейкула имеет
скорость лежащую в интервале
 .
d
.
d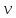 - элемент
объема в фазовом пространстве скоростей.
- элемент
объема в фазовом пространстве скоростей.
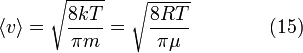
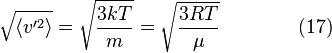
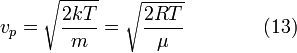 ----наиболее вероятная
скорость.
----наиболее вероятная
скорость.
9. Опыт
Ламерта
Колеса
селектора, на поверхности которых
находятся выступы, пропускающие или
останавливающие летящие молекулы,
вращаются с угловой скоростью ![]() .
Так, преодолев первое колесо, молекула
летит расстояние
.
Так, преодолев первое колесо, молекула
летит расстояние ![]() до
второго, которое за это время поворачивается
на угол
до
второго, которое за это время поворачивается
на угол ![]() .
Выполняется соотношение
и Штерна. всю
систему начинали вращать с некой
достаточно большойугловой
скоростью ω.
При этом полоса налёта смещалась в
сторону, противоположную направлению
вращения, и теряла чёткость. Измерив
смещение s наиболее
тёмной части полосы от её положения,
когда система покоилась, Штерн определил
время полёта, через которое нашёл
скорость движения молекул.
s —
смещение полосы, l —
расстояние между цилиндрами, а u —
скорость движения точек внешнего
цилиндра.
.
Выполняется соотношение
и Штерна. всю
систему начинали вращать с некой
достаточно большойугловой
скоростью ω.
При этом полоса налёта смещалась в
сторону, противоположную направлению
вращения, и теряла чёткость. Измерив
смещение s наиболее
тёмной части полосы от её положения,
когда система покоилась, Штерн определил
время полёта, через которое нашёл
скорость движения молекул.
s —
смещение полосы, l —
расстояние между цилиндрами, а u —
скорость движения точек внешнего
цилиндра.
![]() ,
,
![]()
P=nkT
pV= RT
F=-grad U
RT
F=-grad U
10. распределение Больтсмана: равновесное Это распределение позволяет рассчитывать концентрацию газа, находящегося в равновесном состоянии во внешнем силовом поле. Причем это поле не должно быть обязательно гравитационным, а может иметь любое происхождение, в частности, быть электростатическим или полем сил инерции.
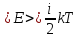 - средняя энергия
молейкул. На вращат. степень свободы -
1/2kT
, на колебат.степ.своб.-1/2кТ,
i=zпост.+zвращ.+2zколеб.
- средняя энергия
молейкул. На вращат. степень свободы -
1/2kT
, на колебат.степ.своб.-1/2кТ,
i=zпост.+zвращ.+2zколеб.
Барометрическая
формула —
зависимость давления или плотности
газа от высоты в поле силы тяжести. Для
идеального
газа, имеющего постоянную температуру
![]() и
находящегося в однородном поле тяжести
(во всех точках его объёма ускорение
свободного падения
и
находящегося в однородном поле тяжести
(во всех точках его объёма ускорение
свободного падения
![]() одинаково),
барометрическая формула имеет следующий
вид:
одинаково),
барометрическая формула имеет следующий
вид:
![]()
где
![]() —
давление газа в слое, расположенном на
высоте
—
давление газа в слое, расположенном на
высоте
![]() ,
,
![]() —
давление на нулевом уровне (
—
давление на нулевом уровне (![]() ),
),
![]() —
молярная
масса газа,
—
молярная
масса газа,
![]() —
универсальная
газовая постоянная,
—
универсальная
газовая постоянная,
![]() —
абсолютная
температура
—
абсолютная
температура
11.
![]()
12. Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Энтропия - мера вероятности осуществления какого-либо макроскопического состояния;
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Для
любой квазиравновесной термодинамической
системы существует однозначная функция
термодинамического состояния ![]() ,
называемая энтропией, такая, что ее
полный дифференциал
,
называемая энтропией, такая, что ее
полный дифференциал ![]() где
где ![]() —
приращение энтропии;
—
приращение энтропии; ![]() —
минимальная теплота, подведённая к
системе;
—
минимальная теплота, подведённая к
системе; ![]() —
абсолютная температура процесса.
—
абсолютная температура процесса.
13.
О вычислении и применении энтропии.
Статический смысл энтропии.
В
1877 году Людвиг Больцман установил связь
энтропии с вероятностью данного
состояния. Позднее эту связь представил
в виде формулы Макс Планк:
где
константа 1,38·10−23 Дж/К названа Планком
постоянной Больцмана, а — статистический
вес состояния, является числом возможных
микросостояний (способов), с помощью
которых можно составить данное
макроскопическое состояние. Этот
постулат, названный Альбертом Эйнштейном
принципом Больцмана, положил начало
статистической механике, которая
описывает термодинамические системы,
используя статистическое поведение
составляющих их компонентов. Принцип
Больцмана связывает микроскопические
свойства системы () с одним из её
термодинамических свойств ().
Рассмотрим,
например, идеальный газ в сосуде.
Микросостояние определено как позиции
и импульсы (моменты движения) каждого
составляющего систему атома. Связность
предъявляет к нам требования рассматривать
только те микросостояния, для которых:
(I) месторасположения всех частей
расположены в рамках сосуда, (II) для
получения общей энергии газа кинетические
энергии атомов суммируются.
Согласно
определению, энтропия является функцией
состояния, то есть не зависит от способа
достижения этого состояния, а определяется
параметрами этого состояния. Так как
может быть только натуральным числом
(1, 2, 3, …), то энтропия Больцмана должна
быть неотрицательной — исходя из свойств
логарифма
![]() а
а
![]() —
статистический
вес состояния, является числом
возможных микросостояний
—
статистический
вес состояния, является числом
возможных микросостояний
14. Циклы. Тепловые и холодильные машины. Цикл Карно. Теорема Карно
Круговые процессы изображаются в термодинамических диаграммах в виде замкнутых кривых. Работа против внешнего давления, совершаемая системой в обратимом круговом процессе, измеряется площадью, ограниченной кривой этого процесса в диаграмме V - р. Прямым циклом называется круговой процесс, в котором система совершает положительную работу: А > 0. В диаграмме V - p прямой цикл изображается в виде замкнутой кривой, проходимой рабочим телом по часовой стрелке. Обратным, циклом называется круговой процесс, в котором работа, совершаемая системой, отрицательна А < 0. В диаграмме V - p обратный цикл изображается в виде замкнутой кривой, проходимой рабочим телом против часовой стрелки. В тепловом двигателе рабочее тело совершает прямой цикл, а в холодильной машине - обратный цикл.
Пусть тепловая
машина состоит из нагревателя с
температурой
![]() ,
холодильника с температурой
,
холодильника с температурой
![]() и
рабочего
тела.
и
рабочего
тела.
Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две — при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия).
1. Изотермическое расширение (на
рис. 1 — процесс A→Б). В начале процесса
рабочее тело имеет температуру
![]() ,
то есть температуру нагревателя. Затем
тело приводится в контакт с нагревателем,
который изотермически (при постоянной
температуре) передаёт ему количество
теплоты
,
то есть температуру нагревателя. Затем
тело приводится в контакт с нагревателем,
который изотермически (при постоянной
температуре) передаёт ему количество
теплоты
![]() .
При этом объём рабочего тела увеличивается,
оно совершает механическую работу, а
его энтропия возрастает.
.
При этом объём рабочего тела увеличивается,
оно совершает механическую работу, а
его энтропия возрастает.
2. Адиабатическое расширение (на
рис. 1 — процесс Б→В). Рабочее тело
отсоединяется от нагревателя и продолжает
расширяться без теплообмена с окружающей
средой. При этом температура тела
уменьшается до температуры холодильника
![]() ,
тело совершает механическую работу, а
энтропия остаётся постоянной.
,
тело совершает механическую работу, а
энтропия остаётся постоянной.
3. Изотермическое сжатие (на рис. 1 —
процесс В→Г). Рабочее тело, имеющее
температуру
![]() ,
приводится в контакт с холодильником
и начинает изотермически сжиматься под
действием внешней силы, отдавая
холодильнику количество теплоты
,
приводится в контакт с холодильником
и начинает изотермически сжиматься под
действием внешней силы, отдавая
холодильнику количество теплоты
![]() .
Над телом совершается работа, его
энтропия уменьшается.
.
Над телом совершается работа, его
энтропия уменьшается.
4. Адиабатическое сжатие (на рис. 1 — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается под действием внешней силы без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя, над телом совершается работа, его энтропия остаётся постоянной.
Теорема Карно — теорема о коэффициенте полезного действия (КПД) тепловых двигателей. Согласно этой теореме, КПД цикла Карно не зависит от природы рабочего тела и конструкции теплового двигателя и является функцией температур нагревателя и холодильника[1].
15. реальные газы. Газ Ван-дер Вальса, его внутренняя энергия. Изотермы газа Ван-дер Вальса и реальных газов.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами
показывают, что молекулы в реальном
газе взаимодействуют между собой и
занимают определенный объём. Состояние
реального газа часто на практике
описывается обобщённым уравнением
Менделеева — Клапейрона:![]() Уравнение
состояния газа Ван-дер-Ваальса —
уравнение,
связывающее основные термодинамические
величины в модели газа Ван-дер-Ваальса.
Уравнение
состояния газа Ван-дер-Ваальса —
уравнение,
связывающее основные термодинамические
величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для более точного описания поведения
реальных газов при низких температурах
была создана модель газа Ван-дер-Ваальса,
учитывающая силы межмолекулярного
взаимодействия. В этой модели внутренняя
энергия
![]() становится
функцией не только температуры,
но и объёма.
становится
функцией не только температуры,
но и объёма.
Уравнение Ван-дер-Ваальса — это одно из широко известных приближённых уравнений состояния, имеющее компактную форму и учитывающее основные характеристики газа с межмолекулярным взаимодействием[1].
