
чло при иммунопат
.docx-
образование на поверхности зубов тонкой пленки из протеинов, содержащихся в слюне;
-
неспецифическое, обратимое закрепление отдельных бактерий на внешней поверхности протеиновой пленки;
-
специфическое, необратимое взаимодействие так называемых адгезинов закрепившихся бактерий и содержащихся в пленке молекул-рецепторов;
-
закрепление новых и размножение уже закрепившихся бактерий;
-
выделение полисахаридов в процессе жизнедеятельности закрепившихся бактерий и «разрастание» бактериального налета.
Так образуется пространственно структурированное объединение различных штаммов микроорганизмов, которое закрепляется на поверхности зубов и продолжает свое существование во внеклеточной матрице, состоящей из полисахаридов, выделяемых ими в процессе своей жизнедеятельности. Кариозные повреждения твердых тканей зубов начинают образовываться сразу после того, как ускоренное селективное размножение ацидогенных микроорганизмов (Streptococcus mutans и Streptococcus sorbinus) приводит к необратимому нарушению равновесия, установившегося между различными бактериями, которые входят в состав микрофлоры бактериального налета. В 1 мг вещества зубного налета содержатся до 2,5 млн. микробных клеток. Образование зубного налета происходит с участием «приклеивающихся» к поверхности зуба инфицированных микроорганизмами эпителиальных клеток, преципитации внеклеточных полисахаридов и гликопротеинов слюны, образующихся при разрушении бактерий. При отложении в зубном налете неорганических веществ наблюдается его минерализация с образованием зубного камня. В зубном налете содержится большое количество различных бактерий и грибов, но доминируют кариесогенные стрептококки и лактобактерии. В процессе их жизнедеятельности (рост микробных колоний в зубном налете подобен их росту на агаре) образуется значительное количество органических кислот: уксусной, молочной, муравьиной и пропионовой, непосредственно контактирующих с минеральными веществами эмали. В частности, ионы водорода, накапливающиеся в зоне длительного источника кислотообразования (что наблюдается при нарушении микроэкологического равновесия в полости, индуцированном иммунодефицитным состоянием), соприкасаются с апатитами и растворяют их. Растворение может быть равномерным, если кислотообразование на поверхности эмали происходит достаточно активно, или неравномерным, если образовавшиеся кислоты частично нейтрализуются компонентами слюны. В силу того, что поверхностный слой эмали трудно растворим (в нем больше фторапатитов), ионы водорода по межкристаллическим пространствам попадают в подповерхностный слой, где вызывают деминерализацию. Освободившиеся ионы кальция, фосфора и других элементов выходят в ротовую жидкость. При продолжающемся образовании кислоты (рН зубного налета в области поражения снижается до 5,5-5,0) и нарастании процесса деминерализации призменные микропространства увеличиваются. В них проникают органические вещества и микроорганизмы, перенося источник кислотообразования внутрь деминерализованного участка. Таким образом, деминерализация распространяется как параллельно поверхности зуба, так и внутрь, образуя конусовидный кариозный очаг поражения. Деминерализация эмали визуально выражается в изменении ее нормального цвета на ограниченном участке и появлении пятна белого, матового, серого, светло-желтого, коричневого или черного цвета. Кариесогенные штаммы микроорганизмов становятся резистентными к антибиотикам и способны длительно существовать в глубине очага поражения, накапливать углеводы в виде полисахаридов, которые затем могут метаболизироваться в молочную и другие органические кислоты, усиливающие процессы деминерализации эмали. При прогрессировании кариеса нарушаются реминерализующие, буферные, бактерицидные и другие свойства слюны. Секреция слюны уменьшается, резко снижается содержание в ней секреторного IgA, отмечается снижение активности лизоцима и β-лизинов, но повышается активность кислой и щелочной фосфатазы и нарастает содержание молочной кислоты. Формируется «порочный круг» – иммунодефицитное состояние в полости рта нарушает микроэкологическое равновесие (дисбактериоз), что обуславливает гипосаливацию, локальное изменение свойств и состава зубного налета и ротовой жидкости, деминерализацию эмали и прогрессирующее увеличение кариесогенных штаммов микроорганизмов (стрептококков, лактобактерий), усугубляющих иммунодефицитное состояние в полости рта, а также снижающих иммунологическую реактивность и неспецифическую резистентность организма, что в конечном итоге и обуславливает прогрессирование кариозного процесса. Снижение уровня IgA, активности комплемента, возрастание активности С-реактивного белка способствуют постоянной агрессии микробов, что приводит к нарушениям функциональной активности фагоцитирующих и эпителиальных клеток, отражается на выработке ими цитокинов, влечет за собой деструктивные изменения базального эпителия, нарушая связь с подлежащей соединительной тканью. Клинически это проявляется развитием гингивита, пародонтита, стоматита. В зоне поражения пародонта увеличивается численность иммунокомпетентных клеток, особенно Th2 клеток (продуцирующих ИЛ-4,5,6,10,13), что способствует поликлональной активации В-лимфоцитов. Низкая эффективность противомикробных механизмов защиты приводит к развитию хронического воспаления с явлениями деструкции соединительной и костной ткани, а также к росту грануляционной ткани. Недостаточность фагоцитарно-клеточной защиты в ротовой полости у больных агранулоцитозом приводит к неконтролируемому размножению микроорганизмов, токсины которых вызывают развитие некротического повреждения эпителия слизистой оболочки ротовой полости: язвенно-некротический гингивит, эрозивный стоматит. Методы оценки иммунного статуса Лабораторные тесты I уровня: 1. Определение удельного веса (%) и абсолютного количества Т-лимфоцитов (CD3); 2. Определение количества В-лимфоцитов (CD20, 22); 3. Определение показателей фагоцитоза - фагоцитарная активность или процент фагоцитирующих нейтрофилов - фагоцитарное число – среднее число микробов (или тест-частиц) в 1 фагоците; 4. Определение содержания иммуноглобулинов основных классов (IgM, IgG, IgA). Лабораторные тесты II уровня: 1. Определение субпопуляций Т-лимфоцитов: Т-хелперы (CD4), Т-цитотоксические (CD8); 2. Опреление функциональной активности лимфоцитов – в реакции бластной трансформации на ФГА, КонА; 3. Определение цитокинов: провоспалительных (ИЛ-1, ФНО-α, ИЛ-5, ИЛ-6, ИЛ-12, ИФН), противовоспалительных (ИЛ-4, ИЛ-10, ИЛ-13, ТФР-β), Th1 (Т-хелперов I типа) – ИЛ-2, ИФН-γ, Th2 (Т-хелперов II типа) – ИЛ-4, ИЛ-10; 4. Определение компонентов системы комплемента; 5. Определение кислородзависимых и кислороднезависимых механизмов бактерицидности нейтрофилов и макрофагов; 6. Исследование секреторной функции макрофагов; 7. Внутрикожная проба с туберкулином для оценки состояния Т-клеточного иммунитета; 8. Определение специфических антител, циркулирующих иммунных комплексов. 9. Определение маркеров активации иммунокомпетентных клеток. Нормаграмма основных показателей иммунного статуса представлена в табл. 1. ИММУННЫЙ СТАТУС
ИММУННЫЙ СТАТУС
|
Показатели |
Норма |
Данные обследования |
Показатели |
Норма |
Данные обследования |
|
Лейкоциты |
4-8 Г/л |
|
CD25 абс. число |
7-18% 0,06-0,4 |
|
|
Лимфоциты |
24-30% 1800-2500 |
|
CD54 абс. число |
5-25% 0,045-0,7 |
|
|
Фагоцитарный показатель |
40-90% |
|
CD95 абс. число |
2-6% 0,02-0,05 |
|
|
Фагоцитарное число |
3,0-5,0 |
|
Сывороточные IgA |
1,21-2,64г/л |
|
|
CD3 абс. число |
60-80% 1,0-2,4 |
|
IgM |
0,38-2,17г/л |
|
|
CD22 абс. число |
6-23 0,05-0,6 |
|
IgG |
8,54-11,85г/л |
|
|
CD16 абс. число |
3-20% 0,03-0,5 |
|
ЦИК |
30-50 усл.ед |
|
|
CD4 абс. число |
33-50% 0,6-1,7 |
|
|
|
|
|
CD8 абс. число |
16-39% 0,3-1,0 |
|
|
|
|
|
Индекс CD4/CD8 |
1,5-2,0 |
|
|
|
|
Обозначения: Фагоцитарный показатель: % лейкоцитов, поглотивших тест-частицы; Фагоцитарное число: среднее количество поглощенных частиц; CD3 лимфоциты – Т-лимфоциты; CD22 – В-лимфоциты; CD16 – натуральные киллеры; CD4 – Т-хелперы; CD8 – Т-лимфоциты с цитотоксической и супрессорной функцией; CD25 – активированные Т-лимфоциты с рецептором к ИЛ-2; CD54 – клетки с молекулами ICAM-I; CD95 – клетки экспрессирующие FAS-рецептор (рецептор апоптоза); ЦИК – циркулирующие иммунные комплексы.
5. Общие принципы коррекции иммунодефицитов: 1. Химиотерапия и профилактика. С помощью химиопрофилактики можно значительно улучшить прогноз гипогаммаглобулинемии. Профилактическое введение антибиотиков используют только при комбинированных иммунодефицитах для предотвращения угрозы инфекционных осложнений, грибковых поражений. Обычно рекомендуют высокие дозы антибиотиков узкого спектра действия. Вопрос об иммунизации остается открытым. Кроме того, следует помнить, что при нарушениях клеточного иммунитета абсолютно исключается использование живых вакцин, так как это может привести к генерализованным процессам. 2. Заместительная терапия. Переливание крови при Т-клеточном и комбинированном иммунодефиците связано с угрозой реакции «трансплантат против хозяина». Наиболее безопасно переливание свежей крови, которую предварительно облучают для подавления антигенных свойств лимфоцитов. Заместительная терапия – это способ лечения гипо- и дисгаммаглобулинемии. Используются официальные препараты иммуноглобулинов – пентоглобин, октагам, иммуноглобулин человека, цитотек и другие. Вместе с тем, следует иметь в виду, что на вводимый гамма-глобулин могут возникать нежелательные реакции в виде лихорадки, тахикардии, коллапса, удушья и даже анафилактического шока вследствие наличия агрегированных форм иммуноглобулинов или выработки антител к IgA. 3. Трансплантация вилочковой железы и применение препаратов, полученных из нее (тималин, тимоген). Полагают также, что восстановить иммунологическую компетенцию организма можно с помощью пересадки лимфоидных органов и тканей, тем более что иммунодефициты сопровождаются ослаблением реакций трансплантационного иммунитета. Рекомендуется использовать тимус эмбриона, не достигшего 14 недель, т.е. до приобретения им иммунологической толерантности. Эффективной оказывается пересадка костного мозга. Дискутируется вопрос о применении стволовых клеток. 4. Введение препаратов, полученных из лимфоидной ткани. Используется фактор переноса (трансфер-фактор) – экстракт из лимфоцитов периферической крови донора. С помощью его удается стимулировать Т-клеточный иммунитет, усиливая синтез интерлейкина-2, продукцию гамма-интерферона, повышать активность киллеров. При В-клеточных иммунодефицитах используют миелопид (препарат костно-мозгового происхождения). При тяжелом комбинированном иммунодефиците обычно сочетают введение фактора переноса с пересадкой вилочковой железы. 5. При иммунодефиците, обусловленном пониженной активностью аденозиндезаминазы рекомендуется вводить замороженные эритроциты (успех в 25-30%). При дефиците пуриннуклеозидфосфорилазы эффект достигается трансплантацией костного мозга. 6. Применение иммуномодулирующих препаратов разных групп, в зависимости от выявленного дефекта (Т-, В-лимфоциты, NK-клетки, недостаточность макрофагального звена, дефицит антител и т.д.). Например, при недостаточности Т-звена иммунитета и нарушении процесса активации Th1 типа рационально применение рекомбинантного ИЛ-2 (ронколейкина), который связывается с рецептором на Th (CD25) и стимулирует их функциональную активность.
Глава 2. ПАТОФИЗИОЛОГИЯ АЛЛЕРГИИ Результаты изучения эпидемиологии аллергических реакций и заболеваний в стоматологической практике указывают не только на широкое их распространение, но и на увеличение их частоты. Заболевания слизистой оболочки полости рта и языка аллергической природы диагностируются в 18-42% случаев. Кроме того, нарастает частота аллергических заболеваний у врачей-стоматологов, зубных техников, другого персонала стоматологических учреждений. Знание этиологии и патогенеза аллергических реакций позволяет врачу-стоматологу более эффективно проводить лечение и профилактику аллергических заболеваний. МАТЕРИАЛ ДЛЯ САМОПОДГОТОВКИ (патофизиологические и клинические аспекты учебной темы) 1. Определение понятий: аллергия, аллергические реакции и заболевания, парааллергия, гетероаллергия, идиосинкразия. Аллергия (allos –другой, ergos - действие) – гиперчувствительность или повышенная чувствительность организма к веществам белковой и небелковой природы, приводящая к повреждению клеток и тканей, в основе, которой лежат иммунологические механизмы. Аллергия достаточно часто встречается в стоматологической практике. Ротовая полость может служить входными воротами для множества антигенов/аллергенов, поступающих из окружающей среды и быстро всасывающихся в местах наибольшей проницаемости слизистой ротовой полости (десневые бороздки, дно полости рта). В полости рта, как и в других слизистых оболочках, имеются ассоциированная со слизистой лимфоидная ткань (МАЛТ – Mucosa associated lymphoid tissue), макрофаги, эпителиальные и другие клетки, участвующие в реализации иммунного ответа. Участие MALT в специфическом иммунитете проявляется в продукции плазматическим клетками специфических антител, относящихся, преимущественно, к Ig A и Ig E. Ig A, проходя через эпителиальные клетки, поступает на поверхность слизистой в секреторной форме (s Ig A), которая обеспечивает антибактериальную и противовирусную защиту. Образованные Ig E способны приводить к развитию аллергических заболеваний реагинового типа. Кроме того, в жидкости ротовой полости присутствуют Ig M, Ig G, компоненты системы комплемента и другие факторы. Это создает условие для местных аллергических реакций. Немаловажным фактором является наличие в полости рта условно-патогенных микроорганизмов и условие для персистенции патогенных микробов, что может способствовать сенсибилизации организма. Широкое применение в стоматологии новых лекарственных препаратов (анестетики, антисептики, антибиотики, гормональные препараты), пломбировочных материалов (компоненты полимеров, сополимеры и др.), протезных конструкций, а также работа врача-стоматолога в латексных перчатках, компоненты которых являются потенциальными аллергенами, может приводить к развитию аллергических реакций и аллергических заболеваний, в том числе у медицинского персонала (профессиональная аллергия). Аллергическая реакция – ответная реакция организма на антиген, в основе развития которой лежат иммунологические механизмы. Аллергическое заболевание – болезнь, в основе развития которой лежит повреждение, вызванное иммунной реакцией на аллерген. Парааллергия (аллергоподобная, анафилактоидная реакция, ложная аллергия, псевдоаллергия) – это реакция, клинически сходная с аллергией. Она связана с выбросом БАВ (в том числе, гистамина), однако в ее основе нет иммунологического механизма (взаимодействия антигена и антитела). Причиной развития является прямое воздействие веществ (пищевых: сыр, шоколад и т.д., лекарственных: рентгенконтрастные вещества, йод и др., холода) на клетки-мишени (тучная клетка), их активация и дегрануляция. Патохимическая и патофизиологическая стадии аналогичны с аллергическими. Гетероаллергия – это перекрестная аллергическая реакция на антиген, сходный по химической структуре с тем, который вызвал сенсибилизацию (за счет общих антигенных детерминант). Примером может служить аллергическая реакция на цефалексин у пациента с сенсибилизацией к пенициллину. Идиосинкразия – непереносимость какого-либо вещества, чаще продуктов питания, в основе которой лежит энзимопатия (недостаточность ферментов). 2. Этиология аллергических заболеваний (классификация аллергенов и их характеристика). Аллергены – это вещества (антигены или гаптены), способные вызывать сенсибилизацию (повышенную чувствительность в соответствии с механизмами по Джеллу и Кумбсу) и развитие аллергических реакций. По происхождению аллергены разделяют на:
-
экзогенные;
-
эндогенные.
К экзогенным аллергенам относят: 1). Неинфекционные: - бытовые (домашняя пыль, библиотечная пыль); - эпидермальные (перхоть, шерсть животных, перья птиц, чешуйки рыб, хитин ракообразных); - лекарственные; - пыльцевые (пыльца растений); - пищевые (цитрусовые, шоколад, морепродукты, бобы, томаты и т.д.); - промышленные (красители, металлы и их соли, латекс, эпоксидные смолы и т.д.); - инсектные (яд жалящих насекомых, слюна кусающих, пыль из частиц насекомых). 2). Аллергены инфекционного происхождения: - бактериальные; - грибковые; - вирусные; - протозойные. Эндогенные аллергены подразделяются на: 1) Первичные (хрусталик, мозг, коллоид щитовидной железы, ткань яичка). 2) Вторичные (комплексные, промежуточные). Бытовые аллергены – домашняя пыль, библиотечная пыль. Имеют сложный состав, основу которого составляют продукты жизнедеятельности и сам микроскопический клещ Dermatophagoidus Pteronyssinus его размер 0,2-0,3 мм, реже Dermatophagoidus Flava. Они не паразитируют на человеке, но питаются ороговевшим эпидермисом (в день 500 млн. чешуек со здорового человека). В 1 гр. домашней пыли – 10-100 клещей. Кроме того, в домашнюю пыль входят споры грибов, микроорганизмы, волокна тканей, продукты жизнедеятельности и хитин тараканов и т.д. Эпидермальные – эпидермис животных: кошек, собак, кролика, морской свинки, овцы, лошади и других, волос человека. Перо подушки – птичий эпидермис. Нужно помнить о перекрестных реакциях за счет общей антигенной структуры (при аллергии к перхоти лошади – противопоказание для введения лечебно-профилактических сывороток (противостолбнячной и т.д.)). При аллергии к перу подушки может быть реакция на мясо кур, уток. Пыльцевые – пыльца деревьев, кустарников, злаковых, сорных трав (амброзия, полынь и т.д.). Причиной развития аллергии к пыльце – поллинозов – чаще являются ветроопыляемые растения, т.к. пыльцы много и она очень мелкая, мельче, чем у опыляемых насекомыми (энтемофильные – яблоня, акация и т.д.). По способу действия на иммунную систему аллергены подразделяют на полноценные и неполноценные. Полноценные – способны к самостоятельной индукции аллергии: 1) микроорганизмы и продукты их жизнедеятельности – эндотоксины, экзотоксины; 2) белки любого происхождения. Неполноценные (гаптены) – способны индуцировать аллергическую реакцию после конъюгации с белками организма или клетками: 1. химические вещества (ртуть, мышьяк); 2. дезодорирующие средства; 3. лекарственные препараты (антибиотики, анальгетики и др.); 4. некоторые пищевые продукты и добавки к ним – в частности, тартразин; 5. пластмассы, сополимеры. По способу проникновения их подразделяют на: 1. ингаляционные; 2. пищевые; 3. контактные; 4. парентеральные.
3. Типы аллергических реакций (Джелл, Кумбс, 1975), стадии (по Адо А.Д., 1980) и их патогенез. Основные типы аллергических реакций представлены в таблице 1. Выделяют еще один тип аллергических реакций (V тип) – это смешанный тип, при котором одновременно включаются разные механизмы (кожная базофильная гиперчувствительность, антирецепторные антитела и др.). Таблица 1.
Основные типы реакций гиперчувствительности (по P. Gell, R. Coombs, 1975 г)
|
Показатели |
Тип I |
Тип II |
Тип III |
Тип IV |
|
Название реакции Антиген Антиген- распознающая структура Эффекторный механизм Срок реакции на повторное введение антигена Примеры |
Анафилактическая (гиперчувствитель-ность реагинового типа) Растворимый, обычно экзогенный IgE-антитела, IgG4-антитела Выброс активных субстанций тучными клетками Ранняя фаза 10-30 мин, поздняя фаза 2 ч – 2 сут Бронхиальная аст-ма, поллиноз, ато-пический дерматит, острая крапивница, атопические забо-левания ЖКТ, отек Квинке, анафилактический шок, аллергия на акрилаты, аллергические стоматит и глоссит |
Цитотоксическая Связан с поверх-ностью клетки Антитела IgМ IgG1, IgG3 подклассов Комплемент-зависимый цитолиз (вариант-активации) 3-8 ч Гемолитическая анемия, лейкопения, агранулоцитоз, тромбоцитопения, миастения, некоторые формы миокардитов, васкулитов |
Иммунокомплексная Внеклеточный, растворимый Обычно IgG-антитела, реже IgМ Реакция на от-ложение иммунных комплексов 3-8 ч Сывороточная болезнь, феномен Артюса, иммуно-комп-лексный (постстрептококковый) гломерулонефрит, ситемная красная волчанка, узелковый периартрит, экзогенный аллергический альвеолит |
Гиперчувствитель-ность замедлен-ного типа Растворимый, презентируется АПК TCR (Т-клеточный рецептор) Клеточно-опосре-дованная реакция (эффекторы – Th1 лимфоциты и макрофаги), в меньшей степени CD8 48-72 ч (21-28 сут) Контактный дерматит, некоторые формы лекарственной аллергии, гранулемы при шистосоматозе, реакции на ту-беркулин, хроническая крапивница, ревматоидный артрит, сахарный диабет типа 1. |
Примечание: АПК – антиген представляющая клетка TCR – Т-клеточный рецептор Th1 – Т-хелперы 1 типа Стадии аллергических реакций и их патогенез. Выделяют три стадии аллергических реакции (Адо А.Д., 1980):
-
Иммунологическую.
-
Патохимическую.
-
Патофизиологическую.
Разберем эти стадии, в зависимости от типа аллергических реакций. I тип – реагиновый (анафилактический) I стадия – иммунологическая: начинается с 1 контакта с аллергеном под действием предрасполагающих причин (генетических факторов, типа иммунного ответа и др.), усиливается продукция IgE (реагинов). Его норма в крови 200-300 нг/л (10-9). Он бивалентен. Его особенностью является длинный Fс фрагмент, который позволяет ему прикрепляться к клеткам-базофилам, тучным клеткам, т.е. его цитотропность (цитофильность), а Fab фрагмент остается свободным, выставленным на поверхности тучных клеток. Таким образом, иммунологическая стадия включает процесс синтеза IgE и прикрепление их к тучным клеткам. Этот процесс длится 7-14 дней и называется сенсибилизацией. Сенсибилизация – это процесс приобретения организмом повышенной чувствительности к аллергену. На первое введение аллергена аллергии быть не может. Но надо помнить о возможности скрытой сенсибилизации: так пенициллин содержится в птице, в молочных продуктах, в рыбных консервах – тетрациклин. В Англии он нормируется 0,01 ЕД/мл, в России таких норм нет. Доза для сенсибилизации может быть минимальной. Но иммунологическая стадия этим не завершается. Она продолжается после повторного попадания аллергена в организм. При этом реакция аллергена с IgE происходит на поверхности тучных клеток. После этого начинается II-патохимическая стадия. II стадия – патохимическая. Молекула аллергена связывает 2 соседних IgE (бивалентна) – за счет приближения рецепторов изменяются свойства мембраны, открываются кальциевые каналы и кальций поступает внутрь клетки (10-4 снаружи и 10-7 внутри), нарушается стабильность мембраны, тучная клетка активируется, и выбрасываются гранулы (дегрануляция) во внеклеточное пространство (рис. 1).
IgE
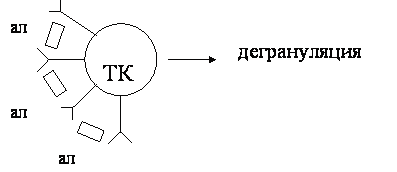 Рис.
1. Патогенез реагинового типа аллергических
реакций.
Рис.
1. Патогенез реагинового типа аллергических
реакций.
Медиаторы тучных клеток. I группа (преформированные, готовые): 1) гистамин оказывает свое действие через рецепторы Н1-тип – повышение проницаемости сосудов, спазм гладкой мускулатуры, раздражение нервных волокон (возбуждение вагуса и зуд), сокращение бронхиол; Н2-тип – стимулирует секрецию бронхиальных желез и других желез. 2) Фактор хемотаксиса эозинофилов – ИЛ-5 – вызывает повышение числа эозинофилов в крови и секретах (за счет их пролиферации) и активацию эозинофилов. Эозинофилы содержат гистаминазу и выполняют, в том числе, регулирующую роль (защитную). Однако при их гиперактивации происходит повреждение тканей; 3) Фактор хемотаксиса нейтрофилов – ИЛ-8 – привлекает из кровотока нейтрофилы, активирует их. Нейтрофилы приходят для уничтожения аллергенов (фагоцитоза). Но их ферменты могут усиливать воспаление в ткани; 4) Гепарин – влияет на микроциркуляцию, препятствует свертыванию крови, обладает антикомплементарной активностью, тормозит выработку антител и хемотаксис клеток; 5) Кининогеназа – активирует кининовую систему, кинины (брадикинин) отщепляются от глобулинов ферментом каликреином. Каллидин под действием трипсина тоже превращается в брадикинин. Действие: повышение проницаемости сосудов, снижение их тонуса, расширение гладкой мускулатуры. Медиатор боли. II группа медиаторов – образуются при активации тучных клеток из арахидоновой кислоты, входящей в состав фосфолипидов мембраны тучных клеток (вновь образованные). Ее расщепляют 2 фермента:
-
циклооксигеназа – образуются простагландины разных типов (E,U, D, F, A), особенно важен простагландин F2α. Большинство из них повышают проницаемость сосудов, снижают их тонус, вызыввают спазм гладкой мускулатуры, тогда как ПГЕ способствует накоплению ЦАМФ в клетках, тем самым способствует расслаблению бронхиальных мышц и снижению выделения БАВ.
-
липооксигеназа – образуются лейкотриены C4, D4, E4 – это ни что иное как медленно действующее вещество анафилаксии. Они вызывают спазм гладкой мускулатуры и повышение проницаемости сосудов. Действие лейкотриенов в 10-100 раз сильнее, чем у гистамина.
