
Khimia_Lektsia
.pdf41
крытых системах являются условия, выражаемые (3.50) и (3.51), то пределом протекания процессов служат соотношения
dA=0 |
A=min, |
(3.52) |
dG=0 |
G=min, |
(3.53) |
т. е. состояние равновесия характеризуется минимальным и постоянным значением термодинамических потенциалов. Из изложенного выше следует вывод, что если рассчитать изменение термодинамического потенциала процесса, то по знаку ∆G или ∆А можно сделать заключение о возможности и направлении его протекания.
Вопросы для самопроверки
1.В чем заключается суть второго закона термодинамики?
2.Как математически выражается второй закон термодинамики для химических процессов?
3.Напишите математическое выражение для энтропии.
4.Какое значение имеет третий закон термодинамики?
5.Для решения каких вопросов используется энтропия?
6.Что характеризуют термодинамические потенциалы? Где они применяются?
7.Что представляет собой химический потенциал? От чего он зависит? Где применяется?
8.Что является критерием самопроизвольного протекания химической реакции в условиях постоянства давления и температуры?
9.В каком направлении протекают самопроизвольные изохорноизотермические процессы?
10.При каком условии возможно самопроизвольное протекание химических реакций в изолированной системе?
4.ХИМИЧЕСКАЯ КИНЕТИКА
4.1.Понятие о химической кинетике. Скорость химических реакций
Термодинамический подход к описанию химических процессов позволяет оценить энергию взаимодействия и наиболее вероятные направления протекания реакций. При этом нет необходимости прибегать к конкретному рассмотрению механизма процесса, к экспериментальному его осуществлению.

42
Однако классическая термодинамика рассматривает только равновесные системы и равновесные процессы, т. е. процессы, которые протекают бесконечно медленно. С термодинамических позиций невозможно анализировать развитие процесса во времени, поскольку время (как переменная) не учитывается при термодинамическом описании. Поэтому вторым этапом в изучении закономерностей протекания химических процессов является рассмотрение их развития во времени, что представляет собой основную задачу химической кинетики. В реальных условиях протекание химических реакций связано с преодолением энергетических барьеров, которые иногда могут быть весьма значительными. Именно поэтому термодинамическая возможность осуществления данной реакции (∆G<0) является необходимым, но недостаточным условием реализации процесса в действительности. Химическая кинетика кроме выяснения особенностей развития процесса во времени (формальнокинетическое описание) изучает также механизм взаимодействия реагентов на атомно-молекулярном уровне (молекулярно-кинетическое описание). Оба метода описания кинетических закономерностей взаимно дополняют друг друга.
Исходным и основополагающим понятием в химической кинетике является понятие о скорости химических реакций. Скорость химической реак- ции—это количество элементарных актов взаимодействия в единицу времени. Так как при взаимодействии изменяются концентрации реагирующих веществ, скорость реакции обычно измеряют изменением концентрации реагентов или продуктов реакции в единицу времени. При этом нет необходимости следить за изменением концентрации всех веществ, участвующих в реакции, поскольку ее стехиометрическое уравнение устанавливает соотношение между концентрациями реагентов.
Рассмотрим уравнение реакции общего вида А+В=АВ. Пусть эта реакция протекает в изобарно-изотермических условиях (р =const и Т=const). Пусть концентрация (моль/л) вещества А в момент времени t0 равна С0. По истечении времени в некоторый момент t1 (t1> t0) концентрация реагента А уменьшается за счет образования продукта АВ и равна С1 (С1 < С0). За промежуток времени t1- t0 изменение концентрации реагента А равно С1 - С0 и в соответствии с определением средняя скорость изменения концентрации А выразится:
ν |
A = (С1 - С0)/( t1- t0)=- ∆С/ ∆ t |
(4.1) |
Знак «-» в выражении (4.1) свидетельствует о том, что в ходе реакции концентрация вещества А уменьшается. Аналогичное выражение для скорости изменения концентрации продукта реакции АВ имеет вид
νA = + (∆ САВ/∆ t),
т. е. концентрация продукта реакции со временем возрастает.
Концентрация вещества А в зависимости от химической природы взаимодействия может изменяться со временем как линейно, так и в соответствии

43
с более сложными закономерностями (параболическими, гиперболическими, экспоненциальными и т. п.). Для линейной зависимости средняя скорость однозначно характеризует течение процесса (рис. 4.1, а), поскольку она постоянна и определяется тангенсом угла наклона прямой к оси времени (∆СА/∆ t =tgα). Для нелинейной зависимости концентрации от времени (рис. 4.1, б) средняя скорость является грубым приближением, поскольку в интервале времени (t1- t0) она не остается постоянной. Чем меньше интервал времени ∆t, тем ближе значение средней скорости процесса к ее истинному значению в момент времени t.
Рис. 4.1. Зависимость концентрации реагирующих веществ от времени для линейного (a) и нелинейного (б) процессов, где CA— концентрация вещества А; ϕA —коэффициент пропорциональности.
В пределе при ∆ t → 0 получим |
|
vA = lim (-∆СА/∆ t)= - (d СА /dt). |
(4.2) |
∆t→0 |
|
Таким образом, истинная скорость vA равна первой производной от концентрации по времени и определяется тангенсом угла наклона касательной к кривой СА =f(t) в точке, соответствующей данному моменту времени
(dСА /dt = tgα1).
4.2. Основной закон химической кинетики
Взаимодействие между частицами возможно лишь в момент их столкновения. Вследствие этого скорость реакции пропорциональна вероятности столкновений. А вероятность столкновения частиц определяется их концентрацией. Пусть вероятность w нахождения частицы А в некоторой точке пространства определяется выражением
WA=ϕACA, |
(4.3) |
где CA – концентрация вещества А; ϕA – коэффициент пропорционально-
сти
Тогда вероятность одновременного нахождения А и В в данной точке пространства – вероятность их столкновения – определяется произведением частных вероятностей WA и WВ:
44
WAB = WA WB =ϕABCA CB.
где ϕAB =ϕAϕB. Так как скорость реакции пропорциональна вероятности столкновения, то можно записать:
v=λWAB =λϕAB CACB, |
|
где λ-коэффициент пропорциональности. |
|
Обозначив произведение постоянных множителей λϕAB= k, получим |
|
V=KCACB |
(4.3а) |
т.е. истинная скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Этот основной закон химической кинетики называется законом действия масс.
Коэффициент пропорциональности k называется константой скорости. Смысл ее становится ясным, если принять CA=CB=1моль/л, тогда v=k. Константа скорости—это скорость реакции при концентрациях реагирующих веществ, равных единице. Таким образом, константу скорости можно рассматривать как удельную скорость.
4.3. Молекулярность и порядок реакций
Важными понятиями в химической кинетике являются молекулярность и порядок реакций. Рассмотрим гомогенную реакцию, протекающую в газовой фазе по уравнению
ν1A1 + ν2A2 + ... = ν'1A'1 + ν2'A2' + ...
(νi, νi'—стехиометрические коэффициенты). Чтобы возможным был акт
взаимодействия, необходимо одновременное столкновение ν1 частиц A1 и ν2 частиц A2 с образованием соответствующих продуктов. Вероятность одновременного нахождения νi частиц Аi в некоторой точке пространства, согласно выражению (4.3) равна
wAi=ϕAI (CAi CAi CAi ........ CAi )= ϕAi |
CAiνi . |
|||
Тогда |
|
νi |
νi |
|
νi |
νi |
|
||
v=k CA1 |
CA2 |
CA3 |
.... CAi . |
(4.4) |
Число частиц, участвующих в элементарном акте реакции, определяет ее молекулярность. Например, реакции разложения представляют собой пример мономолекулярных реакций, так как в элементарном акте распада участвует лишь одна частица. Если взаимодействие осуществляется за счет столкновения двух или трех частиц, то соответствующие реакции называются бимолекулярными и тримолекулярными.
Сумма показателей степеней ν1 + ν2 +...νi в выражении (4.4.) определяет общий порядок реакции, а сами показатели определяют порядок реакции по
45
каждому из компонентов. В соответствии с данным определением реакцией первого порядка называется реакция, скорость которой описывается выражением
v =- (dC/dt) = k C А1 (ν2 + ν3 +...= 0, ν1= 1).
Для реакции второго порядка возможны два выражения, отражающих зависимость скорости реакции от концентрации:
-dC/dt = k CA2 1 |
(ν1=2, ν2 =0); |
(I) |
-dC/dt = k C А1 |
C А2 (ν1=1, ν2 = 1). |
(II) |
Выражение (I) справедливо для реакций, скорость которых зависит лишь от концентрации одного из реагентов. В уравнении (II) скорость реакции определяется произведением концентраций двух реагентов. При этом порядок реакции по каждому из компонентов равен единице. Кроме того, если концентрации A1 и А2 равны, то уравнение (II) переходит в уравнение (I), т. е.
- dC/dt = K C А1 C А2 = К CA2 при C А1 = C А2 .
Если же C А2 >>C А1 и в процессе взаимодействия расходуется лишь небольшая часть компонента А2 (C А2 ≈ const), то формально уравнение (II) сводится к уравнению реакции первого порядка.
Аналогично для реакций третьего порядка могут быть рассмотрены три случая:
- dC/dt = kC3A , |
- dC/dt = kCA2 CA , - dC/dt = kCA CA2CA |
3 |
. |
|
1 |
|
Так как скорость реакции всегда измеряется в одинаковых единицах [моль/(л×с), молекул/(см3 ×с)], то размерность константы скорости будет зависеть от порядка реакции. Для реакций первого порядка [k]=c-1, для реакций второго порядка [k] = см3/(мoль×c) или [k] =л/(моль×с), для реакций третьего порядка [k] = см6/(молекул2 ×с) или [k] = л2/(моль2 ×с). Сравнение величин констант скоростей для реакций разного порядка недопустимо, поскольку они измеряются в разных единицах и являются разнохарактерными физикохимическими величинами. Реакции более высокого порядка чем 3 на практике не встречаются.
Молекулярность реакции представляет собой молекулярнокинетическую характеристику системы, а понятие о порядке реакции следует из формально-кинетического описания. Для простых гомогенных реакций, протекающих в одну стадию, эти два понятия совпадают, т. е. мономолекулярная реакция соответствует реакции первого порядка, бимолекулярная— реакции второго порядка, тримолекулярная—реакции третьего порядка. Для
46
сложных реакций, протекающих в несколько стадий, формальное представление о порядке не связано с истинной молекулярностью реакций. Поэтому при формально-кинетическом описании таких процессов встречаются реакции дробного, нулевого и даже отрицательного порядка по одному из компонентов. Например, каталитическое разложение аммиака на поверхности вольфрама описывается уравнением v1 =k (реакция нулевого порядка, скорость которой не зависит от концентрации реагентов), разложение фосфина на стекле протекает в соответствии с уравнением v=kCpH (реакция первого
порядка), стибин на твердой сурьме диссоциирует со скоростью v= kCSbH0,6 3
(реакция дробного порядка). Окисление оксида углерода, протекающее по уравнению 2СО+O2 → 2СO2 на платиновом катализаторе, подчиняется зависимости v =k(CO2/Cco), т. е. эта реакция имеет порядок —1 по СО, хотя общий порядок реакции равен нулю. Экспериментальная оценка формального порядка реакции имеет большое значение в химической кинетике, поскольку позволяет предположить вероятный механизм протекания реакции.
4.4.Сложные процессы. Параллельные, последовательные, сопряженные и цепные реакции
Реальные химические процессы лишь редко могут быть описаны простым механизмом и, как правило, представляют собой сложные реакции, в которых помимо молекул могут участвовать и такие нестойкие промежуточные образования, как ионы, свободные радикалы, активные комплексы и т. п. Сложные реакции подразделяются на параллельные, последовательные и сопряженные. Особо следует выделить цепные реакции, которые можно рассматривать как комбинацию трех основных типов.
Параллельными реакциями называется связанная система реакций, имеющих одни и те же исходные реагенты, но различные продукты реакции. Например, термическое разложение хлората калия может одновременно протекать в двух направлениях:
v1
1) 4KClO3 →4KCl +6O2;
v2
2) 4KClO3 → 3KClO4+ КС1.
Каждая из реакций мономолекулярна (в единичном акте разложения участвует одна формульная единица KClO3). Скорости этих параллельных реакций определяются выражениями:
v1 = k1CKClOз, v2 = k2CKclOз.
Суммарная скорость процесса, который также представляет собой мономолекулярное взаимодействие, равна
v = v1 + v2= (k1 + k2) CKClOз
47
т. е. скорость системы параллельных реакций равна сумме скоростей отдельных стадий. Последнее правило справедливо и для бимолекулярных параллельных реакций общего вида
v1 |
v2 |
А + В→C + D; |
А + В→С ' +D' |
Суммарная скорость при этом равна
v = v1 + v2= (k1 + k2) СAСB.
Последовательными реакциями называется связанная система реакций, в которых продукты предыдущих стадий расходуются в последующих. Закономерности протекания этих реакций более сложны, и здесь рассмотрим лишь особенности взаимодействия для наиболее простого варианта двух последовательных реакций первого порядка, которые в общем виде могут быть представлены следующим образом:
v1 |
v2 |
(II) |
А→ В (I); |
В→С. |
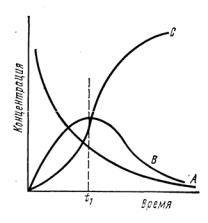
Продукт В, образующийся по первой реакции, является промежуточным. Скорость расходования вещества А определяется скоростью реакции (I), и его количество непрерывно убывает со временем (рис. 4.2.):
v1A=-(dCA/dt)= k1CA.
Скорость накопления вещества В в соответствии с реакцией (I) определяется выражением
v1B=(dCB/dt)= k1CB.
Однако это вещество одновременно расходуется в соответствии с реакцией (II), и скорость его расходования определяется выражением
v2B=-(dCB/dt) = k2CB.
Так как вещество В одновременно участвует в двух реакциях, то общее изменение его концентрации определяется разностью скоростей накопления и расходования:
vB = v1B - v2B = (k1 — k2) Св.
В начальный период процесса скорость расходования промежуточного продукта В невелика и общая его концентрация в системе возрастает. По мере его накопления растет скорость расходования и концентрация В с момента времени t1 начинает уменьшаться. Таким образом, на кривой зависимости концентрации В от времени появляется максимум (рис. 4.2.), в котором скорость накопления равна скорости расходования. Скорость накопления конечного продукта С определяется выражением v2С=-(dCС/dt)= k2CС
48
Рис. 4.2.Изменение концентраций исходного вещества (А), промежуточного (B) и продукта (С) последовательных реакций
Вначале с ростом общей концентрации В скорость накопления С увеличивается. В момент времени t1, соответствующий максимальной концентрации В, скорость накопления С максимальна и далее падает, поскольку концентрация В уменьшается. Таким образом, общее изменение концентрации конечного продукта С со временем отражается нарастающей кривой с точкой перегиба, соответствующей максимальному количеству промежуточного продукта. Обычно различные стадии серии последовательных реакций протекают с различными скоростями, поэтому общая скорость этого сложного взаимодействия определяется стадией, протекающей с наименьшей скоростью. Эта стадия реакции называется лимитирующей.
Сложное химическое взаимодействие возможно и тогда, когда протекание одной реакции вызывает (индуцирует) протекание другой реакции в той же системе. Это явление называется химической индукцией. Например, непосредственного взаимодействия иодистоводородной кислоты с хромовой не происходит. Однако при введении в систему оксида железа (2+) наряду с его окислением по уравнению
6FeO + 2Н2СгО4 = ЗFe2О3 + Сг2О3 + 2Н2О
одновременно происходит окисление HI:
6HI + 2Н2СгО4 = 3I2 + Сг2О3 + 5Н2O.
Две реакции, одна из которых индуцирует протекание другой, называются сопряженными. С формальной точки зрения систему сопряженных реакций можно рассматривать как частный случай параллельных реакций, поскольку один из исходных компонентов— общий для обоих процессов (в приведенном примере Н2СrO4). Однако сопряженные реакции могут протекать только в сложных системах, когда взаимодействие осуществляется через ряд последовательных промежуточных стадий.
Детальное рассмотрение химических процессов с молекулярно - кинетической точки зрения показывает, что большинство из них протекает по так
49
называемому радикально-цепному механизму. Особенность цепных реакций заключается в образовании на промежуточных этапах свободных радика- лов—нестабильных фрагментов молекул с малым временем жизни, имеющих свободные связи: οСН3, οС2Н5, Clο, N , НО2 ο и т. п. Связанная система сложных реакций, протекающих последовательно, параллельно и сопряженно с участием свободных радикалов, называется цепной реакцией. По цепному механизму развиваются многие процессы горения, взрыва, окисления и фотохимические реакции. Значение цепных реакций в химии и в смежных с нею областях науки (биологии, биохимии) очень велико. Выдающаяся роль в изучении цепных процессов принадлежит советскому ученому акад. Н. Н. Семенову, сформулировавшему основные закономерности протекания таких реакций. Основные стадии цепных реакций: зарождение цепи, продолжение цепи, разветвление цепи и обрыв цепи. Зарождение цепи — стадия цепной реакции, в результате которой возникают свободные радикалы из валентнонасыщенных молекул. Эта стадия осуществляется разными путями. Так, при синтезе хлористого водорода из водорода и хлора образование радикалов осуществляется за счет разрыва связи Сl—Сl (по мономолекулярному механизму) под воздействием кванта света: Cl2+hv → Clο +C1ο. А при окислении водорода зарождение цепи происходит за счет обменного взаимодействия по бимолекулярному механизму Н2+O2=Нο + οНO2. Образование свободных радикалов можно инициировать введением посторонних веществ, обладающих специфическим действием (инициаторов). В качестве инициаторов часто используют малостабильные перекисные и гидроперекисные соединения.
Продолжение цепи—стадия цепной реакции, протекающая с сохранением общего числа свободных связей. При этом не имеет значения, какие именно радикалы исчезают и возникают вновь. Важно лишь, что на данной стадии общее количество свободных связей остается постоянным. Для процесса синтеза НСl продолжение цепи обеспечивается следующими элементарными стадиями:
Н2+ οCl → Hο—HCl
Нο+Cl2 → HCl+Clο и т. д.
Продолжение цепи в реакции окисления водорода непосредственно после ее зарождения осуществиться не может, так как радикалοНО2 малоактивен. Этой стадии предшествует стадия разветвления цепи. Разветвление це- пи—элементарная стадия цепного процесса, протекающая с увеличением числа свободных связей. При окислении водорода это происходит за счет взаимодействия: Нο+О2=ОНο+οОο, т. е. вместо одной свободной связи появляются три. После этой стадии продолжение цепи возможно по схемеοОН+Н2=Н2О+ οН. Параллельно с этой реакцией протекает взаимодействие с образованием новых радикалов: οОο+Н2=ОНο+Нο. Обрыв цепи— элементарная стадия цепного процесса, приводящая к исчезновению свободных связей. Исчезновение свободных радикалов происходит за счет взаимо-
50
действия со стенкой реакционного сосуда или при реакции с посторонним веществом (ингибитором) или другим радикалом. Например, обрыв цепи происходит в результате взаимодействий:
Нο +С1ο =НСl
Сlο + стенка = 12 Сl2 (адсорбирован)
или
Нο+ O2 + ингибитор = οНO2+ ингибитор
Образование радикала οНO2 фактически приводит к обрыву цепи, поскольку он неактивен. Общую последовательность элементарных стадий цепных реакций в рассмотренных процессах можно представить следующим образом:
|
Н2 + Cl2 = 2HCI |
|
зарождение цепи (I) |
||
|
Cl2+hv=Cl + Cl |
|
|
||
|
H2+Cl =НС1+Н |
|
продолжение цепи |
||
|
|
|
|
|
|
|
Сl2+Н =HCl+CI |
|
|
||
|
|
|
|
||
|
|
|
|
||
|
Н +Сl =НСl |
|
обрыв цепи |
||
|
Сl + стенка = 1/2 Cl2 (адc) |
|
|||
|
2Н2 + O2 = 2Н2O |
(II) |
|
||
|
Н2 + O2= Н |
+ НО2 |
зарождение цепи |
||
|
Н |
+O2= ОН |
+ |
O |
разветвление цепи |
|
|
|
|
||
|
ОН+Н2=Н2O+Н |
|
|
||
|
O +Н2=ОН +Н |
продолжение цепи |
|||
|
|
|
|||
|
Н + стенка = 1 /2 Н2 (адc) |
|
|||
|
|
|
обрыв цепи |
||
|
Н |
+ O2 + ингибитор = |
|||
|
НO2 + ингибитор |
|
|||
Уравнения (I) и (II) для цепных реакций не отражают действительно протекающий процесс, поскольку в результате промежуточных взаимодействий
