
- •Тема 6. Химическая кинетика. Химическое равновесие План занятия
- •Теоретическая часть
- •Примеры решения типовых задач
- •Задания для самостоятельной работы Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №1
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №2
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №3
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №4
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №5
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №6
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №7
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №8
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №9
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №10
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №11
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №12
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №13
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №14
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №15
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №16
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №17
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №18
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №19
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №20
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №21
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №22
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №23
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №24
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №25
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №26
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №27
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №28
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №29
- •Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №30
- •Контрольные вопросы
Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №7
Напишите кинетическое уравнение реакции:
CO2(г)+4H2(г) = CH4(г) + 2H2O(ж)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 2 раза; б) увеличить концентрацию водорода в 2 раза ; в) увеличить концентрацию углекислого газа в 3 раза.
В каком направлении будет происходить смещение равновесия реакции
2CO(г) + O2(г)
= 2CO2(г) ;
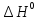 =
-566 кДж
=
-566 кДж
если: а) увеличить температуру; б) увеличить давление в системе; в) увеличить концентрацию кислорода.
Температурный коэффициент скорости реакции равен 2,8. Во сколько раз увеличится скорость реакции при повышении температуры от 20 до 75 0С?
Энергия активации реакции в отсутствии катализатора равна 84,6 кДж/моль, а в присутствии катализатора – 60,6 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при температуре 35 0С?
Запишите выражение константы равновесия для реакции:
CO(г) + Cl2(г) = COCl2(г)
Вычислить концентрации всех веществ в момент равновесия, если начальные концентрации веществ равны: С0(CO) = 2 моль/л; С0(Cl2) = 1,5 моль/л, а константа равновесия К = 20 л/моль.
Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №8
Напишите кинетическое уравнение реакции:
S(тв) + 2N2O(г) = SO2(г) + 2N2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 4 раза; б) увеличить концентрацию оксида азота (I) в 3 раза ; в) уменьшить концентрацию оксида азота (I) в 5 раз.
В каком направлении будет происходить смещение равновесия реакции
CO2(г)+4H2(г)
= CH4(г) + 2H2O(г)
;
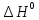 =
-164,7 кДж
=
-164,7 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) уменьшить концентрацию водорода.
Температурный коэффициент скорости реакции равен 2,7. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз?
Определите энергию активации реакции, если при 716 К константа скорости реакции равна 0,0067, а при 787 К равна 0,159.
Запишите выражение константы равновесия для реакции:
2NO2(г) = 2NO(г) + O2(г)
В момент равновесия концентрации веществ в системе были равны: [NO2] = 0,8 моль/л; [O2] = 1,1 моль/л; [NO] = 2,2 моль/л. Вычислите константу равновесия и начальную концентрацию оксида азота (IV).
Индивидуальное задание «Химическая кинетика. Химическое равновесие» вариант №9
Напишите кинетическое уравнение реакции:
FeO(тв) + CO(г) = Fe(тв) + CO2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 3 раза; б) увеличить концентрацию оксида углерода (II) в 6 раз ; в) уменьшить концентрацию оксида углерода (II) в 2 раза.
В каком направлении будет происходить смещение равновесия реакции
2NO(г) + O2(г)
= 2NO2(г);
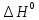 =
-116,2 кДж
=
-116,2 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) увеличить концентрацию кислорода.
Во сколько раз возрастет скорость реакции при повышении температуры на 32 градуса, если температурный коэффициент равен 2,8?
Константа скорости реакции при 600 К равна 7,5, а при 650 К равна 4,5·102. Вычислить энергию активации этой реакции.
Запишите выражение константы равновесия для реакции:
CO(г) +H2O(г) = CO2(г) +H2(г)
Начальные концентрации исходных веществ равны 0,08 моль/л. Вычислить равновесные концентрации всех веществ в системе и константу равновесия, если равновесная концентрация [СO2] = 0,05 моль/л.
