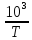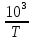Курсовая химия
.docxФедеральное агентство по образованию Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
«Южно-Уральский государственный университет»
Факультет «Экономика и предпринимательство»
Кафедра «Физической химии»
Курсовая работа по курсу теоретические основы прогрессивных технологий
3 вариант
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА К КУРСОВОЙ РАБОТЕ
по дисциплине «ТОПТ»
Фазовые равновесия в однокомпонентных системах
ЮУрГУ–0805026521.2010.638.ПЗ КР
Руководитель, доцент
___________ В.М. Жихарев
__________________ 2011 г.
Автор работы
Студент группы ЭиП-125
_______ Колесниченко К.С.
__________________ 2011 г.
Работа защищена
с оценкой (прописью, цифрой)
________________________
__________________ 2011 г.
Челябинск 2011
Исходные данные к курсовой работе.
В таблице приведены:
- экспериментальные данные по упругости паров над некоторым чистым твердым (Атв) и жидким (Аж) веществом при разных температурах;
- плотности твердого и жидкого веществ dтв и dж , г/см3 (в расчетах их следует считать независящими в исследованном температурном интервале);
- давление Р, Па;
- молярная масса М, г/моль, вещества А.
Задания:
-
Построить графики зависимостей lnp от
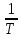 и рассчитать величины постоянных
коэффициентов в интегральных уравнениях
Клаузиуса – Клапейрона для фазовых
равновесий
и рассчитать величины постоянных
коэффициентов в интегральных уравнениях
Клаузиуса – Клапейрона для фазовых
равновесий
Аж=Агаз, Атв=Агаз.
-
Вычислить теплоты испарения, возгонки и плавления вещества, считая их постоянными в исследованном интервале температур.
-
С помощью полученных аналитических зависимостей р=f(T), рассчитать точные координаты тройной точки, характеризующей трехфазное равновесие Атв=Аж =Агаз
-
Построить диаграмму фазовых равновесий в координатах Р-Т, проведя линии по расчетным значениям Р и Т и нанеся на график экспериментальные точки и линию двухфазного равновесия Атв=Аж.
-
Определить количественно влияние внешнего давления на температуру плавления вещества, определив величину
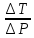 .
. -
Рассчитать нормальные температуры плавления и кипения вещества и температуры плавления вещества А при давлении Р.
-
Результаты расчетов представить в сводной таблице, сделать выводы по курсовой работе.
АННОТАЦИЯ
Колесниченко К.С.
Челябинск: ЮУрГУ
9 с., 2 таблицы
Курсовая работа по дисциплине «ТОПТ» представляет собой решения задач и построение графиков по важнейшим разделам курса и нацелена на выявление способности студентов, применить усвоенные ими знания.
Курсовая работа включает 7 заданий, выполнение которых требуют знания теории вопросов и понимания логической взаимосвязи между основными проблемами курса.
ОГЛАВЛЕНИЕ
Решение………………………………………………………………….5
Библиографический список…………………………………………….9
-
Согласно уравнению Клаузиуса - Клапейрона для равновесия Атв = Агаз и Аж = Агаз имеем в предположении постоянства теплот сублимации и испарения.
lnp(ж)
=
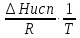 + const =
+ const =
 + B; (1)
+ B; (1)
lnp(тв)
=
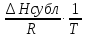 + const =
+ const =
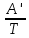 + B; (2)
+ B; (2)
Результаты
вычислений, необходимых для построения
графиков зависимостей lnp
от
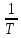 , представлены в таблице. Тот факт. Что
на рис 1.2. зависимости lnp
от
, представлены в таблице. Тот факт. Что
на рис 1.2. зависимости lnp
от
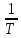 хорошо аппроксимируются прямыми линиями
ab
и cd,
свидетельствует о допустимости
предположения
хорошо аппроксимируются прямыми линиями
ab
и cd,
свидетельствует о допустимости
предположения
 Нсубл
=
const
и
Нсубл
=
const
и
 Нисп
=
const.
Определяем постоянные А и A’
(угловые коэффициенты прямых), используя
координаты точек a,
b,
c,
d.
Нисп
=
const.
Определяем постоянные А и A’
(угловые коэффициенты прямых), используя
координаты точек a,
b,
c,
d.
А’
=
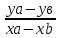 =
=
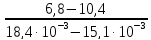 =
=
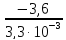 = - 1090,1 (3)
= - 1090,1 (3)
А
=
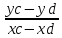 =
=
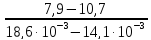 =
=
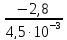 = - 622,2 (4)
= - 622,2 (4)
Рис.1.1 графическое определение постоянных уравнения Клаузиуса – Клапейрона: линия od - равновесие Аж = Агаз ; oa – равновесие Атв = Агаз
Таблица №1
Равновесие Атв = Агаз
|
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ |
РАСЧЕТ |
|||||
|
Т, К |
Р (тв), Па |
х
= |
у=lnр |
Т, К |
Р (тв), Па |
|
|
55,0 |
1333 |
18,2 |
7,2 |
54 |
823,0 |
|
|
58,0 |
3999 |
17,2 |
8,3 |
56 |
1692,4 |
|
|
59,2 |
11997 |
16,9 |
9,4 |
59 |
4553,9 |
|
|
63,0 |
14663 |
15,9 |
5,6 |
62 |
11133,8 |
|
|
64,0 |
17329 |
15,6 |
9,8 |
65 |
25065,1 |
|
Таблица №2
Равновесие Аж = Агаз
|
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ |
РАСЧЕТ |
|||||
|
Т, К |
Р (ж), Па |
х
= |
у=lnр |
Т, К |
Р (ж), Па |
|
|
60,0 |
12663 |
16,7 |
9,5 |
61 |
10938,0 |
|
|
64,0 |
17329 |
15,6 |
9,8 |
62 |
12893,9 |
|
|
66,0 |
22394 |
15,2 |
10,1 |
65 |
20490,0 |
|
|
67,8 |
27993 |
14,8 |
10,2 |
67 |
27267,0 |
|
|
69,0 |
31992 |
14,5 |
10,4 |
68 |
31257,0 |
|
|
71,0 |
39990 |
14,1 |
10,6 |
70 |
40596,2 |
|
Постоянные интегрирования можно определить, подставляя в линейное уравнение при известных A или А’ координату любой точки прямой ab или cd.
B’
= уа
– A’
 ха
=
6,8 – (-1090,1)
ха
=
6,8 – (-1090,1) 18,4
18,4 = 26,9 (5)
= 26,9 (5)
B
= ус
–
A хс
= 7,9 – (- 622,2)
хс
= 7,9 – (- 622,2) 18,6
18,6
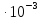 = 19,5 (6)
= 19,5 (6)
Таким образом, в исследованном интервале температур зависимостей упругости пара над твердым и жидким веществом описываются уравнениями (Па):
lnp(тв)
=
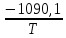 + 26,9 или p(тв)
=
+ 26,9 или p(тв)
=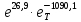 (7)
(7)
lnp(ж)
=
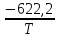 + 19,5 или p(ж)
=
+ 19,5 или p(ж)
=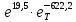 (8)
(8)
Теплоту возгонки (сублимации) и испарения определяем по величинам А и А’.
 Hсубл
= - R
Hсубл
= - R А’
= 8,314
А’
= 8,314 (-1090,1)
= 9063
(-1090,1)
= 9063
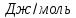 (9)
(9)
 Hисп
= - R
Hисп
= - R А
= 8,314
А
= 8,314 (-622,2)
= 5173
(-622,2)
= 5173
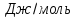 (10)
(10)
Теплоту плавления вещества вычисляем используя закон Гесса:
 Hсубл
=
Hсубл
= Hплав
+
Hплав
+ Hисп
(11)
Hисп
(11)
 Hплав
=
Hплав
=
 Hсубл
- +
Hсубл
- + Hисп
= 9063- 5173= 3890
Hисп
= 9063- 5173= 3890
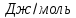
Рис.1.2. Диаграмма фазовых равновесий (р – Т- диаграмма) чистого вещества А;
Линия ОА – двухфазное равновесие Атв = Агаз, уравнение (7),
Линия ОК - двухфазное равновесие Аж = Агаз, уравнение (8),
Линия ОВ - двухфазное равновесие Аж = Атв
Точка О характеризует параметры трехфазного равновесия Атв = Аж = Агаз
3, 4. В таблицах представлены результаты расчетов ртв = f(Т) по уравнениям (7) и (8). А на рис.1.2 результаты этих расчетов представлены кривыми ОА и ОК вместе с результатами экспериментальных исследований.
Точные координаты тройной точки (точки пересечения прямых на рис 1.1 и кривых упругостей паров на рис1.2 ) можно определить, приравняв первые части уравнений (12) и (13)
lnp(тв) = lnp(ж)
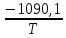 +
26,9 =
+
26,9 =
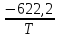 + 19,5
+ 19,5
Отсюда температура трехфазного равновесия:
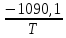 +
+
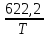 = -26,9 + 19,5
= -26,9 + 19,5
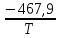 =
7,4
=
7,4
Т0 = 63,2 К
Давление паров трехфазного равновесия Атв = Аж = Агаз. вычисляем, подставив Т0 = 81,993 в уравнение (12) и (13)
р0
=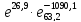 =
=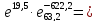 15599,8
Па
15599,8
Па
5.
Оценить влияние внешнего давления на
температуру плавления вещества можно
по знаку и величине производной

Найти ее можно с помощью уравнения
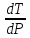 =
=
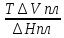 ,
в котором
,
в котором
 Vпл
=
Vпл
=
 Vж
-
Vж
-
 Vтв
=
Vтв
=
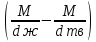
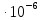 ,
,
где
М – молекулярная масса исследуемого
вещества,

dтв
, dж
- плотности твердого и жидкого вещества,
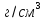
В данном расчете можно воспользоваться найденной ранее температурой трехфазного равновесия Т0 = 63,2 К представляющей одновременно температурой плавления вещества при давлении р0 = 15599,8 Па
Тогда
 Vпл
=
Vпл
=
 Vж
-
Vж
-
 Vтв
=
Vтв
=
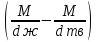
 =
=
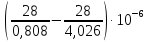 = (34,65 – 6,95)
= (34,65 – 6,95) = 27,7
= 27,7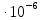 м3/моль
м3/моль
Тогда
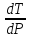 =
=
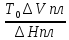 =
=
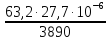 =
=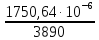
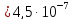 К/Па
К/Па
Т.к.
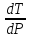 >0,
то следует сделать вывод, что с ростом
давления температура плавления должна
возрастать.
>0,
то следует сделать вывод, что с ростом
давления температура плавления должна
возрастать.
6.
Нормальную (при Рвн
= 1 атм = 1,013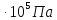 )
температуру кипения рассчитываем по
формуле (13) с учетом того. Что всякая
жидкость закипает тогда, когда упругость
ее паров равна внешнему давлению Рж
= Рвн
)
температуру кипения рассчитываем по
формуле (13) с учетом того. Что всякая
жидкость закипает тогда, когда упругость
ее паров равна внешнему давлению Рж
= Рвн
ln1,013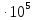 = -
= -
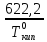 + 19,5
+ 19,5
Отсюда получаем
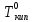 =
=
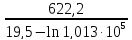 =
=
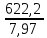 =
78,07 К
=
78,07 К
Линия
двухфазного равновесия на рис.1.1 будет
практически вертикальной прямой ОВ,
исходящей из тройной точки. Поэтому
можно принять приближенно, что
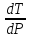 =
=
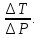
Тогда
при расчете нормальной температуры
плавления вещества (при Рвн
= 1 атм = 1,013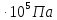 )
)
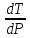 =
=
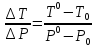 =
=
 =
=
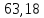 К/Па
К/Па
Отсюда нормальная температура плавления Т0 = 63,2 то есть увеличение внешнего давления до 1 атм приводит к уменьшению температуры на 0,02 градуса.
7. Температура плавления вещества при давлении 100 атм вычисляется аналогично расчету нормальной температуры плавления вещества.
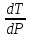 =
=
 =
=
 = 67,71 К/Па
= 67,71 К/Па
Отсюда температура плавления вещества при давлении 100 амт Tp = 67,71, то есть увеличение внешнего давления до 100 атм приводит к увеличению температуры на 4,5 градуса.