
химия кремния (2)
.docx|
10)Трехкальциевый двусиликат 3CaO*2SiO2 может образоваться во время длительной выдержки расплава соответствующего состава 14700С. Он встречается в доменных шлаках. При нагревании плавится с разложением, превращаясь в двухкальциевый силикат и окись кальция. Метасиликат кальция CaO*SiO2 или CaSiO3 содержащий 48% CaO и 52% SiO2 известен и двух кристаллических модификациях: альфа и бета. До 11500С устойчива бета-модификация. Природная ее разновидность-минерал волластонит. Он обычно образуется в местах соприкосновения известняков с вулканическими горными породами. Природный волластонит представляет собой пластинчато-кристаллическое вещество, плотность 2,915, твердость 4,5-5 При 11500 С превращается в альфу-модификацию, называемую псевдоволластонитом температура плавления 15400 С Он выделяется при длительном нагревании и медленном охлаждении известняково-натриевых стекол с большим содержанием окиси кальция. Волластанит состоит из непрерывных лент тетраэдров. Ленты образованы цепочками из радикалов (Si6O17)10-,соединенных между катионами кальция. Кристаллохимическая формула волластонита: Ca6(Si6O17)O В растворах HCl волластонит полностью разлагается, выделяя кремнезем CaSiO3+2HCl→CaCl2+H2O+SiO2 |
1)Метасиликат натрия.Na2SiO3 или Na2O*SiO2,образуется при сплавлении карбоната натрия с эквивалентным количеством кремнезема. Медленно остывая, расплав кристаллизуется. Метасиликат натрия можно получить так же, растворяя кремнезем в водном растворе едкого натра. При выпаривании раствора метасиликат кристаллизуется в ромбической системе, образуя игольчатого вида кристаллы, т. Плав. 10890. В холодной воде очень медленно –лучше в кипящей. Раствор силиката натрия частично гидролизуется поэтому он обладает щелочной реакцией. В спирте не растворим. Минеральные некоторые органические кислоты разлагают его – выделятся осадок водного кремнезема: Na2SiO3+2HCl=2NaCl+H2SiO3 Выделение двуокиси кремния из водных раствором метасиликата натрия способствует растворимые соли аммония Na K Ca Mg и др элементов. Н выделяется кремне кислота, которая затем разлагается на H2O и SiO2 Na2SiO3+2NH4Cl=2NaCl+2NH3+H2SiO3 H2SiO3=H2O+SiO2 Na2SiO3+2NH4Cl=2NaCl+2NH3+H2O+SiO2 Углекислота воздуха частично вытесняет SiO2 и раствора Na2SiO3 |
|
4) 2MgO*SiO2-форстерит. Ортосиликат, в природе встречается в виде минерала форстерита. С кристаллохимической точки зрения форстерит относиться к силикатам с изолированными тетраэдрами Mg2[SiO4]. Тетраэдры в форстерите соед. между собой не вершинами, а через ионы магния, каждый ион магния непосредственно связан с 6-тью ионами кислорода, поэтому коордиционное число 6 (это число связей иона с кислородом). Форстерит – это белое или светло-серое кристаллическое в-во ромбической системы со стеклянным блеском. Теоретический состав: 57,1% MgО, 42,9% SiO2. Твердость: 7. Плотность: 3,217 г/см3. Тем-ра плавления 1890С. Получается искусственно путем медленного охлаждения расплава указанного состава. Кристаллизации способствуют присутствие в расплаве оксида бора (В2О3) или хлорида магния (MgCl) при взаимодействие с концентрированной серной кислотой выделяют студень кремнезема, с соляной кислотой разлагается. Высокая тем-ра плавления позволяет использовать его для изготовления специальных огнеупорных изделий. |
2)
Na2O*2SiO2,
2Na2O*
SiO2,
3Na2O*2SiO2.
Двусиликат
натрия
Na2O*2SiO2
содержит
34,04% Na2O
и 65,96% SiO2.
Кристаллизуется в виде пластинок
ромбической системы. Существует в
двух кристаллических модификациях:
|
|
3) К2О*SiO2, К2О*2SiO2, К2О*4SiO2, 2К2О*SiO2. Известны ортосиликат 2К2О*SiO2 , метасиликат К2О*SiO2, двусиликат К2О*2SiO2 и тетрасиликат К2О*4SiO2, различные водные силикаты калия. Последние представляют собой преимущественно водные соед метасиликатов. Для силикатов калия характерно то, что тем-ры плавления их несколько ниже тем-тур плавления соответствующих силикатов натрия и силикатов лития. Хим. св-ва калиевых силикатов подобны св-вам силикатов натрия. Метасиликат калия, содержащий 61,06% К2О и 38,94% SiO2, получают, подобно метасиликату натрия, сплавляя в эквивалентных кол-вах молотый кварц с поташом при 1100С. Метасиликат калия кристалличен. Его кристаллы ромбической системы, чрезвычайно гигроскопичны. Плавится при 976С. Двусиликат калия состоит из 54,5% К2О и 45,5% SiO2. Получают его, сплавляя тонкоизмельченную смесь кварца с поташом при высоких тем-рах. Двусиликат калия образует таблитчатые кристаллы; тем-ра плавления 1045С. Тетрасиликат калия содержит 28,16% К2О и 71,84% SiO2. Тем-ра плавления около 770С. Ортосиликат калия получают, сплавляя тонкодисперсный кремнезем с избытком поташа. Плавится ортосиликат калия при 913С.он очень хорошо растворяется в воде. Водный раствор 2К2О*SiO2 обладает щелочной р-цией.
|
6) 3MgO*2SiO2*2Н2О - серпентин и асбест. Серпентин. Его хим. состав 3MgO*2SiO2*2Н2О, кристаллохимическая формула Mg6[Si4O10][OH]8. Русское название этого минерала – змеевик. На долю MgO приходится 43%, на долю SiO2 – 44,1%, на долю Н2О – 12,9. Твердость 2,5 – 3; уд. вес 2,5 – 2,7. Главная масса серпентина окрашена в желтый, иногда зеленый и серый, реже в красный и бурый цвет. При нагревание серпентин частично теряет элементы воды, а при прокаливании разлагается. Крепкая серная кислота также разлагает его. Соляная кислота действует на него чрезвычайно медленно. Из разновидностей серпентина наиболее широко применяется хризотиловый, или змеевиковый, асбест. Асбест – это группа минералов волокнистого строения, способных расслаиваться на отдельные иногда очень тонкие волокна. Из асбеста делают изоляционные и огнеупорные прокладки, ткани, обмотки. Длина волокон асбеста от нескольких см до десятых мм, твердость 2 – 3. Волокна содержат огромное кол-во чрезвычайно мелких пустот, называемых микротрещинами и микрощелями. Это в 4000 раз увел общую поверхность асбеста и придает ему высокие адсорбционные св-ва. Он интенсивно адсорбирует гидрат окиси кальция и другие составные части вяжущих в-в, а также ускоряют процесс кристаллизации при твердении. Средневолокнистые сорта асбеста – сырье в произв. огнестойкого и теплоизоляционного асбестового картона и бумаги. Из мелковолокнистого асбеста делают этернит ( кровельный материал), асбоцементные плиты, трубы и другие изделия. Асбест применяют в хим., машиностроительной, бумажной, и других отраслях промышленности. |
|
7) MgO*SiO2 – энстатит. Метасиликаты: содержат 40% MgO и 60% SiO2 в природе представлен минералом энстатитом, который относится к силикатам цепочечного типа Mg2[Si2O6]4- кристаллизуется в ромбической системе имеет различные оттенки цвета от бесцветного до буро-зеленого. Твердость 5,5. Плотность: 3,1-3,3 г/см3. В кислотах не растворяется. К этой же группе метасиликатов относятся диопсиды (Са, Mg) [Si2O6]. Метасиликаты получают искусственно путем сплавления смеси MgО и SiO2 указанного состава. Искусственный метасиликат в зависимости от условий нагрева и скорости охлаждения расплав образует кристаллические разновидности: энстатит (β-метасиликат) – ромбической системы и клиноэнстатит (α – метасиликат) – моноклинной системы. Энстатит иногда образуется при расстекловывание стекол, содержащих оксид магния. Выделяется из стекл при 1000-1100С в виде кристаллических игл, достигающих несколько см в длину. При 1260С превращается в клиноэнстатит. Клиноэнстатит можно получить охлаждая расплав соответствующего состава, а также нагревая энстатит выше 1260С. При медленном остывании расплава клиноэнстатит образ. крупные призмы, при быстром – тонкие пластинки. Он устойчив до тем-ры 1557С. Силикаты магния широко используются в керамике, при изготовлении магнезиальных огнеупорных изделий в произв. автосвечных изоляторов и в спец. массах. |
8) 3СаО* SiO2 – алит. Алит – трехкальциевый силикат -3СаО* SiO2 содержит 26,4% SiO2 и 73,6% СаО. Его кристаллы – гексагональные и прямоугольные таблички с ясно выраженной спайностью. Образуется обычно в металлургических шлаках и в портланцементных клинкерах. В природе в чистом виде не встречается. Синтез 3СаО* SiO2 путем непосредственной термической обработки стехиометрической смеси SiO2 и СаО сопряжен с большими трудностями, т.к. в наиболее устойчивом для сущ. тем-ном интервале 1250 – 1900С оба компонента смеси находятся в твердом состоянии. Известно, что хим. р-ции между в-вами в твердом состоянии могут протекать при соответствующих условиях только в местах соприкосновения их. Поэтому прямой синтез трехкальциевый силикат получают в смеси с другими в-вами при термической обработке некоторых трехкомпонентных систем, н-р СаО-Al2O3-SiO2, CaO-Fe2O3-SiO2. В отношении кристаллохимической структуры трехкальциевого силиката сущ. различные мнения. Одни исследователи полагают, что он в основном состоит из изолированных островного типа радикалов [Si3O9]6-. Другие считают, что он состоит из обособленных тетраэдров [SiO4]4- и расположенных между ними избыточных атомов кислорода. Трехкальциевый силикат разлагается соляной кислотой, в воде гидролизуется. Гидролиз в зависимости от среды может протекать по одной из следующих схем: а) в средах, не содержащих растворенной гидроокиси кальция 3СаО*SiO2+nH2O→3Ca(OH)2+SiO2*(n-3)H2O; б) в насыщенных гидратом окиси кальция растворах 3СаО*SiO2+nH2O→Ca(OH)2+2СаО*SiO2*(n-1)H2O; в) в растворах со слабой концентрацией гидрата окиси кальция 3СаО*SiO2+nH2O→2Ca(OH)2+СаО*SiO2*(n-1)H2O. Эти процессы играю чрезвычайно важную роль при схватывании и твердении портландцементов. |
|
|
|

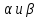 с температурой взаимного перехода
678С. Плавится при 874С. Ортосиликат
натрия 2Na2O*
SiO2
состоит
из 56,9% Na2O
и 43,1% SiO2.
Тем-ра плавления 1118С. Сущ. в виде двух
кристаллических модификациях:
с температурой взаимного перехода
678С. Плавится при 874С. Ортосиликат
натрия 2Na2O*
SiO2
состоит
из 56,9% Na2O
и 43,1% SiO2.
Тем-ра плавления 1118С. Сущ. в виде двух
кристаллических модификациях:
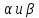 с тем-рой взаимного превращения 960С.
Трехнатриевый
двусиликат 3Na2O*2SiO2
сущ. в интервале 402 - 1122С в виде
остроугольных пластинок. Выделяется
из расплава, содержащего 59,3% Na2O
и 40,7% SiO2.
с тем-рой взаимного превращения 960С.
Трехнатриевый
двусиликат 3Na2O*2SiO2
сущ. в интервале 402 - 1122С в виде
остроугольных пластинок. Выделяется
из расплава, содержащего 59,3% Na2O
и 40,7% SiO2.