
- •Где n– количество газа в молях.
- •Объемная теплоемкость газов выражается через мольную, как
- •Аналитические зависимости для теплоемкостей Cv иCpполучают, используя уравнения для внутренней энергии и энтальпии:
- •После дифференцирования обеих частей уравнения (19) по времени получим
- •V. Методика обработки результатов экспериментов.
- •V. Определение погрешностей эксперимента
- •VII. Требования к отчету.
- •VIII. Контрольные вопросы.
Министерство образования
РФ
Камский государственный политехнический институт
ОПРЕДЕЛЕНИЕ ТЕПЛОЕМКОСТИ ВЕЩЕСТВ
Методические указания к лабораторной
работе по дисциплине “Термодинамика и теплотехника”
г. Набережные Челны
2003
УДК 621. 1:536.7.08, /075/
Печатается по решению научно-методического совета Камского государственного политехнического института от ___________________2003 г.
Определение теплоёмкости веществ: Методические указания к лабораторной работе – Набережные Челны: КамГПИ, 2003, 24 с.
Составители Аверина Н.Ю., Безбородова И.М.
Методические указания к лабораторной работе составлены для студентов машиностроительных специальностей.
Цели, поставленные в лабораторной работе, ориентируют на самостоятельное экспериментальное исследование. Подробно излагаются основные понятия о теплоемкости и методика выполнения лабораторной работы.
Ил. 2, табл. 2, список лит. 3 назв.
Рецензент к.т.н., доцент Тазмеев Х.К.
Камский государственный политехнический институт, 2003
Цель работы:
Ознакомиться с понятием теплоемкости вещества.
Изучить методику определения теплоемкости вещества с помощью сравнительного метода динамического С-калориметра с тепломером и адиабатической оболочкой.
Ознакомиться с конструкцией измерителя теплоемкости ИТ-С-400.
Исследовать температурную зависимость удельной теплоемкости твердых тел.
Краткие сведения из теории
Теплоемкостьютела (системы тел) – называется отношение количества теплоты, поглощенной телом в определенном термодинамическом процессе, к изменению его температуры.
C = dQ/dT, Дж/К, (1)
где dQ – элементарное количество теплоты;
dT – элементарное изменение температуры.
Теплоемкость численно равна количеству теплоты, которое необходимо подвести к системе, чтобы при заданных условиях повышать ее температуру на 1 градус.
В зависимости от количественной единицы тепла, к которому подводится теплота в термодинамике, различают массовую, объемную и мольную теплоемкости.
Массовая теплоемкость (удельная теплоемкость) – теплоемкость, отнесенная к единице массы рабочего тела,
C = C/m, Дж/кг·К.
Объемная теплоемкость – теплоемкость, отнесенная к единице объема рабочего тела,
C = C/V, Дж/м3·К.
Мольная теплоемкость – теплоемкость, отнесенная к количеству рабочего тела, в молях,
C = C/n, Дж/моль·К,
Где n– количество газа в молях.
Массовая и мольные теплоемкости связаны следующим соотношением:
C = C/, или C = ·С,
где - молекулярная масса.
Объемная теплоемкость газов выражается через мольную, как
C’ = C/V, или C = C’·V,
где V = 22,4 м3/моль – мольный объем газа при нормальных условиях. Плотность газа при нормальных физических условиях н = /22,4.
Следовательно,
С = C’/ н, или C’= С·н.
Как и теплота Q, теплоемкость С всегда зависит от внешних условий и характера термодинамического процесса. В общем случае значение теплоемкости С лежит в интервале от - до +, то есть она может быть любой положительной или отрицательной величиной.
Теплоемкости являются функциями параметров термодинамической системы. Для простых систем – это функции каких-либо двух или трех параметров: p, V, T.
В термодинамике широко используется:
а) теплоемкость при постоянном объеме, равная отношению количества теплоты dQv к изменению температуры тела dT в изохорном процессе (V = const);
Cv = (dQ/dT)v;
б) теплоемкость при постоянном давлении, равная отношению количества теплоты dQр к изменению температуры тела dT в изобарном процессе (Р = const);
Cp = (dQ/dT)p;
Аналитические зависимости для теплоемкостей Cv иCpполучают, используя уравнения для внутренней энергии и энтальпии:
dU = (Q/T)v·dT + (U/v)T·dv (1)
di = (i/T)p·dT + (i/p)T·dp, (2)
и уравнение первого закона термодинамики:
dq = dU + p·dv, (3)
dq = di – v·dp. (4)
Из уравнений (1) и (3) при V=const(dv=0) получим
dq = (U/T)v·dT (5)
Отсюда
Cv= (U/T)v, (6)
То есть теплоемкость тела при постоянном объеме является функцией температуры и объема. Для идеального газа внутренняя энергия является функцией только температуры. В этом случае
Cv = dU/dT (7)
Выражение для теплоемкости при постоянном давлении получается из уравнений (2) и (4).
При Р= const,dр=0 получим
dq = (i/T)p·dT (8)
отсюда
Cp= (i/T)p(9)
То есть теплоемкость тела при постоянном давлении является функцией температуры и давления. Для идеального газа, когда энтальпия является функцией только температуры i = f(T), теплоемкость запишется
Cp= di/dT.(10)
Учитывая, что теплоемкость непостоянная и зависит от температуры и других термических параметров, различают истинную и среднюю теплоемкости.
Истинной теплоемкостью называется отношение элементарного количества сообщается термодинамической системе в каком-либо процессе к бесконечно малой разности температур.
С= lim Q1-2/T = dQ/dT.(11)
Средней теплоемкостью процесса в интервале температур от Т1до Т2называют частное от деления теплоты на приращение температуры системы, то есть
Cm= Q1-2/ (T2- T1).(12)
Опытным путем было установлено, что теплоемкость газа непостоянная, а представляет собой функцию температуры; в общем случае эта зависимость (рис.1) может быть представлена уравнением
C = C0 + a·t + b·t2 + d·t3+…, (13)
где С0– теплоемкость при 0С;a,b,d…, - постоянные коэффициенты.
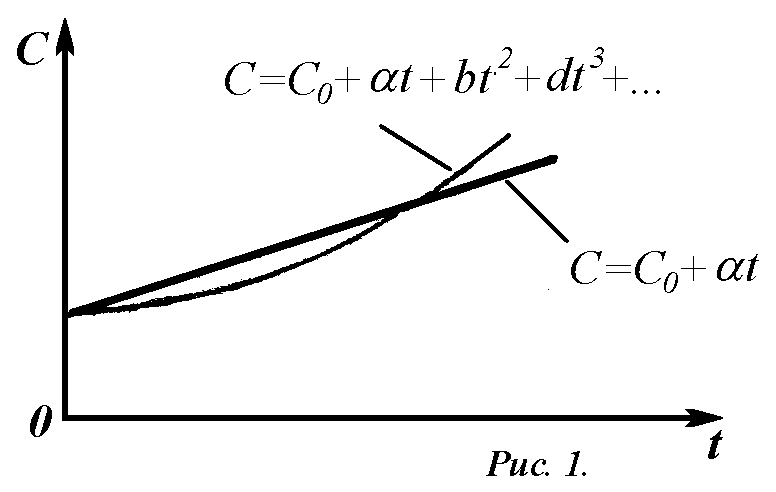
Так как коэффициенты b, d… весьма малы и влияние на значение С членов с температурой в степени выше первой весьма мало, то для технических расчетов часто принимают линейную зависимость теплоемкости от температуры и выражают ее формулой
C = C0+ a·t; (14)
Средняя теплоемкость в пределах от Т1 до Т2 определяется из уравнения
C = (C ·t2– C ·t1)/(t2-t1).(15)
В основу работы измерителя теплоемкости НТ-С-400 положен сравнительный метод динамического С-калориметра с тепломером и адиабатической оболочкой.
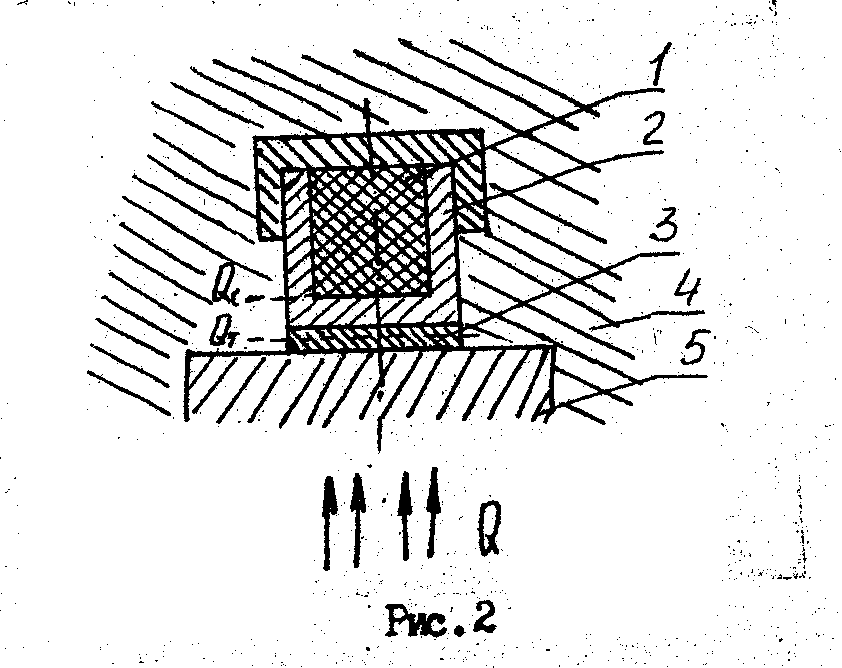
На рис.2 показана тепловая схема метода. Испытуемый образец 1 размещается внутри металлической ампулы 2 и монотонно разогревается вместе с ней за счет непрерывно поступающего к ампуле через тепломер 3 теплового потока.
Тепловая связь ампулы 2 и образца 1 с внешней средой допускается только через тепломер 3, поэтому открытие участка поверхности ампулы отделено от среды адиабатической оболочкой 4. весь процесс нагревания можно разделить на три стадии.
Первая стадия режима охлаждения (неупорядоченного) характеризуется большим влиянием начального распределения температуры, и зависимость между Т и описывается уравнением
T = An·vn·l-m ·, (16)
где An – постоянный коэффициент,
vn = cos (n·/) – функция только координаты х,
mn = n2 · a/2 – комплекс, представляющий собой постоянное вещественное положительное число,
n = 1, 2, 3 …
Вторая стадия охлаждения называется регулярным режимом, а зависимость между Т и описывается уравнением
T = A1·v1·l-mt(17)
Третья стадия охлаждения соответствует стационарному режиму, когда температура во всех точках тела равна температуре охлаждающей среды.
Рассмотрим регулярный режим нагрева тела. Прологарифмировав выражение (17) и опустив
lnT = ln (A·v) – m·(18)
или
lnT = -m·+ c(x, y, z) (19)
