
1.Аналитический обзор
1.1 Материальный баланс.
Основой расчетов химико-технологических процессов являются материальные и тепловые балансы. К расчетам материального баланса следует отнести определение выхода основного и побочных продуктов, расходных коэффициентов по сырью, производственных потерь. Только определив материальные потоки, можно произвести конструктивные расчеты производственного оборудования и коммуникаций, оценить экономическую эффективность и целесообразность процесса. Составление материального баланса необходимо как при проектировании нового, так и при анализе работы действующего производства.
Материальный баланс может быть представлен уравнением, левую часть которого составляет масса всех видов сырья и материалов поступающих на переработку S G, а правую - масса получаемых продуктов S G плюс производственные потери Gпот
S G = S G + Gпот .
Основой материального баланса являются законы сохранения массы вещества и стехиометрических соотношений.
Материальный баланс составляют по уравнению основной суммарной реакции с учетом побочных реакций согласно закону сохранения массы вещества. Общая масса всех поступающих в аппарат материалов, то есть приход, равен общей массе выходящих материалов , то есть расходу. Материальный баланс составляют на единицу массы основного продукта (кг, т) или единицу времени (ч, сутки).
Теоретический материальный баланс рассчитывают на основе стехиометрического уравнения реакции. Для его составления достаточно знать уравнение реакции и молекулярные массы компонентов.
Практический материальный баланс учитывает состав исходного сырья и готовой продукции, избыток одного из компонентов сырья, степень превращения, потери и т.д.
Способы выражения количества и концентрации вещества:
Количество вещества(N):
N=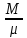

N=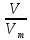
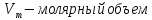 ;
;
Объем(V);
Масса (М);
Мольная доля – отношение количества одного вещества к общему количеству всей смеси: ZN=
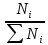 ;
;Объемная доля: ZV=
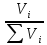 ;
;Массовая доля: ZM=
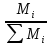 ;
;
Для газов ZNиZVсовпадают.
Основные химико-технологические критерии:
Степень превращения(X) – отношение количества прореагировавшего исходного вещества к его исходному количеству.
XA= =
=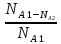
XB=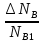 =
=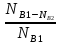
Выход продукта
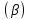 .
.
Относительный выход – отношение фактически полученного количества продукта к теоретическому (максимально возможному).
Для необратимых реакций выход продукта численно совпадает со степенью превращения.
Производительность – количество продукта, полученное за единицу времени.
Для непрерывного процесса:
мольная производительность :ПCN=NC2-NC1;
объемная производительность: ПCV=VC1-VC2=22.4
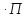 CN=
CN=
=22.4 (NC2-NC1);
(NC2-NC1);
массовая производительность: ПCM=MC2-MC1=
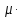 ПCN.
ПCN.
Расходный коэффициент:
Теоретический:
Фактический:
1.2 Кинетика химических реакций.
Кинетика химических реакций, учение о химических процессах — о законах их протекания во времени, скоростях и механизмах.
Скорость реакцииопределяется изменением молярной концентрации одного из реагирующих веществ:
V=С2– С1t2-t1=С /t)
где С1и С2- молярные концентрации веществ в моменты времениt1иt2соответственно (знак (+) – если скорость определяется по продукту реакции, знак (–) – по исходному веществу).
Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость определяется количеством столкновений и вероятностью того, что они приведут к превращению. Число столкновений определяется концентрациями реагирующих веществ, а вероятность реакции - энергией сталкивающихся молекул.
Парциальное давление (P)- часть общего давления, относящаяся к одному из компонентов газовой смеси. Парциальное давление применимо только к идеальным газам. Молярное парциальное давление i-ro компонента газовой смеси с общим давлением р =: pi = Nip, где Ni - отношение числа молей данного компонента к сумме молей всех компонентов смеси4.
Факторы, влияющие на скорость химических реакций.
1.Природа реагирующих веществ.Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулахH2иN2требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl,H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно.
