
- •Глава 1. Философские основы амбивалентных систем…………………………. 5
- •Глава 2.Теоретические основы амбивалентных систем……………………….. 14
- •Глава 3.Применение теории амбивалентных систем……………………… 52
- •Введение
- •Глава 1. Философские основы амбивалентных систем
- •Принцип управляемого противоречия
- •1.3. Особенности амбивалентных систем
- •Глава 2. Теоретические основы амбивалентных систем
- •2.1.1. Статика, нахождение стационарного решения
- •2.1.1.Анализ устойчивости амбивалентных систем в установившемся режиме
- •2.1.2. Анализ устойчивости амбивалентных систем при различных коэффициентах равновесия
- •2.1.3. Динамика амбивалентных систем
- •2.1.4. Математическая модель амбивалентных систем с переменными коэффициентами
- •2.2. Теория знаковых графов, как математический аппарат для описания особенностей поведения в сложных системах с противоречивыми отношениями
- •2.3. Применение теории Марковских цепей для анализа амбивалентных систем
- •2.4.Методы оценки степени остроты противоречия в амбивалентных системах
- •Глава 3. Применение теории амбивалентных систем
- •3.1. В образовании. Амбивалентная система обучения неродному языку.
- •3.2. Моделирование химико-технологических процессов с противоположностями
- •3.2.1 Математические модели химических процессов с противоположностями
- •Проведенные исследования математической модели на устойчивость поливинилхлорида данной марки показали, что положение равновесия системы асимптотически устойчиво.
- •3.2.2 Экспериментальная проверка моделей в лаборатории.
- •3.3. Социально-экономические системы как амбивалентные системы
- •3.3.1. Применение цепей Маркова для анализа социальных систем.
- •3.3.2 Решение обратной задачи расчета матрицы переходов
- •3.3.3. Оценка степени остроты противоречия в социальных системах
- •3.4.Логико-вероятностная модель для амбивалентной системы формирования суждения при взаимодействии тезиса и антитезиса
- •Заключение
- •Литература
Проведенные исследования математической модели на устойчивость поливинилхлорида данной марки показали, что положение равновесия системы асимптотически устойчиво.
Полученные результаты кроме теоретического значения имеют и практический характер, так как с их помощью можно более качественно вести технологический процесс полимеризации винилхлорида.
Математические модели процесса получения хлорноватистой кислоты.
Используя методологию амбивалентных систем, как систем с противоположностями, были получены различные математические модели процесса получения хлорноватистой кислоты. В качестве примера приведем математическую модель процесса получения хлорноватистой кислоты в кислой среде.
Уравнение скорости реакции имеет вид:
![]()
где
![]() - концентрация хлора,
- концентрация хлора,
![]() -
концентрация хлорноватистой кислоты,
-
концентрация хлорноватистой кислоты,
![]() -
концентрация соляной кислоты,
-
концентрация соляной кислоты,
![]() -
константа скорости прямой реакции,
-
константа скорости прямой реакции,![]() - константа скорости обратной реакции.
- константа скорости обратной реакции.
Так как в любой момент времени хлорноватистая и соляная кислоты образуются в равных концентрациях, то уравнение можно записать в виде :
![]()
где
![]() - начальная концентрация хлора.
- начальная концентрация хлора.
В положении равновесия, когда производная равна нулю, выполняется соотношение:
![]() .
.
Сдвинуть равновесие вправо в направлении образования HOCl можно, выводя из реакции любое из веществ в правой части уравнения. Большинство действующих в промышленности производств получают хлорноватистую кислоту нужной концентрации, связывая соляную кислоту. Добиться этого проще всего прибавлением к реакционной смеси какой-нибудь щелочи. Применяя, например, NaOH, имеем:
HCl + NaOH = NaCl + H2O.
Процесс получения хлорноватистой кислоты описывается системой четырех нелинейных дифференциальных уравнений первого порядка:
![]()
![]()
![]()
![]() .
.
В этих обозначениях
![]() - концентрация хлора,
- концентрация хлора,![]() -
концентрация хлорноватистой кислоты,
-
концентрация хлорноватистой кислоты,![]() -
концентрация соляной кислоты,
-
концентрация соляной кислоты,![]() -
концентрация щелочи,
-
концентрация щелочи,![]() и
и![]() - константы
скоростей прямой и обратной реакций в
формуле (1),
- константы
скоростей прямой и обратной реакций в
формуле (1),
![]() - константа скорости реакции .
- константа скорости реакции .
Константы скоростей отличаются друг от друга на несколько порядков:
![]() ,
,
![]() ,
,![]() .
.
Как видно из значений констант скоростей система имеет несколько масштабов времени. Для изучения таких разномасштабных систем широко применяется метод квазистационарных концентраций, который предполагает разделение переменных на два класса: быстрые и медленные и позволяет понизить порядок системы.
Используя принцип выявления противоречия, можно считать, что быстрые и медленные реакции – это и есть противоположности, которые умещаются в одной системе.
Разделим третье
и четвертое уравнения системы на больший
параметр
![]() и введем обозначения:
и введем обозначения:![]()
![]()
![]()
![]()
В результате получим систему уравнений с малым параметром при производных:
![]()
![]()
![]()
![]()
где
![]()
![]()
![]() .
.
Таким образом,
система разбилась на две подсистемы.
Первые два уравнения системы описывают
изменение медленных переменных
![]() и
и![]() ,
а вторые два уравнения описывают
изменение быстрых переменных
,
а вторые два уравнения описывают
изменение быстрых переменных![]() и
и![]() .
.
3.2.2 Экспериментальная проверка моделей в лаборатории.
Для проведения опыта в лабораторных условиях была собрана установка для получения хлорноватистой кислоты.
Хлор получали в колбе Вюрца по реакции:
2 KMnO4 + 16 HCl = 2 KCl + 2 MnCl2 +5 Cl2 +8 H2O.
Хлор пропускали в воду до тех пор, пока не установилось равновесие. По результатам опытов была определена константа равновесия реакции
![]()
Эта константа хорошо согласуется с данными, приведенными в ряде работ по химии.
После того, как установилось равновесие, его начали смещать, прибавляя щелочь. После того, как закончилась подача щелочи, система перешла в новое состояние равновесия, в котором концентрация активного хлора стала 0.285 моль/л, т.е. подтверждено смещение равновесия на 0.250 моль/л .
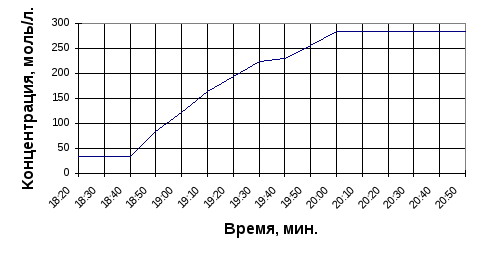
Рис. 3.5.
На рис.3.5 показано смещение равновесия в процессе получения хлорноватистой кислоты в кислой среде.
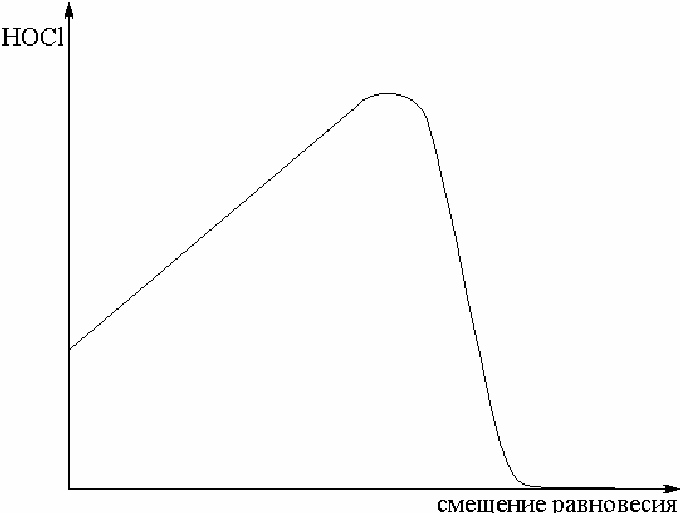
Рис. 3.6.
В ходе проведенных исследований по смещению равновесия удалось получить численные данные, позволяющие сделать некоторые выводы о характере зависимости между величиной смещения равновесия и выходом конечного продукта. Эта зависимость, показанная на рис.3.6, имеет ограниченный линейный участок, который при больших величинах смещения переходит в нелинейную область. Нелинейность обуславливается появлением щелочной среды с уменьшением выхода хлорноватистой кислоты.
Также были проведены опыты по смещению равновесия в щелочной среде и также показано, что смещение возможно, но в небольших пределах.
Таким образом, приведенные примеры с химическими процессами подтверждают применимость теории амбивалентных систем на практике.
