
- •Способи утворення карбенієвих йонів
- •Особливості методів генерації карбокатіонів.
- •Стійкість карбокатіонів
- •3) На рівень стабілізації карбокатіонів вказують також:
- •Реакційні характеристики карбенієвих йонів
- •Реакції нуклеофільного заміщення та перегрупування
- •1) Нуклеофільне заміщення з перегрупуванням. Реакція Меєрвейна – перетворення гідрохлориду камфену в ізоборнілхлорид:
- •1) Реакції з ароматичними сполуками. При генерації карбокатіона з rCl і кислот Льюїса перетворення зветься реакцією Фріделя-Крафтса.
Реакційні частинки умовно можна поділити на: 1) заряджені та нейтральні; 2) сполуки з мультиплетністю 1 і більше (або з сумарним спіном 0 і більше).
До заряджених частинок відносяться карбокатіони, карбаніони, катіон-радикали, аніон-радикали тощо; до нейтральних частинок – нейтральні молекули, арини, карбени, нітрени, радикали та ін. Прикладами частинок з мультиплетністю 1 (спін 0) є нейтральні молекули, арини, синглетні карбени, синглетні нітрени, карбокатіони, карбаніони; частинок з мультиплетністю вище 1 (спін вище 0) – радикали, триплетні карбени, триплетні нітрени, катіон-радикали, аніон-радикали.
Заряджені частинки поділяються на позитивно заряджені (карбокатіони, катіон-радикали тощо) та негативно заряджені (карбаніони, аніон-радикали та ін.).
ПОЗИТИВНО ЗАРЯДЖЕНІ ЧАСТИНКИ
До них відносяться карбокатіони, катіони імонію, іменію, оксенію, оксонію, катіон-радикали.
 (1)
(1)
КАРБОКАТІОНИ
Карбокатіони – активні частинки, що несуть позитивний заряд на одному або декількох атомах вуглецю.
Відомі два види карбокатіонів – йони карбенію і карбонію.
Йони карбенію є похідними катіона СН3+, вони можуть утворюватися при протонуванні карбенів.
Хімія карбенієвих йонів розроблялася в роботах Байєра, Гомберга, Вальдена і Ганча (спочатку за пропозицією Байєра називалися карбонієвими йонами). Термін «йон карбенію» введено Дильтеєм 20 років пізніше.
Ола запропонував розділяти поняття карбенієвих і карбонієвих йонів, причому термін «йони карбонію» віднесено до похідних пентакоординаційного карбокатіона СН5+ (йон метонію). Вони утворюються за рахунок двоелектронних трицентрових зв’язків, які є наслідком -делокалізації.
Деякі структури важко віднести до певного типу карбокатіонів. Наприклад, норборніл-2-катіон, який можна представити як карбокатіони 1, 2 або пентакоординований катіон 3. Іноді застосовують делокалізовані структури типу 4.
 (2)
(2)
Будова
За даними РСА карбокатіонам характерна sp2-гібридизація центрального атома вуглецю з копланарними зв’язками до карбенієвого атома вуглецю і перпендикулярною вакантною орбіталлю. Але ароматичні ядра розвернуті по відношенню до основної площини. В трифенілметилперхлораті ароматичні ядра розташовані під кутами 30 та утворюють своєрідний пропелер. Атоми хлору перхлорат аніона розташовані вище і нижче центрального атома вуглецю на відстані 4.09 Å.
 (3)
(3)
Для циклопропенієвих циклів довжина зв’язку С–С – 1.37 Å. Катіони тропілію 1 (довжина зв’язку С-С – 1.47 Å), азолію 2, пірилію 3 побудовані аналогічно. Катіони ацилію 4 лінійні зі скороченими зв’язками С=О (1.10-1.12 Å).

Електронна спектроскопія є одним з важливих методів дослідження карбенієвих йонів, але інтерпретація спектрів потребує бути обережним, бо карбокатіони можуть реагувати з іншими частинками, що є в розчині. Іноді, особливо в розчинниках з малою діелектричною проникністю відбувається взаємодія катіона з аніоном типу переносу заряду.
Приклад – катіон тропілію І.
Х = BF4- (217, 274, 288 нм); Х = I (278, 422, 575 нм)
В спектрах 1Н ЯМР маємо зміщення сигналів різних груп в слабке поле по відношенню до близьких нейтральних систем.
(CH3)2CH+ 13.5 і 5.06 м.ч.
(CH3)3C+ 4.35 м.ч. (всі в SO2ClF/SbF5)

(в FSO3H)
В спектрі 13С ЯМР трет-бутил гексафлуороборату сигнал центрального вуглецю спостерігається з 335.2 м.ч., ізопропіл-катіона – 320.6 м.ч.; для Ph3C+ – 210 м.ч.
Спектри звичайно записують в тих умовах, в яких карбокатіони стабільні. Потім перевіряють шляхом хімічних реакцій з нуклеофілами (н-д з MeOH).
Електричні властивості
Полярографічні потенціали напівхвиль відновлення карбокатіонів можна також використовувати для порівняння стабільності катіонів і відповідних радикалів.
 (4)
(4)
Структура пентакоординованих йонів вивчалася квантовохімічними методами.
Іон метонію СН5+, який експериментально спостерігався в мас-спектрах, має малосімметричну будову, бо при протонуванні метану в реакції бере участь головна частка гібрідізованной sр3-орбіталі (фронтальна атака). Відстань Н–Н, згідно з розрахунками, майже в точності дорівнює межпротонній відстані в молекулі водню. Звідси випливає, що катіон CH5+ можна розглядати як комплекс кислоти СН3+ і Н2. Цим пояснюється факт легкого розщеплення СН5+ на СН3+ і Н2. Внаслідок зазначеного явища в йоні метонію можливі перегрупування «від зв'язку до зв'язку», які виявляються, наприклад, при застосуванні дейтерієвої мітки.
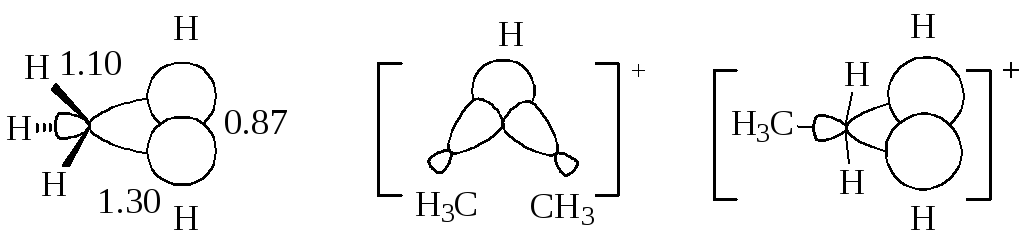
Структура пентакоординованого йону С2Н7+ представляється двох типів (друга структура вважається менш стабільною)
Йони карбонію є інтермедіатами в спектрометричних процесах фрагментації, анодному окисленні насичених вуглеводнів в суперкислому середовищі.
![]()
Способи утворення карбенієвих йонів
Карбенієві йони утворюються в результаті:
1) дисоціації зв’язку С-Х;
2) розпаду діазонієвих солей (гарячі карбенієві йони);
3) комплексоутворення з аніоном (кислоти Льюїса і Ag+);
4) протонування електронегативного атома
 (5)
(5)
5) приєднання протона до ненасичених сполук, в тому числі ароматичних:

 (6)
(6)
Протон – найпростіший з електрофілів. Але протонування олефінів і ароматичних сполук важко здійснювати звичайними кислотами. Необхідні сильніші кислоти. Магічна кислота HSO3F/SbF5 на 17 порядків ефективніша, ніж сірчана кислота.
Інші електрофіли можуть давати з олефінами йони циклічного типу, зокрема з бромом бромонієві солі. Тому в результаті бромування утворюються транс-конформери дибромалканів.
В разі нітрилів краще діяти кислотами Льюїса, щоб не гідролізувати карбокатіон.
6) Відрив гідрид-йона від нейтральної частинки

Звичайно обміну між розчинником і воднем, що переноситься, не відбувається. Але у реакції між пентаметилбензил-катіоном і ізобутаном цей обмін спостерігається. Цей об’єкт є пограничним між хімією пентакоординованих карбонієвих і карбенієвих йонів.
7) З алкоксидів та карбенів
![]()
(7)
Особливості методів генерації карбокатіонів.
1) Дисоціація С-Х зв’язків. Йде ефективно в воді, метанолі, оцтовій кислоті. При цьому перебігають реакції нуклеофільного заміщення.
Великий вклад у розробку цих реакцій внесли Ганс Мейервейн (Німеччина), сер Крістофер Інгольд (Великобританія) і Франк Уітмор (США).
В ході SN1 реакції відбувається рацемізація продукту (8).

(8)
В SN2 реакції спостерігається вальденівське обернення (9).

(9)
В механізмі SNi конфігурація зберігається (10).

(10)
Стабілізація карбокатіона електронодонорними ефектами веде до підвищення швидкості сольволізу

Коли ефекти просторового стискання і резонансні ефекти діють одночасно, то швидкість сольволізу сильно зростає.

Анхімерне прискорення відбувається при утворенні некласичних карбокатіонів

Участь ароматичних ядер веде теж до прискорення сольволізу.

(11)
Це підтверджується: 1) рацемізацією продуктів сольволізу та 2) введенням радіоактивної мітки по обох атомах вуглецю. Останнє зумовлене нехіральністю фенонієвого йона. 3) Іноді відбувається збереження конфігурації, внаслідок утворення некласичного карбокатіона.
Так, продукт 2 на схемі (12) має збережену -конфігурацію.

(12)
Цис-ізомер конденсованого циклопропаноциклопентану реагує зі збереженням конфігурації і перерозподілом дейтерію між атомами в 1,3,5-положеннях. Транс-ізомер реагує повільніше, причому відбувається інверсія конфігурації, але дейтерій не перерозподіляється.

(13)
2) Карбокатіони з діазонієвих солей утворюються дуже легко. Це один з найкращих способів генерації цих активних частинок.

В ароматичному ряді діазонієві солі можна виділяти у вільному стані, але далі вони перетворюються в активні карбокатіони. Аліфатичні карбокатіони, хоча і утворюються швидко, далі реагують з розчинником та можуть давати продукти перегрупування. Хлоридні форми діазонієвих солей в присутності солей міді(І) вступають в радикальні реакції (реакції Зандмейера, Мейервейна).
З амідів можуть отримуватися ацилкарбокатіони через діазонієві солі.

3) Карбокатіони, які утворюються при електрофільній атаці гетероатомів.
Атака на атом галогену

Реакція може перебігати з похідними зі ступенем окислення 2 і більше, наприклад, для фосгену – 4. Крім AlCl3 застосовуються інші кислоти Льюїса – SnCl4, SbCl5 та ін.
Подібний принцип використовується для генерації карбокатіонів з ароматичних сполук, але необхідні жорсткіші умови.
![]()
В звичайних розчинниках (ССl4, бензен, CS2) такі інтермедіати знаходяться у стані йонних пар.
![]()
Атака на атом кисню.
 (14)
(14)
