
- •Глава 1. Политропные процессы.
- •Уравнение процесса
- •Теплоемкость политропных процессов
- •Энергетические характеристики политропных процессов Изменение энтропии
- •Работа расширения /сжатия в политропном процессе.
- •I закон термодинамики
- •Пример №1:
- •Пример №2:
- •Глава 2. Теплообменные аппараты.
- •Конструкции теплообменников
- •Глава 3. Законы термодинамики.
- •Разделы термодинамики
- •Физический смысл термодинамики Необходимость термодинамики
- •Законы — начала термодинамики
- •Основные формулы термодинамики Условные обозначения
- •Формулы термодинамики идеального газа
- •Термодинамика сплошных сред
- •Список литературы.
Глава 1. Политропные процессы.
До сих пор рассматривались процессы, у которых имелись вполне определенные признаки: изохорный процесс осуществлялся при постоянном объеме; изобарный — при постоянном давлении; изотермический — при постоянной температуре; адиабатный— при отсутствии теплообмена между рабочим телом и внешней средой. Наряду с этими процессами можно представить еще бесконечное множество процессов, у которых имеются другие постоянные признаки.
Условились всякий процесс идеального газа, в котором удельная теплоемкость является постоянной величиной, называть политропным процессом, а линию процесса — политропой.
Из определения политропного процесса следует, что основные термодинамические процессы — изохорный, изобарный, изотермический и адиабатный,— если они протекают при постоянной удельной теплоемкости, являются частными случаями политропного процесса. Итак, политропный процесс проходит при постоянной теплоемкости.
![]()
Если теплоемкость зависит от температуры, то нужно найти среднюю теплоемкость, чтобы процесс стал политропным.
Уравнение процесса
Для исследования процесса и расчета слагаемых I закона термодинамики нужно установить связь между параметрами состояния в политропном процессе. Эта функция называется уравнением политропы. Запишем уравнение I закона термодинамики, преобразуем
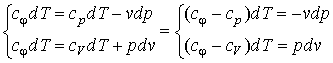
и поделим почленно
![]()
Так
как ![]() = const в
процессе, то левая часть
= const в
процессе, то левая часть ![]() = const и
называется показатель политропы:
= const и
называется показатель политропы:
n = ![]() ,
, ![]()
При этом, каждому значению n соответствует некоторый конкретный процесс.
Получили дифференциальное уравнение:
n=![]()
Разделяем переменные
![]()
и интегрируем в пределах процесса
![]()
Потенцируем
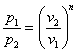 или
или ![]()
Это выражение выполняется не только для крайних точек процесса, но и для всех промежуточных. Оно называется уравнением политропы:
![]()
Запишем это уравнение через другие параметры P-T и V-T:
![]()
![]()
![]()
![]()
![]()
![]()
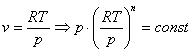
![]()
![]()
![]()
Теплоемкость политропных процессов
Теплоемкость
политропного процесса ![]() можно
определить из выражения
можно
определить из выражения
![]() = n
= n
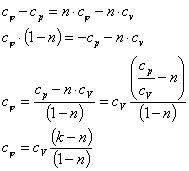
где k - показатель адиабаты.
Найдем
значение ![]() и n для
изопроцессов определения сведем
результаты в таблицу
и n для
изопроцессов определения сведем
результаты в таблицу
|
процесс |
|
n |
|
T=const |
|
1 |
|
p=const |
|
0 |
|
v=const |
|
|
|
q=const |
0 |
k |
Изобразим
зависимость ![]() (n)
графически
(n)
графически
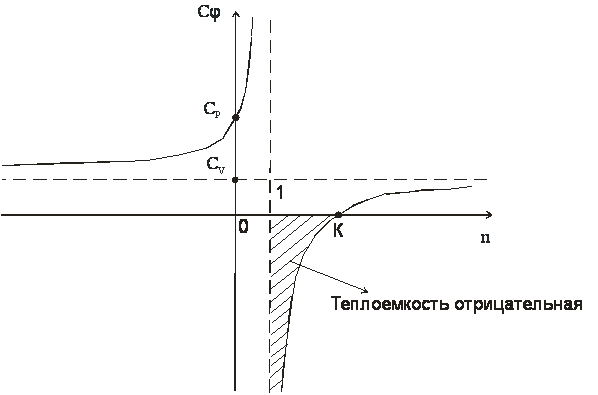
В деапазоне 1<n<k теплоемкость процессов отрицательная, т.е. с подводом теплоты температура системы уменьшается, а с отводом теплоты - увеличивается.
Смысл отрицательной теплоемкости заключается в том, что вся подведенная теплота расходуется на работу и, кроме этого, на работу затрачивается еще и часть внутренней энергии системы
![]()
dq=du+dl подвод тепла
![]()
![]()
|
|
|
|
|
|
![]() dq=du+dl отвод
тепла
dq=du+dl отвод
тепла
Энергетические характеристики политропных процессов Изменение энтропии
По аналогии с интегралом работы было получено выражение для подсчета количества теплоты в ТДП. Для этого был введен параметр состояния системы – энтропия.
Энтропия является функцией состояния. Ее изменение в пределах процесса определяется как разность конечного и начального значений. Также как внутренняя энергия она определяется с точностью до произвольной постоянной. В ТДП нужно знать только ее изменение. Энтропия, и ее изменение не поддается физическому определению и измерению, а является расчетной величиной.
![]()

![]()
![]()
