
- •Глава III. Основы молекулярно-кинетической теории
- •§12. Основные понятия и исходные положения
- •§13. Статистический метод исследования систем. Понятие о случайной величине и функции распределения
- •§14. Идеальный газ
- •§15. Основное уравнение молекулярно - кинетической теории
- •15.1. Вывод основного уравнения молекулярно-кинетической теории
- •15.2. Другие формы записи основного уравнения молекулярно-кинетической теории. Абсолютная температура - мера энергии теплового движения молекул
- •§16. Следствия из основного уравнения молекулярно-кинетической теории
- •§17. Распределение молекул по скоростям и кинетической энергии (распределение Максвелла)
- •§18. Барометрическая формула. Распределение молекул в потенциальном силовом поле (распределение Больцмана)
- •§19. Средняя длина свободного пробега молекул. Понятие о физическом вакууме
- •§20. Закон равномерного распределения энергии по степеням свободы
- •§21. Явления переноса в газах
- •21.1. Диффузия
- •21.2. Внутреннее трение (вязкость)
- •21.3. Теплопроводность
§20. Закон равномерного распределения энергии по степеням свободы
Напомним, что под числом степеней свободы тела понимают наименьшее число независимых координат, необходимых для полного определения положения тела.
Л. Больцман установил закон равномерного распределения энергии молекул идеального газа по степеням свободы: на каждую степень свободы молекулы в среднем приходится одинаковая кинетическая энергия, равная kT/2.
Таким образом, молекула с i-степенями свободы обладает средней кинетической энергией, равной
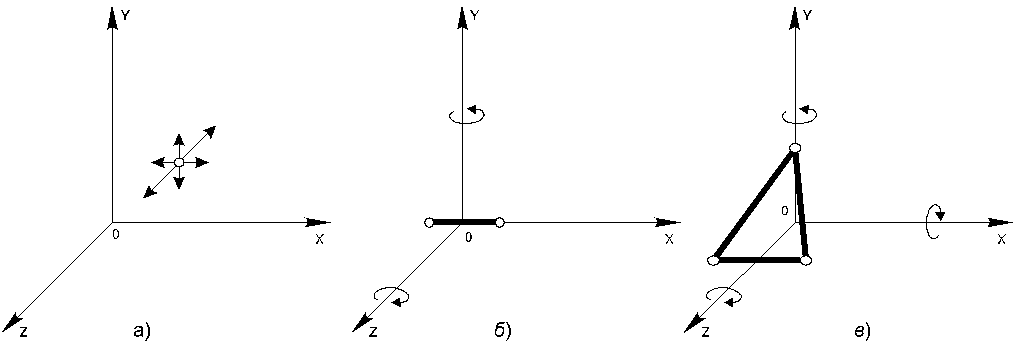
Рис.20.1
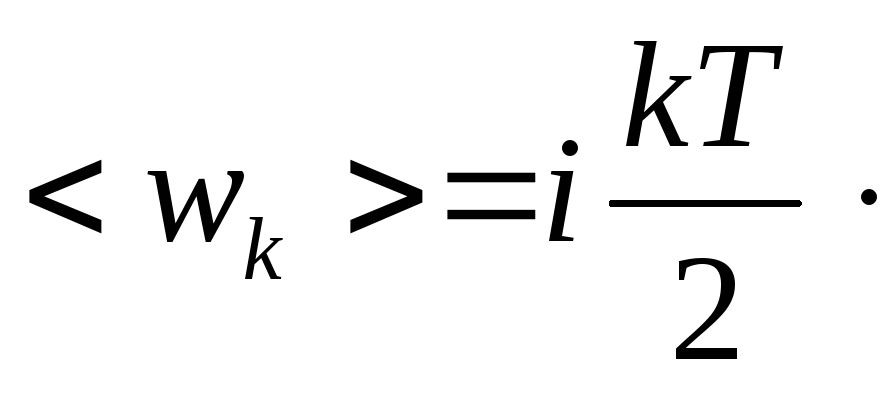 (20.1)
(20.1)
Заметим, что при определении числа степеней свободы молекул газов принимаются во внимание те степени свободы, которые вносят существенный вклад в ее кинетическую энергию.
Например,
молекула одноатомного газа, принимаемая
за материальную точку (рис.20.1.а) и
способная совершать три независимых
движениях (вдоль осей X,
Y и
Z),
имеет три степени свободы. Следовательно,
средняя кинетическая энергия такой
молекулы
![]() .
Этот вывод согласуется с выражением
(15.25). Действительно, ввиду хаотичности
теплового движения молекул кинетическая
энергия каждой из них равномерно
распределяется между тремя степенями
свободы, так что в среднем на каждую
степень свободы приходится энергия,
равнаяkT/2.
.
Этот вывод согласуется с выражением
(15.25). Действительно, ввиду хаотичности
теплового движения молекул кинетическая
энергия каждой из них равномерно
распределяется между тремя степенями
свободы, так что в среднем на каждую
степень свободы приходится энергия,
равнаяkT/2.
Молекулу
двухатомного газа можно представить в
виде двух атомов, жестко связанных друг
с другом (рис.20.1.б). Кроме трех степеней
свободы поступательного движения, такая
система имеет еще две степени свободы
вращения вокруг осей Y
и Z
(вращение вокруг третьей оси X
не вносит вклада в энергию молекулы,
так как момент инерции молекулы
относительно этой оси ничтожно мал).
Таким образом, двухатомная молекула
имеет пять степеней свободы и,
следовательно, обладает средней
кинетической энергией
![]() .
.
Молекулы,
состоящие из трех и более атомов, имеют
шесть степеней свободы: три поступательных
и три вращательных (рис.20.1.в). Для таких
молекул
![]() .
.
Строго говоря, связи между атомами в молекулах реальных газов не являются абсолютно жесткими, поэтому при некоторых условиях (например, при повышенных температурах) эти связи скорее можно представить в виде упругих пружин, результатом чего являются дополнительные, колебательные степени свободы.
Закон равномерного распределения энергии по степеням свободы приводит к выводу о равноправности всех степеней свободы молекулы: все они вносят одинаковый вклад в ее среднюю кинетическую энергию.Однако этот вывод имеет ограниченную область применимости и уточнен в квантовой статистике.
§21. Явления переноса в газах
Равновесное состояние газа в молекулярно-кинетической теории рассматривается как состояние полной хаотичности движения молекул, распределение которых по скоростям подчиняется закону Максвелла. Любое неравновесное состояние газа всегда связано с нарушением полной хаотичности движения. Основной особенностью неравновесных состояний является стремление газа самопроизвольно переходить в равновесное состояние. Это обусловлено хаотическим движением молекул и непрерывными столкновениями их друг с другом что приводит к постоянному перемешиванию молекул, изменению их скоростей и энергии.
Установление в газе максвелловского распределения молекул по скоростям при переходе его в равновесное состояние всегда связано с направленным переносом массы, импульса и энергии, что позволило объединить соответствующие процессы общим названием - явления переноса.
К явлениям переноса относят диффузию (перенос массы), внутреннее трение, или вязкость (перенос импульса) и теплопроводность (перенос энергии в форме теплоты).
