
- •Глава III. Основы молекулярно-кинетической теории
- •§12. Основные понятия и исходные положения
- •§13. Статистический метод исследования систем. Понятие о случайной величине и функции распределения
- •§14. Идеальный газ
- •§15. Основное уравнение молекулярно - кинетической теории
- •15.1. Вывод основного уравнения молекулярно-кинетической теории
- •15.2. Другие формы записи основного уравнения молекулярно-кинетической теории. Абсолютная температура - мера энергии теплового движения молекул
- •§16. Следствия из основного уравнения молекулярно-кинетической теории
- •§17. Распределение молекул по скоростям и кинетической энергии (распределение Максвелла)
- •§18. Барометрическая формула. Распределение молекул в потенциальном силовом поле (распределение Больцмана)
- •§19. Средняя длина свободного пробега молекул. Понятие о физическом вакууме
- •§20. Закон равномерного распределения энергии по степеням свободы
- •§21. Явления переноса в газах
- •21.1. Диффузия
- •21.2. Внутреннее трение (вязкость)
- •21.3. Теплопроводность
§14. Идеальный газ
Для описания свойств каких-либо объектов обычно пользуются модельными представлениями. Вид модели выбирается в зависимости от характера решаемой задачи. В частности, при исследовании свойств достаточно разреженных газов в молекулярной физике применяется модель так называемого идеального газа.
Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающе малые собственные размеры.
Кроме того, считается, что:
- молекулы идеального газа при взаимных столкновениях и ударах о стенки сосуда ведут себя как абсолютно упругие шарики;
- движение каждой молекулы идеального газа подчиняется законам механики, при этом между столкновениями каждая молекула движется равномерно и прямолинейно;
- связи между атомами в многоатомных молекулах идеального газа абсолютно жесткие (это положение нарушается при высоких температурах газа: атомы получают возможность совершать колебания друг относительно друга и связи между ними в этом случае следует считать упругими).
Опытным путем было показано, что поведение идеального газа подчиняется уравнению Клапейрона-Менделеева:
![]() ,
(14.1)
,
(14.1)
где
![]() -
соответственно давление, объем, масса,
молярная масса и температура газа;
-
соответственно давление, объем, масса,
молярная масса и температура газа;![]() -
универсальная газовая постоянная.
-
универсальная газовая постоянная.
Многие газы при определенных условиях можно считать идеальными. Особенно близки по своим свойствам к идеальному газу гелий и водород.
§15. Основное уравнение молекулярно - кинетической теории
Основным уравнением молекулярно-кинетической теории принято называть уравнение, устанавливающее связь между давлением газа, объемом и средней кинетической энергией теплового движения его молекул. Давление газа в сосуде есть результат столкновений молекул газа со стенками сосуда. Ввиду хаотичности теплового движения молекул давление газа на стенки сосуда (независимо от его формы) одинаково и, по определению, представляет собой среднюю силу, действующую по направлению нормали к стенке на единицу площади ее поверхности.
15.1. Вывод основного уравнения молекулярно-кинетической теории
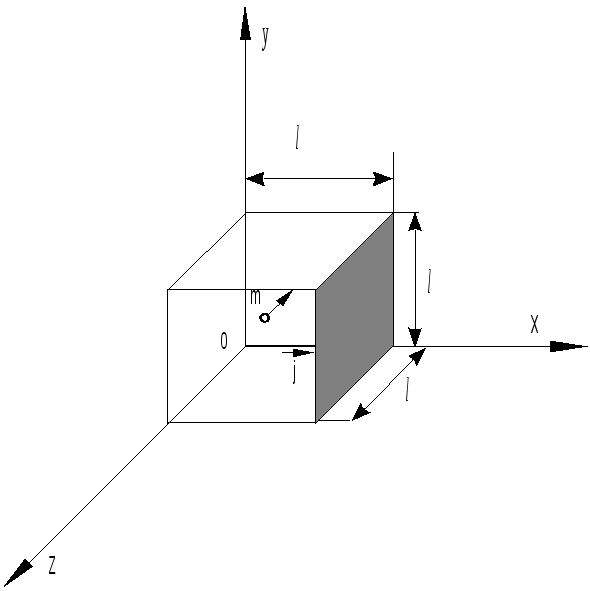
Для упрощения математических выкладок выведем основное уравнение для идеального газа, находящегося в сосуде кубической формы (рис. 15.1). Будем считать, что газ однороден (состоит из одинаковых молекул) и находится в состояния теплового равновесия.
Vj
Рис.15.1


![]() и
и![]() скорость и массуj
-ой молекулы (j = 1, 2,...,N
-номер молекулы, N
- общее число молекул в сосуде). Скорость
молекулы можно представить в виде
векторной суммы ее составляющих вдоль
выбранных осей координат (см. рис.15.1):
скорость и массуj
-ой молекулы (j = 1, 2,...,N
-номер молекулы, N
- общее число молекул в сосуде). Скорость
молекулы можно представить в виде
векторной суммы ее составляющих вдоль
выбранных осей координат (см. рис.15.1):
![]() . (15.1)
. (15.1)
Рассчитаем давление газа на правую заштрихованную (рис.15.1) стенку сосуда.
Для описания движения молекул газа и их взаимодействия со стенкой сосуда воспользуемся законами Ньютона.
Силу
![]() ,
действующую на стенку в момент удара
со стороны
,
действующую на стенку в момент удара
со стороны![]() -ой
молекулы, можно найти по третьему закону
Ньютона, если предварительно найти силу
-ой
молекулы, можно найти по третьему закону
Ньютона, если предварительно найти силу![]() ,
действующую на молекулу со стороны
стенки:
,
действующую на молекулу со стороны
стенки:
![]() . (15.2)
. (15.2)
Силу
![]() определим с помощью второго закона
Ньютона, в соответствии с которым
изменение импульса молекулы численно
равно импульсу действующей на нее силы:
определим с помощью второго закона
Ньютона, в соответствии с которым
изменение импульса молекулы численно
равно импульсу действующей на нее силы:
![]() ,
(15.3)
,
(15.3)
где
![]() -
изменение импульса молекулы,
-
изменение импульса молекулы,
![]() -
продолжительность
удара молекулы о стенку.
-
продолжительность
удара молекулы о стенку.
Рис.15.2
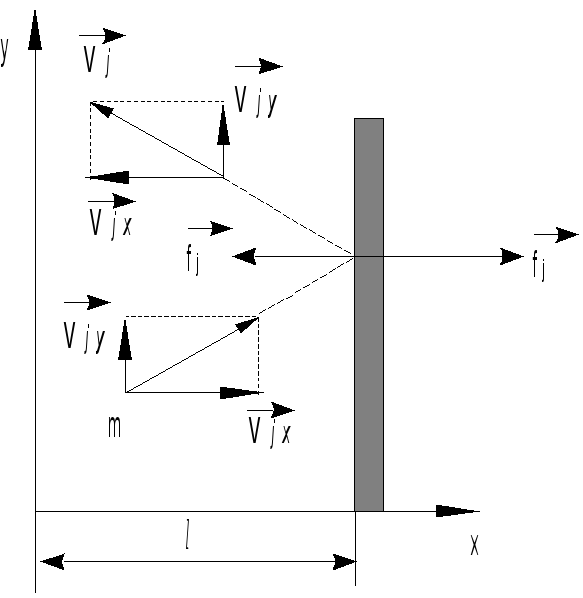
![]() на противоположное (рис. 15.2), поэтому
полное изменение импульса молекулы при
ударе (с учетом направлений составляющей
на противоположное (рис. 15.2), поэтому
полное изменение импульса молекулы при
ударе (с учетом направлений составляющей![]() до
и после удара)
до
и после удара)
![]() .
(15.4)
.
(15.4)
Подставим выражение (15.4) в (15.3)
![]()
или с учетом равенства (15.2)
![]() .
(15.5)
.
(15.5)
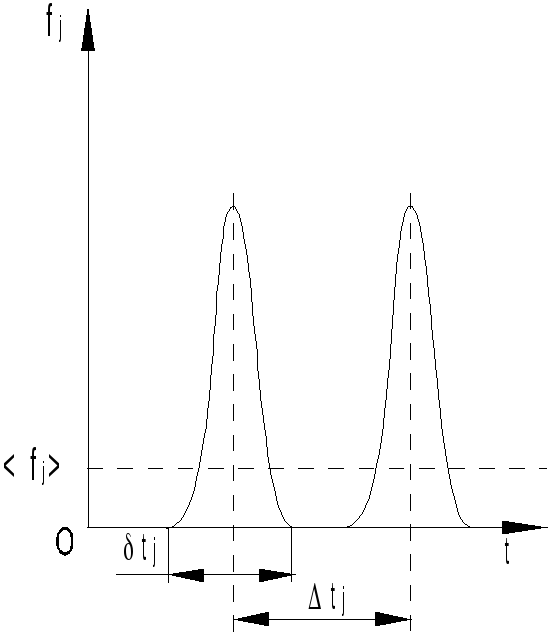
Из
этого выражения можно было бы найти
модуль силы, но неизвестна продолжительность
удара
![]() .
Поэтому заменим кратковременно
действующую силу
.
Поэтому заменим кратковременно
действующую силу![]() (характер ее изменения во времени показан
на рис.15.3) "эквивалентной" ей
постоянной силой
(характер ее изменения во времени показан
на рис.15.3) "эквивалентной" ей
постоянной силой![]() таким образом, чтобы импульс этой силы
за время
таким образом, чтобы импульс этой силы
за время![]() между двумя
последовательными ударами равнялся бы
импульсу силы
между двумя
последовательными ударами равнялся бы
импульсу силы
![]() ,
то есть
,
то есть
Рис.15.3
![]() . (15.6)
. (15.6)
Подставим выражение (15.6) в (15.5):
![]() , (15.7)
, (15.7)
отсюда:
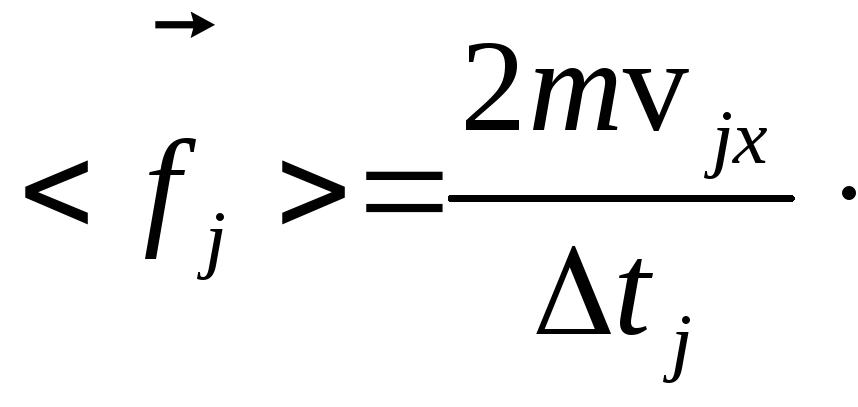 (15.8)
(15.8)
Промежуток
времени
![]() равен
равен
![]() , (15.9)
, (15.9)
так
как между двумя ударами об одну и ту же
стенку молекула проходит вдоль оси X
расстояние
![]() со скоростью
со скоростью
![]() (рис. 15.4).
(рис. 15.4).
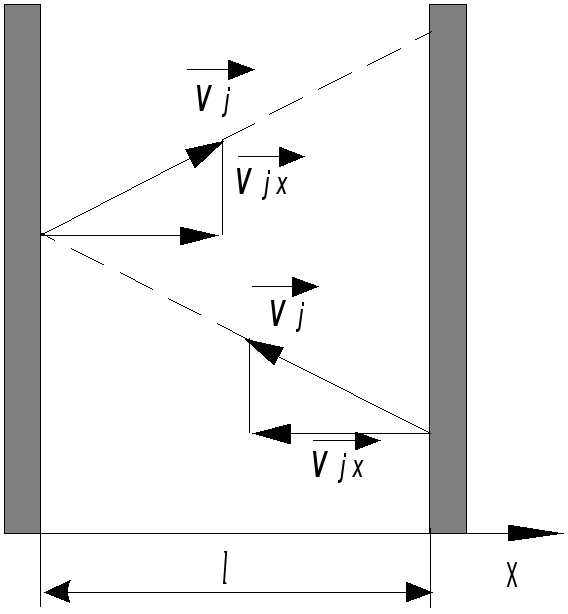 Рис.15.4
Рис.15.4![]() удара одной молекулы выражение:
удара одной молекулы выражение:
![]() .
(15.10)
.
(15.10)
Средняя
сила удара
![]() всехN
молекул будет равна
всехN
молекул будет равна
![]() .
(15.11)
.
(15.11)
Разделив (15.11) на площадь грани куба S=l2, найдем давление газа
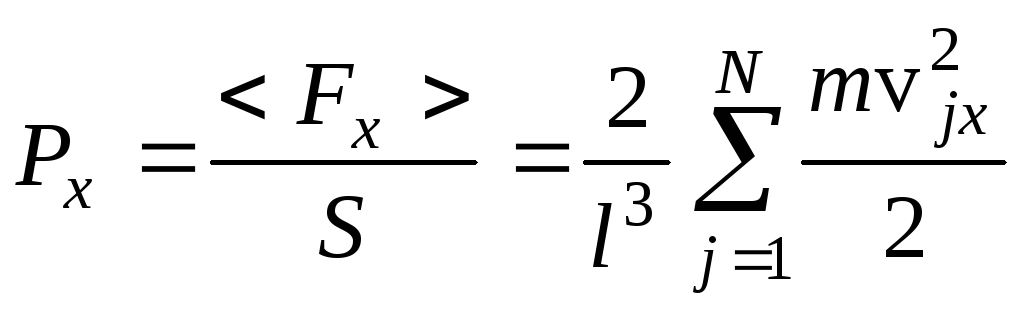 .
(15.12)
.
(15.12)
Аналогично для сторон куба в направлении осей Y и Z:
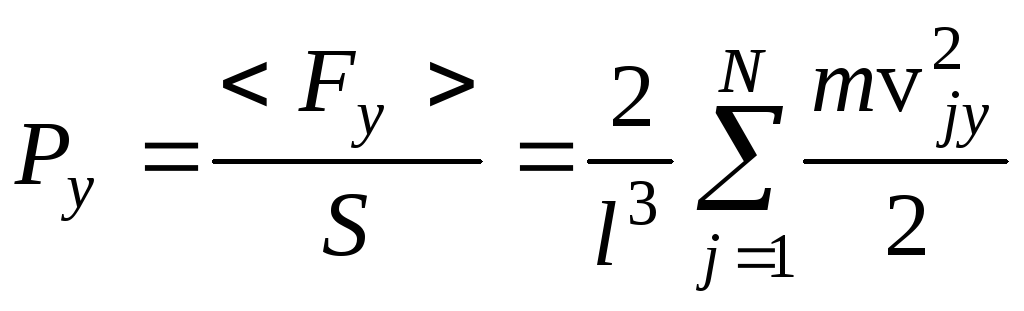 и
и 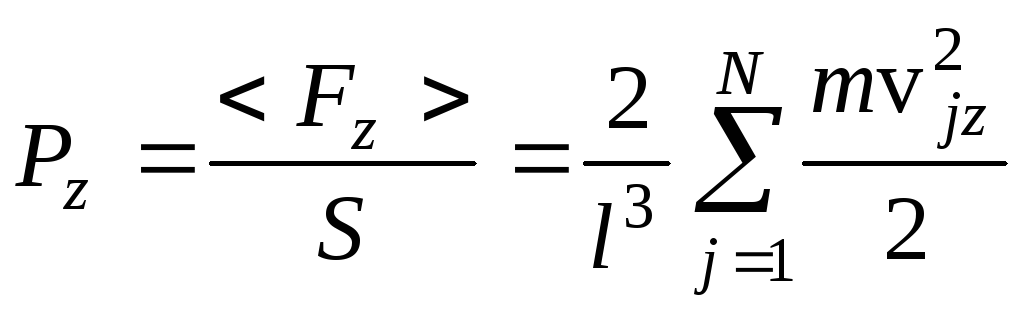 .
.
Так как давление газа одинаково во всех направлениях, то
![]() и
и ![]()
или
![]() .
(15.13)
.
(15.13)
Учитывая,
что
![]() (V
- объем газа),
и, выражая квадрат скорости молекул на
основании формулы (15.1)
(V
- объем газа),
и, выражая квадрат скорости молекул на
основании формулы (15.1)
![]() , (15.14)
, (15.14)
получим из (15.13)
![]() ,
(1.15)
,
(1.15)
или
![]() ,
(15.16)
,
(15.16)
где
![]() -
суммарная кинетическая энергия
поступательного движения всех молекул
в объемеV.
-
суммарная кинетическая энергия
поступательного движения всех молекул
в объемеV.
Выражение (15.16) представляет собой основное уравнение молекулярно-кинетической теории для идеального газа. Из него следует, что произведение давления идеального газа на его объем равно двум третям суммарной кинетической энергии поступательного движения всех молекул в данном объеме.
