
- •Эту хуйню делали:
- •3 Северина с 440-448
- •4 Добавить серу
- •2 Северина с 704
- •3 Не нашел
- •1 Северина с 140-170
- •Применение ингибиторов ферментов
- •1 Северина с 143-146
- •1 Северина с 146-149
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •136,137. Желудочный сок, формы кислотности.
- •Вопрос 1
- •Вопрос 2
- •128. Содержание глюкозы в крови, возрастные особенности.
- •Вопрос 3
- •Вопрос 4
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •138. Физико-химические показатели мочи, возрастные особенности.
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •139. РН мочи в норме и при патологии.
- •Вопрос 1
- •17. Процессы превращения а/к в кишечнике под влиянием гнилостных бактерий. Обезвреживание ядовитых продуктов.
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •140. Пигменты мочи и их происхождение.
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •141. Органические вещества мочи.
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •142. Азотсодержащие вещества мочи.
- •Вопрос 1
- •19. Биосинтез белков. Роль нуклеиновых кислот.
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 1
- •19. Биосинтез белков. Роль нуклеиновых кислот.
- •20. Биосинтез днк. Повреждение и репарация днк.
- •21. Транскрипция, генетический код, процессинг рнк.
- •Вопрос 2
- •Вопрос 3
- •92,93. Витамины. Классификация, участие в обмене веществ, а- гипо- гипер- витаминозы.
- •Вопрос 4
- •143. Индикан мочи.
- •Вопрос 1
- •24. Дезаминирование, трансаминирование, декарбоксилирование.
- •25. Связь трансаминирования и дезаминирования. Непрямое дезаминирование.
- •Вопрос 2
- •Вопрос 2
- •Вопрос 4
- •144. Парные соединения мочи.
- •2) Дезаминирование глутамата
- •1)Трансаминирование
- •2)Окислительное дезаминирование глутамата
- •Вопрос 1
- •Вопрос 2.Биосинтез триацилглицеринов, способы синтеза, последовательность реакций. Роль инсулина, адреналина, глюкогона в регуляции синтеза. Значение процесса.
- •Вопрос 3. Гормоны и их классификация. Представление об основных механизмах гормональной регуляции метаболизма.
- •Гормон паращитовидной железы
- •Причины
- •Лечение
- •Тиоредоксин: принцип действия
- •Тиоредоксин: роль в организме
- •2. Депонирование и мобилизация жиров в жировой ткани.
- •3. Ферменты сыворотки крови
- •2.Активные формы кислорода
- •Гомеостатические функции почек
- •Основные функции гормонов
- •4. Мышечная ткань
- •Билет №35.
- •Билет №36
- •Билет №37
- •Билет №38
- •3. Синтез гема и его регуляция. Нарушение синтеза гема, Порфирии. Обмен железа: источники, транспорт, депонирование.
- •4. Возрастные особенности состава желудочного сока.
- •39 Билет
- •40 Билет
- •3) Белковая система
- •41 Билет
Вопрос 2
48. Роль печени в обмене углеводов. В печени происходит синтез гликогена, глюконеогенез, ПФЦ. Печеночный гликоген участвует в поддержании уровня глюкозы в крови, а гликоген мышц играет энергетическую роль. Глюкоза6фосфат идет на синтез гликогена.
Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени.
В печени синтез гликогена и его регуляция в основном аналогичны тем процессам, которые протекают в других органах и тканях, в частности в мышечной ткани. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, если ее содержание значительно уменьшается (например, у человека это происходит при недостаточном поступлении углеводов с пищей или в период ночного «голодания»).
Необходимо подчеркнуть важную роль фермента глюкокиназы в процессе утилизации глюкозы печенью. Глюкокиназа, подобно гексокиназе, катализирует фосфорилирование глюкозы с образованием глюкозо-6-фосфата, при этом активность глюкокиназы в печени почти в 10 раз превышает активность гексокиназы. Важное различие между этими двумя ферментами заключается в том, что глюкокиназа в противоположность гексокиназе имеет высокое значение КМ для глюкозы и не ингибируется глюкозо-6-фосфатом.
После приема пищи содержание глюкозы в воротной вене резко возрастает: в тех же пределах увеличивается и ее внутрипеченочная концентрация . Повышение концентрации глюкозы в печени вызывает существенное увеличение активности глюкокиназы и автоматически увеличивает поглощение глюкозы печенью (образовавшийся глюкозо-6-фосфат либо затрачивается на синтез гликогена, либо расщепляется).
Считают, что основная роль печени – расщепление глюкозы – сводится прежде всего к запасанию метаболитов-предшественников, необходимых для биосинтеза жирных кислот и глицерина, и в меньшей степени к окислению ее до СО2 и Н2О. Синтезированные в печени триглицериды в норме выделяются в кровь в составе липопротеинов и транспортируются в жировую ткань для более «постоянного» хранения.
В реакциях пентозофосфатного пути в печени образуется НАДФН, используемый для восстановительных реакций в процессах синтеза жирных кислот, холестерина и других стероидов. Кроме того, при этом образуются пентозофосфаты, необходимые для синтеза нуклеиновых кислот.
Наряду с утилизацией глюкозы в печени происходит и ее образование. Непосредственным источником глюкозы в печени служит гликоген. Распад гликогена в печени происходит в основном фосфоролитическим путем. В регуляции скорости гликогенолиза в печени большое значение имеет система циклических нуклеотидов. Кроме того, глюкоза в печени образуется также в процессе глюконеогенеза.
Основными субстратами глюконеогенеза служат лактат, глицерин и аминокислоты. Принято считать, что почти все аминокислоты, за исключением лейцина, могут пополнять пул предшественников глюконеогенеза.
При оценке углеводной функции печени необходимо иметь в виду, что соотношение между процессами утилизации и образования глюкозы регулируется прежде всего нейрогуморальным путем при участии желез внутренней секреции.
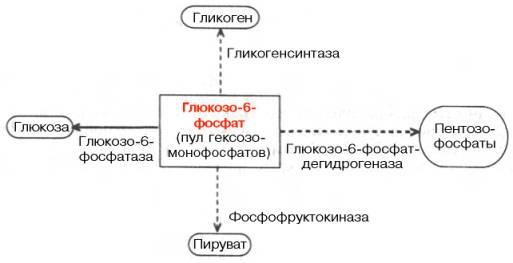
Центральную роль в превращениях глюкозы и саморегуляции углеводного обмена в печени играет глюкозо-6-фосфат. Он резко тормозит фосфоролитическое расщепление гликогена, активирует ферментативный перенос глюкозы с уридиндифосфоглюкозы на молекулу синтезирующегося гликогена, является субстратом для дальнейших гликолитических превращений, а также окисления глюкозы, в том числе по пентозофосфатному пути. Наконец, расщепление глюкозо-6-фосфата фосфатазой обеспечивает поступление в кровь свободной глюкозы, доставляемой током крови во все органы и ткани (рис. 16.1).
При многих патологических состояниях, в частности при сахарном диабете, отмечаются существенные изменения в функционировании и регуляции системы Ф-2,6-Р2. Установлено, что при экспериментальном (стептозотоциновом) диабете у крыс на фоне резкого увеличения уровня глюкозы в крови и моче в гепатоцитах содержание Ф-2,6-Р2 снижено. Следовательно, снижается скорость гликолиза и усиливается глюконео-генез. Данный факт имеет свое объяснение. Возникающие у крыс при диабете нарушения гормонального фона: увеличение концентрации глю-кагона и уменьшение содержания инсулина – обусловливают повышение концентрации цАМФ в ткани печени, усиление цАМФ-зависимого фосфорилирования бифункционального фермента, что в свою очередь приводит к снижению его киназной и повышению бисфосфатазной активности. Таков может быть механизм снижения уровня Ф-2,6-Р2 в гепатоцитах при экспериментальном диабете. По-видимому, существуют и другие механизмы, ведущие к снижению уровня Ф-2,6-Р2 в гепатоцитах при стрептозото-циновом диабете. Показано, что при экспериментальном диабете в ткани печени имеет место снижение активности глюкокиназы (возможно, и снижение количества данного фермента). Это приводит к падению скорости фосфорилирования глюкозы, а затем к снижению содержания фруктозо-6-фосфата – субстрата бифункционального фермента. Наконец, в последние годы было показано, что при стрептозотоциновом диабете уменьшается количество мРНК бифункционального фермента в гепатоцитах и как следствие – снижается уровень Ф-2,6-Р2 в ткани печени, усиливается глюко-неогенез. Все это еще раз подтверждает положение, что Ф-2,6-Р2, являясь важным компонентом в цепи передачи гормонального сигнала, выступает в роли третичного посредника при действии гормонов, прежде всего на процессы гликолиза и глюконеогенеза.
