
Лекция 3 (для ФТ) (1)
.doc
Лекция № 3
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА
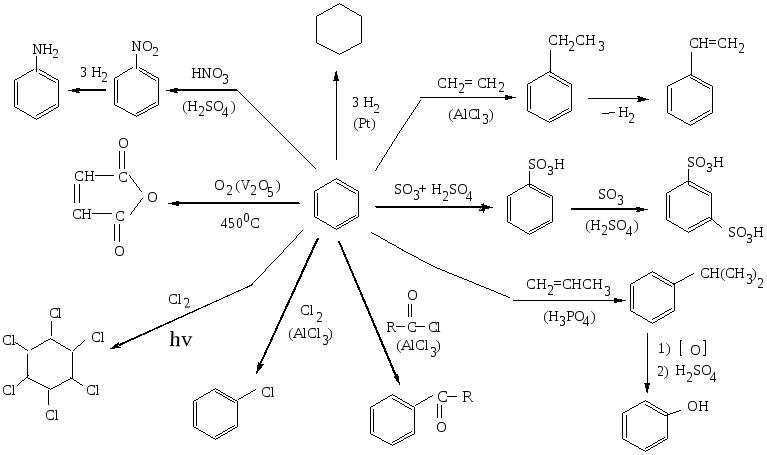
На бензол не действуют сильные окислители (KMnO4, K2Cr2O7).
Ядро бензола может быть разрушено только в результате озонолиза (образуется глиоксаль) или окисления кислородом при 450 ºС на катализаторе V2O5 до малеинового ангидрида.
Реакции присоединения бензолу нехарактерны и немногочисленны (гидрирование до циклогексана, хлорирование на свету до гексахлорциклогексана).
.
Лекция № 3
I. ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ
1) НИТРОВАНИЕ БЕНЗОЛА НИТРУЮЩЕЙ СМЕСЬЮ

нитробензол
Образование иона нитрония в конц. HNO3 можно представить схемой:

Реакцию электрофильного замещения (SE) протекает по схеме:

-комплекс -комплекс
Регенерация катализатора:
![]()
Лекция № 3
2) БРОМИРОВАНИЕ ИЗОПРОПИЛБЕНЗОЛА
а) В присутствии А1С13 реализуется механизм SE; при этом образуется смесь о- и п-бромизопропилбензолов.

б) Бромирование на свету протекает по механизму SR с образованием a-бромизопропилбензола.

Лекция № 3
РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ (SE) В БЕНЗОЛЕ

Лекция № 3
ПРАВИЛО ОРИЕНТАЦИИ В РЕАКЦИЯХ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ В РЯДУ ПРОИЗВОДНЫХ БЕНЗОЛА
При наличии в ароматическом ядре заместителя X направленность внедрения Y и скорость реакции SE определяются характером заместителя X.
В бензоле все атомы углерода и водорода равноценны, поэтому в реакциях электрофильного замещения образуется только один монозамещенный продукт.
При введении в молекулу бензола заместителя X электрофильная частица Y+ (например, С1+) может заместить атом водорода в кольце в трех разных положениях:

т.е. возможно образование трех s-комплексов, каждый из которых может быть описан в виде предельных (резонансных) структур:
Лекция № 3

(а) В случае, когда Х - доноры электронов (заместители I рода):
-О-, -ОН, -OR, -NH2, -NHR, -NR2, -R, -C6H5;
они увеличивают электронную плотность в ароматическом ядре, способствуя образованию p- и s-комплексов с Y+ (повышается скорость реакций SE по сравнению с незамещенным бензолом). При орто- и пара-атаке в делокализации положительного заряда в s-комплексе может принимать непосредственное участие заместитель Х [структуры (I), (IV), (IХ) и (XI)]; в результате реакции образуются смесь орто- и пара-дизамещенных продуктов.
Следует отметить, что галогены не являются донорами электронов, не облегчают реакции SE, но ориентируют заместитель Y в орто- и пара-положения
(б) Когда Х - акцепторы электронов (заместители II рода):
-N+R3, -CC13, -NO2, -CN, -CHO, -COR, -COOH, -COOR, -SO3H, они понижают электронную плотность ароматического ядра, тем самым замедляя скорость взаимодействия с электрофильной частицей Y+ в реакциях SE, и ориентируют вступающий заместитель в мета-положение.
Так, строение s-комплексов, описанное с помощью резонансных структур, выявляет у орто- и пара-изомеров структуры (I), (IV) и (IX), (X) соответственно, которые энергетически невыгодны (т.к. в них наведен положительный заряд на атоме углерода, связанном с электронноакцепторным заместителем Х. Вклад в делокализацию
Лекция № 3
положительного заряда будут вносить только структуры (II) и (III) (о-атака) и (VIII) и (X) (п-атака). В этом случае более выгодно мета-замещение, приводящее к образованию s-комплекса, в котором делокализация положительного заряда осуществляется с помощью трех структур (V)-(VII).
При наличии нескольких заместителей одного рода их общее влияние на скорость реакций SE усиливается. В случае удаления функциональной группы от ароматического кольца вдоль по углеродной цепи заместителя ее электронное и ориентирующее влияние на протекание реакций SE резко уменьшается. При несогласованной ориентации двух заместителей образуется сложная смесь продуктов, причем предпочтение отдается ориентирующему действию заместителя I рода.
Лекция № 3
|
ВЛИЯНИЕ ЗАМЕСТИТЕЛЕЙ НА ОРИЕНТАЦИЮ В РЕАКЦИЯХ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ SE
|
||
|
активирующие орто- и пара-ориентанты
|
дезактивирующие орто- и пара-ориентанты
|
дезактивирующие мета-ориентанты |
|
-O- , -OH , -OR , -NH2 , -NHR , -NR2 , -NHCOCH3 (+Mэфф ;-Iэфф)
-Alk , -Ar (+Iэфф)
|
-Cl, -Br, -I, -F (+Mэфф < -Iэфф)
-СH=CHNO2 ,-CH2Cl,
|
+ + -NH3 , -NR3 , -СF3 , -ССl3 (-Iэфф) ;
-SO3H , -SO2R, -СOOH , -СOOR, -CONH2 , -СHO, -COR, -СN, -NO (-Iэфф ; -Mэфф)
|
По силе влияния на связанное с ними бензольное ядро орто- , пара-ориентанты могут быть расположены в следующий ряд:
(ориентанты I рода)
-O- > -NR2 > -NHR > -NH2 > -OH > -OR > -Alk
По силе воздействия на связанное с ними ароматическое ядро заместители второго рода могут быть расположены в следующий ряд:
(ориентанты II рода)
+
- NR3 > -NO2 > -CCl3 > -SO3H > -COR > -CN > -COOH
Лекция № 3
ПРАВИЛО ОРИЕНТАЦИИ В РЕАКЦИЯХ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ В РЯДУ ПРОИЗВОДНЫХ НАФТАЛИНА
Нафталин вступает в реакции электрофильного замещения легче, чем бензол. При этом заместитель обычно вступает в a-положение т.к. в этом случае возникает более энергетически выгодный s-комплекс, чем в b-положении. В первом случае s-комплекс стабилизируется перераспределением электронной плотности без нарушения ароматичности второго кольца, во втором случае такая стабилизация невозможна:

Если в одном из колец нафталина находятся пассивирующие его электроноакцепторные заместители (ориентанты II рода), то реакции SE идут по более активному незамещенному кольцу. Электронодонорные заместители (ориентанты I рода, кроме Hal), напротив активирует кольцо, в котором они находятся, и реакция SE протекают по замещенному кольцу.
Лекция № 3
ХИМИЧЕСКИЕ РЕАКЦИИ НАФТАЛИНА

Лекция № 3
ХИМИЧЕСКИЕ РЕАКЦИИ АНТРАЦЕНА И ФЕНАНТРЕНА

