
- •1. Основные свойства дисперсных систем
- •2. Классификация дисперсных систем
- •3. Методы получения дисперсных систем
- •4. Основные свойства дисперсных систем определяются нескомпенсированной поверхностной энергией
- •Классификация поверхностных явлений
- •6. Поверхностное явление – адсорбция
- •8. Адсорбция на границе жидкость-газ
- •7. Основные адсорбционные уравнения
- •10. Характеристики твердых адсорбентов. Правила подбора
- •11. Основные теории адсорбции на твердых адсорбентах
- •Основные положения теории мономолекулярной адсорбции Ленгмюра
- •12. Основные положения теории полимолекулярной адсорбции бэт
- •13. Адсорбция в растворах электролитов
Классификация поверхностных явлений
Электрические процессы
Образование ДЭС
Электрокинетические явления





6. Поверхностное явление – адсорбция
Основные понятия и определения
Адсорбция – самопроизвольное концентрирование веществ по поверхности раздела фаз.
Адсорбция широко используется при очистке, сушке, разделении и концентрировании жидких и газовых сред. С помощью адсорбции производят очистку и осветление воды, которая в дальнейшем используется для питья. Восприятие человеком запаха и вкуса зависит от адсорбции молекул соответствующих веществ в носовой полости. На явлении адсорбции основана очистка воздуха в противогазах.
Адсорбент – фаза, на поверхности которой происходит адсорбция.
Адсорбируемое вещество имеет два названия:
– адсорбтив – адсорбируемое вещество в объеме раствора;
– адсорбат – на поверхности адсорбента (в адсорбированном состоянии).
Величину адсорбции обычно выражают двумя способами.
Абсолютная адсорбция Аi – количество вещества в поверхностном слое, приходящееся на единицу площади поверхности или единицу массы адсорбента
 ,
моль/м2
или моль/г
,
моль/м2
или моль/г
где
 –
количествоi-го
компонента в поверхностном слое
(адсорбата);
S
– площадь
поверхностного слоя; m
– масса
адсорбента.
–
количествоi-го
компонента в поверхностном слое
(адсорбата);
S
– площадь
поверхностного слоя; m
– масса
адсорбента.
Избыточная, или гиббсовская, адсорбция Гi – избыток i-го компонента в поверхностном слое по сравнению с его количеством в объеме фазы, приходящийся на единицу площади поверхности
 ,
моль/м2
,
моль/м2
Если концентрация адсорбируемого вещества на поверхности значительно превышает его концентрацию в объеме, можно принять, что Г = А.
Десорбця – процесс, обратный адсорбции (переход вещества из поверхностного слоя в объем фазы).
В зависимости от природы адсорбционных сил различают физическую и химическую (хемосорбцию) адсорбцию.
При физической адсорбции взаимодействие адсорбента и адсорбата осуществляется за счет сил Ван-дер-Ваальса и водородных связей, а при хемосорбции – за счет образования химических связей.
В зависимости от агрегатного состояния смежных фаз различают адсорбцию на границе жидкость-газ, жидкость-жидкость, твердое тело-жидкость, твердое тело-газ.
8. Адсорбция на границе жидкость-газ
Поверхностно-активные вещества
Вещества, которые при растворении снижают поверхностное натяжение растворителя, называются поверхностно-активными веществами (ПАВ). Вещества, не изменяющие поверхностное натяжение растворителя, – поверхностно-неактивные.
Изотерма поверхностного натяжения – графическая зависимость поверхностного натяжения от концентрации ПАВ при постоянной температуре (рис. 1). Изотерма поверхностного натяжения описывается уравнением Шишковского

 , (1)
, (1)
где 0, – поверхностное натяжение растворителя и раствора соответственно; В, К – константы (коэффициент В постоянен для гомологов).
Отличительный признак молекул ПАВ – дифильное строение, благодаря которому они обладают сродством как к полярным, так и к неполярным средам.
Молекула ПАВ включает два фрагмента:
1) гидрофильный (полярный), обладающий значительным дипольным моментом, например, группы –СООН, –ОН, –NH2, –CN, –SH, –COH, –NO и др.;
2) гидрофобный (неполярный), обладающий слабым молекулярно-силовым полем – это углеводородный радикал.
ПАВ относительно воды являются многие органические соединения – карбоновые кислоты, альдегиды, спирты, амины.
На рис. 2 представлено условное обозначение молекул ПАВ: «головка» – полярная часть молекулы ПАВ, «хвост» – неполярная.
При адсорбции полярные группы, обладающие большим сродством к воде (полярной фазе), втягиваются в нее, а неполярные распределяются в неполярной фазе (воздух, неполярная жидкость), образуя поверхностный слой.
При малых концентрациях ПАВ в растворе их молекулы произвольно ориентируются в поверхностной фазе (рис. 3, а). С увеличением концентрации поверхностный слой заполняется молекулами ПАВ, образующими мономолекулярный адсорбционный слой с плотнейшей упаковкой, соответствующей строгой пространственной ориентации молекул ПАВ (частокол Ленгмюра, рис. 3, б).


Предельная адсорбция достигается при насыщении поверхностного слоя молекулами ПАВ. При дальнейшем повышении концентрации ПАВ в растворе строение адсорбционного слоя, а также поверхностное натяжение раствора больше не изменяются.
Из
рис. 1 видно, что для ПАВ
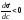 .
Значение производной
.
Значение производной непостоянно и зависит от концентрации
вещества. Чтобы придать этой величине
вид характеристической постоянной,
берут ее предельное значение (приc
0). Эту
величину П.А. Ребиндер назвал поверхностной
активностью
g
непостоянно и зависит от концентрации
вещества. Чтобы придать этой величине
вид характеристической постоянной,
берут ее предельное значение (приc
0). Эту
величину П.А. Ребиндер назвал поверхностной
активностью
g
 .
.
Поверхностная активность – количественная характеристика влияния ПАВ на поверхностное натяжение. Поверхностная активность – положительная величина, поэтому перед производной стоит знак "–".
Графически значение
g
может быть определено как тангенс угла
наклона касательной к изотерме
поверхностного натяжения в точке,
которая соответствует
чистого растворителя (рис. 4).

 .
.
Поверхностная активность зависит от природы растворенного вещества и растворителя. Для водных растворов поверхностная активность возрастает с уменьшением полярности молекул ПАВ. С увеличением в молекуле числа полярных групп поверхностная активность уменьшается.
Увеличение числа неполярных групп в молекуле ПАВ вызывает рост поверхностной активности. Экспериментально установлено, что в гомологическом ряду поверхностная активность возрастает в 3 – 3,5 раза при удлинении углеводородной цепи на одну группу –СН2 (правило Дюкло – Траубе)
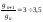 .
.
Более универсальный способ оценки поверхностной активности – вычисление гидрофильно-липофильного баланса (ГЛБ), отражающего сбалансированность гидрофильных и гидрофобных свойств молекул ПАВ
Данный метод разработал косметолог Гриффин. В соответствии с ним молекула ПАВ разбивается на группы, каждая группа имеет свое групповое число В, характеризующее степень взаимодействия ее с водой. Например, В группы –СООК составляет 21,1, –СООН – 2,1, –ОН – 1,9. Групповые числа гидрофобных (неполярных) групп отрицательны. В частности, В групп –СН3, =СН2, =СН– составляет –0,475. Значение ГЛБ определяют сложением групповых чисел Вi всех групп, составляющих молекулу ПАВ.
ГЛБ = 7 + Вi.
Чем ближе ГЛБ к 7, тем лучше сбалансировано действие полярной и неполярной групп. При ГЛБ > 7, у вещества более выражены гидрофильные свойства, а при ГЛБ < 7 – гидрофобные.
