
- •Энергетика
- •Кинетика
- •Открытая
- •Энтальпия (теплота) образования вещества fН298
- •Следствие из закона Гесса:
- •Влияние температуры на ΔrН:
- •С(графит) 0 8,54
- •Акрист Ааморф s 0
- •Зависимость ΔrS от температуры:
- •С(графит) 5,74 8,54
- •Энтальпийный и энтропийный факторы изобарно-изотермического процесса
- •Критерий самопроизвольного протекания процесса:
- •С(графит) 298 – 2300к
Акрист Ааморф s 0
S 0298(O)
= 161 Дж/(моль·К)
за счет усложнения
0298(O)
= 161 Дж/(моль·К)
за счет усложнения
S0298(O2) = 205 Дж/(моль·К) состава молекул
S0298(O3) = 238,8 Дж/(моль·К)
S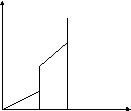 вещества
растет с ростом температуры и скачкообразно
увеличивается в точках фазовых
переходов
вещества
растет с ростом температуры и скачкообразно
увеличивается в точках фазовых
переходов
S
Тпл Ткип Т
S – функция состояния системы
2–ой
закон термодинамики: в
изолированных системах энтропия
самопроизвольно протекающего процесса
возрастает, т.е. S
0
● S (процессов) 0 – переход из более упорядоченного состояния в менее упорядоченное - самопроизвольное протекание процесса вероятно (расширение газов, плавление, растворение).
● S (процессов) 0 – самопроизвольное протекание маловероятно (сжатие газов, конденсация)
▼Стандартная энтропия – S0 (Дж/мольК)-
энтропия вещества, находящегося в стандартном состоянии
В справочниках - S0298 при 298,15 К
Существует абсолютное значение S.
Ст + СО2,г 2СОг ; S0 = 87 Дж/К 0 – за счет
увеличения объема системы;
3Н2,г + N2,г 2NH3,г ; S0 = -90 Дж/К 0 – за счет
уменьшения объема системы;
Alк + Sbк = AlSbк; S0 = -1,1 Дж/К 0 – объем системы практически не изменяется.
Изменение энтропии системы при теплообмене с окружающей средой: ΔS = Q/T
Изменение энтропии химической реакции - на основе следствия из закона Гесса:
ΔrS
= ∑νiSi
продуктов
- ∑νjSj
исх
веществ
Стандартная энтропия реакции при 298К:
(S0298,i – из таблиц)
ΔrS0298 = ∑νiS0298,iпродуктов - ∑νjS0298,jисх веществ
(если
в области
298 ÷Т
нет фазовых переходов)
Т 1)
∆rS0T
= ∆rS0298
+ 298 2)
∆rS0T
= ∆rS0298
+ ∆rС0рln 3)∆rS0T
= ∆rS0298
(при
условии ∆rС0p
= 0)
Зависимость ΔrS от температуры:
![]()
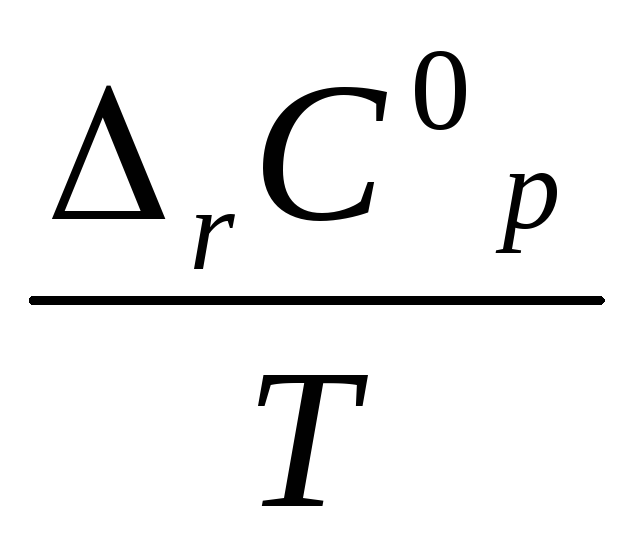 dT
dT
![]() (если не
учитывать зависимость Сp
веществ
от Т, ∆rС0р=
const)
(если не
учитывать зависимость Сp
веществ
от Т, ∆rС0р=
const)
►Задача. Рассчитать ∆rS0Т реакции:
С(к) + СО2(г) = 2СО(г)
при 298К и при 1000К, считая Сp(i) =const в рассматриваемом температурном интервале.
Решение.
Вещество S0298,Дж/(моль.K) С0р298,Дж/(моль.К)
С(графит) 5,74 8,54
СО2 (г) 213,68 37,41
СО (г) 197,54 29,14
ΔrS0298 =2S0298,СОг - S0298,Ск - S0298,СО2г =
= 2(197,54)–5,74–213,68=175,66 Дж/K.
∆rС0р= 2С0р298СОг–С0р298Ск–С0р298СО2г=
= 2.(29,14)–8,54–37,41 =12,33 Дж/К.
∆rS01000
=∆rS0298
+ ∆rС0рln![]() =
=
=175,66+12,33ln(1000/298)=175,66+14,93=190,59Дж/К
при T = 702К S 8,5%.

