
- •Строение молекул воды. Полярность химической связи. Ионизирующая способность воды.
- •Физические и химические свойства воды. Гидролиз соли.
- •Растворы. Растворимость газов, жидкостей и твёрдых веществ в жидкостях.
- •Электролитическая диссоциация. Константа диссоциации. Теория сильных электролитов.
- •Вычисление ph в растворах сильных и слабых кислот.
- •Вычисление рн в растворах сильных и слабых оснований.
- •Гидролиз солей. Вычисление рн в растворах солей, образованных сильным основанием и слабой кислотой.
- •Вычисление рн в растворах солей, образованных слабым основанием и сильной кислотой.
- •Произведение растворимости. Факторы влияющие на растворимость трудно растворимых электролитов.
- •Коллоидные растворы. Строение мицеллы. Устойчивость и коагуляция коллоидных растворов. Пептизация.
- •Понятие об электрокинетическом потенциале. Электрокинетические явления в коллоидных системах.
- •Характеристики состава природных вод. Классификация природных вод. Характеристики состава сточных вод. Классификация состава.
- •Физические показатели качества воды.
- •Химические показатели качества воды, характеризующие минеральные соли. Ионитовый метод обессоливания
- •Химические показатели качества воды- растворённые газы.
- •Углекислое равновесие в воде. Равновесная и агрессивная углекислота.
- •Стабильность воды.
- •Кислотность и щёлочность воды. Примеси, обуславливающие кислотность и щёлочность. Методы определения.
- •Химические показатели, характеризующие органические вещества.
- •Окисляемость и химическое потребление кислорода хпк.
- •Биохимическое потребление кислорода бпк.
- •Биогенные элементы в воде. Доочистка городских сточных вод от биогенов. Денитрификация.
- •Требования к качеству воды различного назначения.
- •Процесс удаления из воды грубодисперсных примесей.
- •Нейтрализация производственных сточных вод.
- •Метод осаждения примесей.
- •Методы стабилизации воды.
- •Жёсткость воды. Катионитовый метод умягчения воды.
- •Процесс удаления из воды коллоидно-дисперсных примесей 2 группа.
- •Коагулирование воды. Флокуляция.
- •Метод дегазации воды.
- •Метод дезодорации воды.
- •Метод удаления органических веществ 3 группа.
- •Физико-химические методы очистки сточных вод. Экстракция. Эвапорация. Адсорбация
- •Обессоливание воды.
- •Обеззараживание воды хлором.
- •Обеззараживание воды озоном и ионами тяжелых металлов. Безреагентные методы обеззараживания воды.
- •Аэробные процессы окисления в биологической очистке сточных вод.
- •Методы мембранной сепарации в очистке воды.
- •Методы удаления примесей 4 группа.
-
Коллоидные растворы. Строение мицеллы. Устойчивость и коагуляция коллоидных растворов. Пептизация.
Золи, коллоидные растворы — это ультрамикрогетерогенные дисперсные системы, размер частиц которых лежит в пределе от 1 до 100 нм (10-9—10-7м).
В зависимости от дисперсионной среды золи бывают твердыми, аэрозолями (газообразная дисперсионная среда) и лиозолями (жидкая дисперсионная среда). В зависимости от природы среды лиозоли называют гидрозолями (вода), органозолями (органическая среда) или, более конкретно, алкозолями (спирты), этерозолями (эфиры) и др. 3оли занимают промежуточное положение между истинными растворами и грубодисперсными системами (суспензиями, эмульсиями).
Свойства
большая удельная поверхность;
адсорбция и плёнкообразование на поверхностях раздела;
агрегация как следствие взаимодействия частиц;
частицы на поверхнoсти обладают большей энергией, чем частицы внутри фазы.
Мицеллы — частицы в коллоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекул растворителя. Например, мицелла сульфида мышьяка имеет строение:
{(As2S3)m•nHS-•(n-x)H+}x-•хН+
Средний размер мицелл от 10−5 до 10−7см.
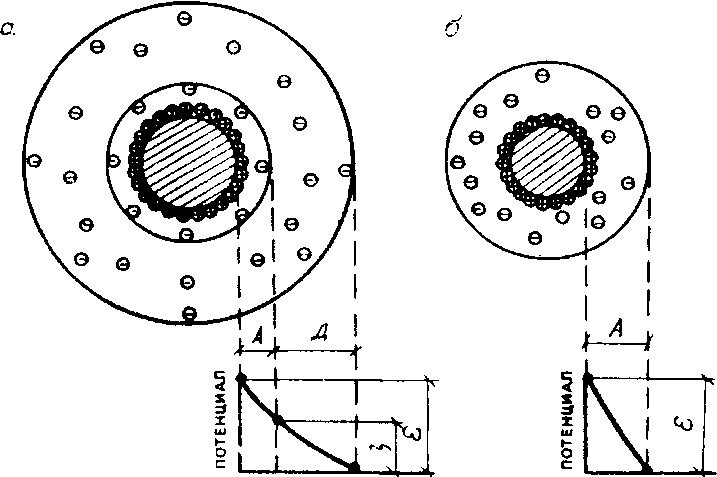
Строение мицеллы
а — § > 0; б — *г - 0 — изоэлектрическое состояние;
А — адсорбционный слой; Д — диффузионный слой;€-
термодинамический потенциал — электрокинетический
потенциал
Агрегативная устойчивость — способность системы
сохранять свою степень дисперсности. Устойчивость
коллоидных растворов связана с наличием одноименного
заряда у коллоидных частиц. Двигаясь, частицы сближаются,
при этом проявляются действие отталкивания одноименных
ядер частиц и действие притяжения за счет межмолекулярных
сил. В зависимости от того, какие силы преобладают, система
либо устойчива, либо частицы дисперсной фазы слипаются и
укрупняются.
Под воздействием различных факторов коллоидные растворы
способны разрушаться. Разрушение может сопровождаться
слипанием отдельных частиц с образованием крупных агрегатов.
Такой процесс разрушения коллоидного раствора называется
коагуляцией. Коагуляция нарушает агре-гативную
устойчивость коллоидного раствора, крупные агрегаты частиц
легкл седиментируют под действием гравитационных сил.
Причиной коагуляции могут быть самые разнообразные факторы:
изменение температуры и концентрации коллоидного раствора,
его старение, механические воздействия, введение в раствор
золей с противоположным знаком заряда, добавление
электролитов.
Пептизация — расщепление агрегатов, возникших при коагуляции дисперсных систем, на первичные частицы под действием жидкой среды (например, воды) или специальных веществ — пептизаторов. Пептизация — один из способов получения коллоидных растворов, применяется в технике при получении высокодисперсных суспензий глин и других веществ.
-
Понятие об электрокинетическом потенциале. Электрокинетические явления в коллоидных системах.
В коллоидном растворе частицы находятся в постоянном движении, поэтому
диффузный (очень размытый) слой В несколько отстает от частицы, и часть
ионов этого слоя отрывается. В результате наблюдается декомпенсация зарядов,
коллоидная частица становится отрицательно заряженной, а окружающий ее
раствор приобретает положительный заряд. Возникающий при этом потенциал
называется электрокинетическим потенциалом частицы (обозначается
$ -потенциал, читается — дзета-потенциал).
Если поместить золь в постоянное электрическое поле, то, как и в растворах электролитов, заряженные частицы будут двигаться к противоположно заряженным электродам: коллоидная частица с адсорбированными на ней противоионами – в одну сторону, противоионы диффузного слоя – в другую. Сила, с которой электрическое поле действует на частицы и, следовательно, скорость движения частиц, очевидно, будет пропорциональна ζ-потенциалу. Движение частиц дисперсной фазы в электрическом поле называется электрофорезом. Явление электрофореза можно наблюдать, поместив в U-образную трубку какой-либо окрашенный золь, поверх которого налит не смешивающийся с золем бесцветный электролит. Если опустить в электролит электроды и наложить разность потенциалов, то граница окрашенного золя в одном из колен трубки будет подниматься, в другом – опускаться. Если поместить в U-образную трубку пористую перегородку (например, мелкий кварцевый песок) и заполнить её водой, то при наложении разности потенциалов в одном колене будет наблюдаться подъем уровня жидкости, в другом – его опускание. Движение дисперсной среды в электрическом поле относительно неподвижной дисперсной фазы (в рассмотренном случае – относительно поверхности пористых тел) называется электроосмосом. Явления электрофореза и электроосмоса получили общее название электрокинетических явлений.
