2 Расположение электронов в атоме
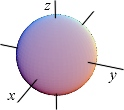
Атомные электроны с большой скоростью движутся в пространстве вокруг ядра. Нельзя точно сказать, в какой точке этого пространства находится электрон в данный момент времени. Можно говорить лишь о вероятности нахождения электрона на определенном расстоянии от ядра. Область пространства вблизи атомного ядра, в которой вероятность нахождения электрона является наибольшей, называется орбиталью (рис.1.2).
Последовательное описание распределения электронов вблизи атомного ядра возможно только в рамках квантовой механики (приложения 1 и 2).
В квантовой механике вероятность нахождения электрона на определенном расстоянии от ядра задается квадратом волновой функции, которая является решением основного уравнения квантовой механики – уравнения Шрёдингера. При этом оказывается, что эта вероятность, другими словами,состояние электрона в атоме описывается четырьмя квантовыми числами: главным квантовым числом n, орбитальным квантовым числом l, магнитным квантовым числом m и спиновым квантовым числом s.
Главное квантовое число n определяет размер электронного облака и характеризует величину энергии электрона.В атоме водорода (Z=1), например, или в водородоподобном ионе с зарядом ядра +Zeзначение энергии электрона определяется выражением:
![]() ,
(1.1)
,
(1.1)
где m – масса электрона,0– электрическая постоянная,– постоянная Планка.
|
|
|
|
|
а) |
б) | |
|
|
| |
|
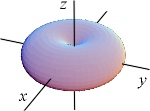
Рис. 1.2. Форма электронного облака атома (форма орбитали) определяется значениями орбитального квантового числа l и магнитного квантового числа m. На рисунке представлены: а) s-орбиталь (l=m=0); б) две p-орбитали (l = 1, m = 0 и l = 1, m = 1). Два токовых состояния m = 1 отличаются направлением вращения электрона вокруг оси z. | ||
|
| ||
|
| ||
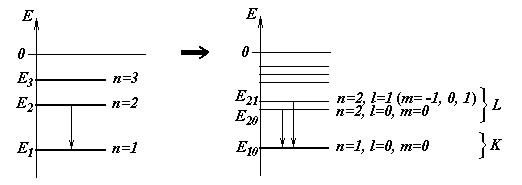
Главное квантовое число может принимать любое положительное целочисленное значение, большее или равное единице: n= 1, 2, 3, … Таким образом,энергия электрона в атоме может принимать только дискретный набор значений, каждое из которых отвечает определенномуэнергетическому уровнюатома.
Наименьшей энергией обладают электроны первого энергетического уровня (n = 1); они наиболее прочно связаны с ядром. Электроны последующих уровней характеризуются большим запасом энергии. Набор дискретных значений энергии атомных электронов называютэнергетическим спектроматома.
Орбитальное квантовое число l описывает форму (симметрию) орбиталей и характеризует величину орбитального момента импульса атомного электрона:
![]() .
(1.2)
.
(1.2)
Оно может принимать целочисленные значения от 0 до n–1:l= 0, 1, 2, …, (n–1).
Таким образом, орбитальный момент электронов в атоме, также как и их энергия, квантуется, то есть может принимать дискретный набор значений.
Обычно для обозначения состояний электронов, отвечающих различным значениям орбитального квантового числа, и соответствующих орбиталей применяют строчные буквы латинского алфавита: s(l=0),р(l=1),d(l=2),f(l=3) и т.д. (Формаs- ир- орбиталей приведена на рис.1.2.)Буквы s, p, d, f берут начало от наименования серий в спектрах щелочных металлов: s - sharp (резкая), p - principal (главная), d - diffuse (диффузная), f - fundamental (фундаментальная). Буквы, следующие за f, идут в алфавитном порядке.
Энергия электрона (1.1) в атоме водорода не зависит от значения орбитального квантового числа l. Иными словами, энергетический спектр электрона в атоме водорода вырожден по орбитальному квантовому числу. Однако это вырождение является случайным. Оно характерно только для кулоновского потенциала взаимодействия электрона с атомным ядром и носит название кулоновского вырождения. В случае многоэлектронных атомов или ионов благодаря дополнительному взаимодействию электронов друг с другом это вырождение снимается, поэтому электроны с различными орбитальными квантовыми числами (s-электроны,р-электроны и т. д.) обладают различной энергией: их энергия тем больше, чем больше значениеl,точнее, сумма (n+l).