
Лекция Получение ТМК
.pdf
Глава IV Гидратация олефиновых углеводородов
1 Теоретические основы процесса гидратации олефинов
2 Технологические основы процесса гидратации олефинов
1.1 Химизм процесса
Процессы гидратации непредельных углеводородов очень широко используются в промышленности органического синтеза для получения кислородсодержащих соединений. Этим методом из олефинов получают одноатомные спирты, в частности гидратацией этилена — этиловый спирт:
CH2  CH2 +H2O
CH2 +H2O  CH3 CH2OH
CH3 CH2OH
R CH CH2 + H2O
CH2 + H2O  R CH2 CH2OH
R CH2 CH2OH
R' |
C |
|
CH2 + H2O |
|
R' |
CH |
|
CH2OH |
R'' |
|
|
R'' |
|
||||
|
|
|||||||
|
|
|
|
|
|
|
Все олефины, за исключением этилена, при гидратации образуют вторичные или третичные спирты. Так как присоединение воды к олефинам всегда происходит по правилу Марковникова. Правило Марковникова находит объяснение с позиции электронной теории органических реакций. Вследствие того, что электроотрицательность углерода больше, чем водорода, углерод в метильной группе СН3 несет на себе некоторый отрицательный заряд. Это приводит к сдвигу σ-электронов связи Н3С – СН в направлении центрального атома углерода. Этот сдвиг в свою очередь влечет за собой гораздо большее смещение подвижных π-электронов двойной связи в направлении, указанной изогнутой стрелкой:
|
|
H |
|
|
|
|
|
|
|
|
|
CH |
|
CH2 |
|
|
|
|
|
|
|
||
H |
|
C |
|
|
|||
|
|||||||
|
|
|
|||||
|
|
|
|
||||
|
|
|
|
|
|||
|
|
H |
|||||
Таким образом, электронные сдвиги Н С, Н3С СН вызывают сильный сдвиг электронов двойной связи, т.е. поляризацию со сдвигом электронной плотности к атому углерода, не соединенному с алкильной группой:

CH3 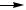 CH
CH  CH2
CH2
Протон присоединяется к тому ненасыщенному атому углерода, который несет частичный отрицательный заряд. Ясно, что им будет атом углерода, связанный с меньшим числом алкильных групп (более насыщенный водородом). Анионная часть реагента направляется к атому углерода с наименьшей электронной плотностью — к
наименее гидрогенизованному.
1.2 Термодинамика и кинетика процесса
Рассмотрим равновесие основной реакции: гидратации - внутримолекулярной дегидратации:
RCH |
|
CH2 + H2O |
|
RCH |
|
CH3 |
|
|
|||||
|
|
|
OH
Она протекает с выделением тепла (∆Н°298 = -46 кДж/моль), следовательно, ее равновесие смещается вправо при понижении температуры. Изменение энергии Гиббса при гидратации этилена, пропилена и изобутена в зависимости от температуры представлено графически на рис. 59. Видно, что равновесие невыгодно для гидратации олефинов, так как при 150—300°С,
Рис. 1 Температурная зависимость изменения энергии Гиббса для гидра тации этилена
(1 ) , про пилена (2 ) и изобутена (3 )
Рис. 2 Зависимость равновесной степени конверсии этилена в этанол от давления при разных температурах и. соотношении С 2 Н4:Н2О= = 1 : 1
когда катализаторы процесса достаточно активны, ∆G° имеет большую положительную величину и равновесие смещено в сторону дегидратации. При этом для олефинов разного строения различия в термодинамике рассматриваемых реакций незначительны.
Как показывает стехиометрия реакций, на их равновесие можно влиять,
изменяя давление. Гидратации олефинов благоприятствует высокое давление,
увеличивающее равновесную степень конверсии олефина. Так, последняя при 250-300
°С и атмосферном давлении составляет всего 0,1-0,2 %, что совершенно неприемлемо для практических целей, но при 7-8 МПа и тех же температурах она возрастает до 12-
20%. Зависимость равновесной степени конверсии этилена при его гидратации от давления и температуры изображена на рис. 60, причем аналогичные кривые
характерны и для других олефинов. Очевидно, что гидратации способствуют одновременное снижение температуры и повышение давления.
Следует отметить, что при приближении к равновесию скорость гидратации и селективность падают, что делает невыгодным проведение реакции до степеней конверсии, близких к равновесным.
Скорость реакции зависит от строения олефина и длины его углеродной цепи. С
наибольшей скоростью протекает гидратация олефинов разветвленного строения. Чем короче углеродная цепь олефина, тем труднее присоединяется к нему вода; наиболее трудно гидратируется этилен. Олефины по изменению реакционной способности можно расположить в следующий ряд, который объясняется электрофильным механизмом гидратации, определяемым сравнительной стабильностью промежуточных карбокатионов:
CH3 C CH2 >> CH3 CH2 CH
CH2 >> CH3 CH2 CH CH2 >> CH3 CH
CH2 >> CH3 CH CH2 >> CH2
CH2 >> CH2  CH2
CH2
CH3
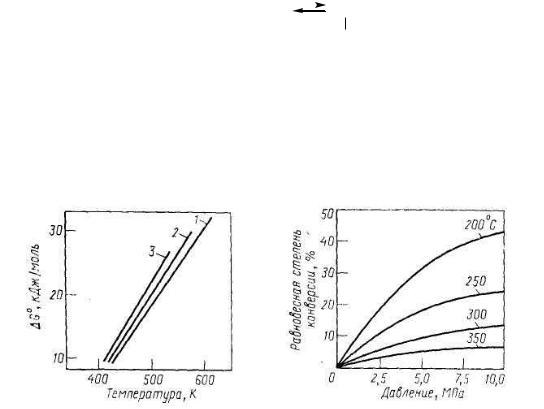
Данные о зависимости константы равновесия реакций гидратации некоторых олефинов от температуры и о тепловом эффекте реакций приведены в таблице.
Графически зависимость константы равновесия от температуры показана на рис.
108.
.
Рис. 108. Влияние температуры на константы равновесия реакций гидратации некоторых
олефинов: 1 – гидратация этилена, 2 – гидратация пропилена, 3 – гидратация н-бутилена.

1.3 Катализаторы, механизм процесса
Все рассматриваемые реакции принадлежат к числу кислотно-каталитических
процессов.
Катализаторами гидратации олефинов могут служить растворы серной или фосфорной кислот. Это был первый метод гидратации спиртов, называемый сернокислотным. Процесс является жидкофазным. Имеет следующие недостатки:
многостадийность процесса, образование моно- и диалкилсульфатов, коррозия
аппаратуры, необходимость утилизации отработанной серной кислоты.
Отмеченные недостатки сернокислотной гидратации олефинов привели к разработке методов прямой гидратации олефинов в присутствии гетерогенных
кислотных катализаторов.
Твердыми катализаторами гидратации являются фосфорная кислота на носителе
(алюмосиликат, силикагель, пемза), катализаторы на основе оксидов металлов (Al2O3, W2O3 и др.) и ионообменные смолы (сульфокатиониты).
При прочих равных условиях в присутствии твердых катализаторов процесс протекает значительно медленнее, чем в присутствии жидких, но зато значительно уменьшается или даже исключается коррозия. Снижение скорости можно компенсировать повышением температуры, но в этом случае снижается выход спирта и
повышается выход побочных продуктов (эфиров, полимеров).
Роль катализаторов при гидратации состоит в протонировании олефина и
образовании промежуточного карбокатиона:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
OH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ OH |
|
|
|
|
|
|||||||||
|
|
|
|
|
+ |
|
|
+ H2O |
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
CH2 + H+ |
|
CH3 |
|
|
|
|
|
R |
|
CH |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
R |
|
CH |
|
|
|
|
R |
|
CH |
|
|
|
|
|
R |
|
CH |
|
CH3 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
- H+ |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Образование карбониевого иона (карбокатиона) II является стадией,
лимитирующей скорость реакции. Его возникновению предшествует быстро и обратимо протекающий процесс образования π-комплекса I, медленно превращающегося в II:
|
|
|
|
CH2 + H+ |
|
|
|
|
|
|
|
|
|
+ |
|
CH3 |
|||||
R |
|
CH |
|
|
|
|
R |
|
CH |
|
|
CH2 |
|
|
|
R |
|
CH |
|
||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
H+ |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
II |
|
||||

1.4 Побочные процессы
При гидратации олефинов наряду с основной реакцией протекают олигомеризация олефина (получение низкомолекулярных полимеров) и образование простого эфира. Все они идут через промежуточную стадию карбокатиона.
Простые эфиры образуются за счет взаимодействия ионов карбония с образовавшимся спиртом:
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
+ |
|
|
|
CH + R |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
|
|
|
O + |
H+ |
|||||||||
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
R |
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
R |
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
CH (R) |
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
||
|
|
|
|
Олигомеры олефинов образуются при взаимодействия иона карбония с |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
олефином: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
+ |
|
|
CH3 + R |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
CH |
|
|
CH |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||||||||
R |
|
CH |
|
|
CH |
|
CH2 |
|
|
|
R |
|
CH |
|
|
|
|
|
- H+ R CH |
|
CH |
|
|
|
|
CH |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
R R
Выход олигомеров зависит от способности олефинов к полимеризации (изобутен
> пропилен > этилен). Образование олигомеров можно снизить, не только изменяя соотношение воды и олефина, но и уменьшая температуру, так как олигомеризация имеет более высокую энергию активации по сравнению с гидратацией. Следует отметить, что при приближении к равновесию скорость гидратации и селективность падают, что делает невыгодным проведение реакции до степеней конверсии, близких к равновесным. При этом для каждого олефина и катализатора имеется некоторый оптимум соотношения реагентов, степени конверсии и температуры, зависящий от производительности и селективности процесса.
2 Технологические основы процесса гидратации олефинов
В настоящее время в промышленном масштабе изобутилен получают в основном дегидрированием изобутана и выделением из фракций С4 нефтепереработки и пиролиза нефтепродуктов. При производстве изобутилена возникает необходимость в выделении изобутилена из фракции С4. Процесс селективной гидратации-дегидратации нашел применение для выделения изобутилена из фракции С4.
Метод извлечения изобутилена основан на различных реакционных способностях н-бутилена и изобутилена в реакциях гидратации.
Изобутилен способен вступать в реакцию с водой c образованием трет-бутилового
спирта (триметилкарбинола). Процесс состоит из двух основных стадий: 1) гидратация изобутилена в триметилкарбинол
СН3
СН3
С СН2 + Н2O  СН3 С OH
СН3 С OH
СН3
СН3
2) дегидратация триметилкарбинола в изобутилен
|
СН3 |
|
|
|
|
|||||
СН3 |
|
|
|
|
|
|
СН3 |
|
|
|
|
С |
|
OH |
|
С |
|
СН2 + Н2O |
|||
|
|
|
СН3 |
|
||||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|
|
|
||||||
|
|
|
|
|
||||||
Для извлечения изобутилена |
используется сульфакатионит КУ-2ФПП |
|||||||||
(сульфированный сополимер стирола с дивинилбензолом и формованным полипропиленом).
Гидратация изобутилена идет по карбоний-ионному механизму. Изобутилен,
присоединяя подвижный ион сульфокатионита RSO3Н, образует карбониевый ион:
СН3 – С = СН2 + RSО3Н |
СН3 |
|
С+ |
|
СН3 + RSO-3 |
|
||||||||||||
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|
|
СН3 |
|
|
|
|
|
|
|
|
|||||||
|
Реакционоспособный |
карбониевый |
ион |
активно |
взаимодействует с водой, |
|||||||||||||
причем образуется трет-бутиловый спирт, |
а |
катализатор |
возвращается в свою |
|||||||||||||||
первоначальную форму: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОН |
|
|||
|
|
С+ |
|
СН3 + RSO-3) + Н+ОН- |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
(СН3 |
|
|
СН3 |
|
С |
|
СН3 + RSО3Н |
|||||||||||
|
|
|
||||||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|
|
|
|
|
|
|
|
СН3 |
|
||||||
В процессе гидратации изобутилена в присутствии сульфокатионита в небольшом количестве образуются побочные продукты: димеры изобутилена, эфиры, вторичный бутиловый спирт.
Образование димеров можно сократить, увеличивая соотношение водной фазы и углеводородов, а также уменьшая температуру реакции:

|
|
|
|
|
|
|
|
|
СН3 |
||||
|
СН3 |
|
СН3 |
|
|
||||||||
|
|
|
|||||||||||
2 |
С |
|
СН2 |
|
С |
|
СН |
|
С |
|
СН3 |
||
|
|
|
|
|
|||||||||
|
СН3 |
|
СН3 |
|
|
||||||||
|
|
|
|||||||||||
СН3
Объемное соотношение воды и изобутиленсодержащей фракции 7:1.
Процесс гидратации бутилен-изобутиленовой фракции проводится в жидкой фазе при температуре 80-95 °С и давлении 1,75 - 2,0 МПа (17,5 - 20 кгс/см2). Выбор температуры и давления процесса обусловлен тем, что при более высоких температурах протекает процесс гидратации бутиленов с образованием вторичного бутилового спирта.
Высокая температура также приводит к спеканию катализатора.
Также на срок службы катализатора влияет чистота сырья и воды. Наличие в них солей органических кислот, карбонильных и азотистых соединений, ионов металлов
(Fe,Na и др.) приводит к «отравлению» катализатора.
Конверсия изобутилена достигает 99 %, селективность по изобутилену в процессе гидратации составляет до 98 %.
Описание технологической схемы производства
Процесс гидратации изобутилена в ТМК производится в двух последовательно
работающих системах. Первая система состоит из двух, а вторая из трех
последовательно расположенных гидрататоров.
Гидратация изобутилена из изобутилен содержащей фракции С4 проводится в прямоточном экстракционно-реакционном режиме (по первой системе), где экстрагентом является циркулирующий раствор ТМК, процесс проводится на макропористом сульфокатионите.
По второй системе процесс проводится в противоточном экстракционно-
реакционном режиме, где экстрагентом является паровой конденсат, который из углеводородов С4 экстрагирует ТМК, образовавшийся в результате присоединения воды к изобутилену на макропористом сульфокатионите при движении воды против
потока углеводородов через батарею реакторов.
БИФ, нагретая до 80 0С, подается в гидрататор Р-11, также подается паровой конденсат и рециркулирующий раствор ТМК.
После каждого слоя катализатора реакционная масса охлаждается в выносных холодильниках до 80 0С промышленной водой. Реакционная масса после гидрататоров Р-1 поступает на дегазацию в колонну Кт-1, где при давлении в 0,5
МПа и температуре 110-1150С происходит отгон растворенных углеводородов из раствора ТМК. Из куба колонны Кт-1 раствор ТМК отправляется на концентрирование.
С верха колонны Кт-1, отогнанные углеводороды, содержащие в основном изобутилен и бутилены конденсируются, после чего подаются на гидратацию в батарею гидрататоров Р-2.
Процесс гидратации по второй системе проводится в гидрататорах Р -2 на вышеуказанном катализаторе при температуре 80-900С и давлении1,75 – 2,0 МПа.
Циркулирующий конденсат поступает в верхнюю часть гидрататора Р -21, затем проходит гидрататоры Р-22, Р-23 и выходя из нижней части гидрататора Р-23 в виде слабого водного раствора ТМК поступает на питание колонны Кт-2.
Углеводороды, содержащие изобутилен, после гидрататоров первой системы подаются в нижнюю часть гидрататора Р-23 и, пройдя слой катализатора, выходят с верху гидрататора, после чего насосом Н-41 подаются в нижнюю часть Р-22 . Пройдя слой катализатора из верхней части этого гидрататора насосом Н-42 подаются в нижнюю часть гидрататора Р-21. Пройдя слой катализатора отработанная БИФ из верхней части гидрататора Р-21 отводится на переработку.
Слабый водный раствор ТМК из нижней части гидрататора Р -23 проходит теплообменник Т-8, где нагревается за счет тепла кубового продукта колонны Кт - 2,
и поступает в эту колонну для концентрирования ТМК.
Циркулирующий конденсат из куба колонны Кт-2 поступает на гидратацию.
Отгоняемые с верха колонны Кт-2 пары азеотропа ТМК подается в колонну Кт-3
на дегазацию от растворенных углеводородов.
Из куба колонны Кт-3 азеотроп ТМК выводится в сборник Е-6 для последующей подачи его на дегидратацию.
