
- •Новосибирский государственный технический университет
- •Оглавление
- •2. Порядок выполнения работы
- •Оборудование, приборы, инструмент, оснастка, материалы
- •Состав применяемых травителей
- •Контрольные вопросы
- •Литература
- •2. Кинетика высокотемпературного окисления кремния
- •3. Технология термического окисления кремния
- •4. Порядок выполнения работы
- •Оборудование, приборы, инструменты
- •Материалы
- •Определение толщины пленок методом цветовых оттенков
- •Контрольные вопросы
- •Литература
- •Метод вакуумного напыления
- •1. Метод термического нанесения пленок в вакууме
- •2. Контроль параметров пленок и технологических режимов их нанесения
- •2.1. Измерение толщины пленок
- •2.2. Измерение адгезии пленок
- •2.3. Измерение скорости нанесения пленок
- •3. Порядок выполнения работы
- •Примерная последовательность операций при напылении
- •Оборудование, приборы, инструменты, материалы
- •Контрольные вопросы
- •Литература
- •2. Основные свойства фоторезистов
- •3. Фотошаблоны
- •4. Схема технологического процесса фотолитографии
- •5. Методы получения элементов с помощью процесса фотолитографии
- •6. Виды брака при фотолитографии
- •Порядок выполнения работы
- •Операцию выполнять в резиновых перчатках в вытяжном шкафу при включенной вытяжной вентиляции.
- •Операцию выполнять в вытяжном шкафу при включенной вытяжной вентиляции.
- •7. Содержание отчета
- •Оборудование, приборы, инструмент, оснастка, материалы
- •Литература
Министерство образования и науки Российской Федерации
Новосибирский государственный технический университет
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
621.38 № 3269
п 845
ПРОЦЕССЫ МИКРО- И НАНОТЕХНОЛОГИИ
Методическое руководство
к лабораторным работам для студентов III курса РЭФ
(направление 210100) заочной и дневной форм обучения
Новосибирск
2006
УДК 621.382.017.7(076.5)
П 845
Составитель: канд. техн. наук В.А. Илюшин
Рецензент: канд. физ.- мат. наук, доц. Е.А. Макаров
Работа подготовлена на кафедре полупроводниковых приборов
и микроэлектроники
Новосибирский государственный
технический университет, 2006
Оглавление
Лабораторная работа № 1. Химическое травление
пластин кремния 4
Лабораторная работа № 2. Термическое окисление
кремниевых пластин в сухом и влажном
кислороде 14
Лабораторная работа № 3. Метод вакуумного напыления 27
Лабораторная работа № 4. Фотолитография в производстве
полупроводниковых приборов В ИНТЕГРАЛЬ-
ных схем 39
Лабораторная работа №1
Химическое травление
пластин кремния
Цель работы – практическое освоение технологических приемов химического травления и контроля качества поверхности пластин кремния.
1. Химическое травление полупроводниковых
материалов
Большинство процессов или реакций, используемых для получения или обработки полупроводниковых материалов, являются гетерогенными, т. е. протекают на границе раздела двух различных фаз. Условия равновесия определяются законом действующих масс: в равновесном состоянии отношение произведений концентраций начальных веществ к произведению концентраций конечных веществ – постоянная величина. Однако при проведении гетерогенных процессов достижение состояния равновесия часто менее существенно, чем возможность управления кинетикой процессов, которая определяет производительность процесса и качество получаемого материала.
Гетерогенные процессы многостадийны. Например, в случае взаимо-действия полупроводникового материала с любым травителем должны наблюдаться следующие стадии:
1) доставка компонентов травителя к поверхности полупроводника;
2) адсорбция компонентов травителя поверхностью;
3) поверхностная диффузия адсорбированных компонентов и химические реакции;
4) десорбция продуктов реакции;
5) удаление десорбированных продуктов от поверхности.
При последовательно протекающих стадиях общая скорость обычно лимитируется скоростью самой медленно протекающей стадии. Если в какой-либо из последовательно протекающих стадий имеет место ряд параллельных процессов, то скорость этой стадии будет определяться наиболее быстрым из них. Для ускорения процесса в целом необходимо выявить лимитирующую стадию и найти способ ее интенсификации. При этом произойдет смена лимитирующей стадии.
Таким образом, в гетерогенных системах реакции протекают на границе раздела фаз и процесс в целом состоит не менее чем из трех этапов. Кинетика реакции может быть относительно простой, если максимальная скорость одного из приведенных этапов значительно меньше скорости любого другого. При таком допущении можно разделить гетерогенные процессы на два основных класса: на процессы, протекающие в диффузионном режиме, и на процессы, протекающие в кинетическом режиме. Лимитирующая стадия оказывает влияние не только на кинетику процесса травления, но и на окончательный результат. Так, если лимитирующими являются поверхностные процессы, то заметно влияние ориентации поверхности подложки и ее морфологии.
Жидкостное травление полупроводников может рассматриваться как процесс окисления поверхности полупроводника с образованием растворимых в травителе продуктов окисления. Например, при травлении германия перекисью водорода по реакции
 (1)
(1)
возникающая двуокись германия растворяется в воде с образованием метагерманиевой кислоты:
 (2)
(2)
Результирующая реакция окисления германия с образованием жидкофазных продуктов записывается в виде
 (3)
(3)
В
тех случаях, когда образующийся окисел
нерастворим в воде, например
в случае
 ,
появлющегося при травлении кремния в
азотной кислоте, в состав травителя
наряду с окислителем вводят также
растворитель окисла, например
фтористоводородную кислоту. Она
раст-воряет
,
появлющегося при травлении кремния в
азотной кислоте, в состав травителя
наряду с окислителем вводят также
растворитель окисла, например
фтористоводородную кислоту. Она
раст-воряет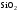 с образованием жидкофазного соединения
с образованием жидкофазного соединения
 .
(4)
.
(4)
В
результате атомы кремния переходят в
водный раствор в форме устойчивых
комплексных ионов
 ,
возникающих за счет гидролитической
диссоциации соединения по реакции
,
возникающих за счет гидролитической
диссоциации соединения по реакции .
В этот травитель часто вводят в
качестве разбавителя уксусную кислоту.
Она замедляет процесс травления, что
облегчает контроль процесса и обеспечивает
бóльшую однородность.
.
В этот травитель часто вводят в
качестве разбавителя уксусную кислоту.
Она замедляет процесс травления, что
облегчает контроль процесса и обеспечивает
бóльшую однородность.
Для выяснения общих закономерностей кинетики жидкостного травления запишем химическую реакцию (3) в обобщенном виде:
 (5)
(5)
Реакция приведена к одному молю жидкого травителя Х. Схематически процесс травления показан на рис. 1.

Рис. 1. Распределение в жидкой фазе концентраций
травящего компонента Х и одного из продуктов (А)
химической реакции при травлении твердого вещества s
Будем считать, что процесс травления проходит в три последовательные стадии:
– подвод
химического травителя
 к поверхности
к поверхности (диффузионный поток
(диффузионный поток );
);
– гетерогенная
химическая реакция на поверхности
 (химические потоки
(химические потоки


 для всех участников реакцииS,
X,
A,
B,...);
для всех участников реакцииS,
X,
A,
B,...);
– отвод
продуктов реакции

 ...
от поверхности
...
от поверхности (диффузионные потоки
(диффузионные потоки ,
, ,
...).
,
...).
Относительно быстрые сорбционные процессы на поверхности (адсорбция, поверхностная миграция, десорбция) включены во вторую стадию.
Для каждого жидкофазного участника реакции плотность диффузионного потока может быть представлена в виде
 (6)
(6)
где
 – коэффициент массопереносаi-го
компонента в жидкой фазе;
– коэффициент массопереносаi-го
компонента в жидкой фазе;
 –коэффициент
диффузии;
–коэффициент
диффузии;
 –толщина
диффузионного слоя.
–толщина
диффузионного слоя.
В стационарном режиме травления диффузионный поток должен быть равен химическому потоку для каждого компонента, тогда

 (7)
(7)

Условие стехиометрии для реакции травления устанавливает следующее соотношение между химическими потоками:
 (8)
(8)
В соответствии с основным законом химической кинетики
 (9)
(9)
где
 – константа скорости травления.
– константа скорости травления.
Подстановкой
(9) в первое уравнение (7) получаем
концентрацию травителя
 на реакционной поверхности
на реакционной поверхности :
:
 (10)
(10)
Формулы
(8)–(10) дают окончательное выражение
для плотности потока травления твердого
вещества
 :
:
 (11)
(11)
где
введена эффективная константа травления
 ,
такая что
,
такая что
 (12)
(12)
Чтобы
найти скорость травления, определяемую
как
 (мкм/мин), используем соотношение
(мкм/мин), используем соотношение
 (13)
(13)
где
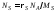 – число молекул в единице объема твердого
вещества
– число молекул в единице объема твердого
вещества .
.
 (14)
(14)
Воспользовавшись аналогией с электрическими цепями, выражение (11) можно представить в виде
 (15)
(15)
Подобно
электрическому току, протекающему через
сопротивление под действием электродвижущей
силы, поток
 создается заданной концентрацией
травителя
создается заданной концентрацией
травителя в объеме жидкой фазы, которая играет
роль «движущей силы» процесса травления.
Система оказывает сопротивление
протеканию потока
в объеме жидкой фазы, которая играет
роль «движущей силы» процесса травления.
Система оказывает сопротивление
протеканию потока ,
складывающееся из диффузионного
,
складывающееся из диффузионного и химического
и химического сопротивлении. В зависимости от
соотношения между этими сопротивлениями
различают диффузионную и кинетическую
области процесса травления.
сопротивлении. В зависимости от
соотношения между этими сопротивлениями
различают диффузионную и кинетическую
области процесса травления.
Диффузионная
область травления
реализуется при
 или
или В
этом случае из двух последовательных
стадий процесса –
диффузионного массопереноса и собственно
химической реакции – наиболее медленной
(лимитирующей) стадией является диффузия.
Именно она управляет процессом травления
в целом, при этом
В
этом случае из двух последовательных
стадий процесса –
диффузионного массопереноса и собственно
химической реакции – наиболее медленной
(лимитирующей) стадией является диффузия.
Именно она управляет процессом травления
в целом, при этом
 и
и .
Скорость травления ограничивается
скоростью диффузионной доставки молекул
травителя
.
Скорость травления ограничивается
скоростью диффузионной доставки молекул
травителя к реакционной поверхности
к реакционной поверхности .
Поскольку диффузионная константа
.
Поскольку диффузионная константа для жидкой фазы является изотропной,
все кристаллографические грани кристалла
и дефекты травятся с одинаковой скоростью,
что обеспечивает достаточно гладкую
зеркально полированную поверхность
пластины. Иными словами, в диффузионной
области реализуется режим полирующего
травления. Увеличение полирующих свойств
травителя может быть достигнуто за счет
усиления неравенства
для жидкой фазы является изотропной,
все кристаллографические грани кристалла
и дефекты травятся с одинаковой скоростью,
что обеспечивает достаточно гладкую
зеркально полированную поверхность
пластины. Иными словами, в диффузионной
области реализуется режим полирующего
травления. Увеличение полирующих свойств
травителя может быть достигнуто за счет
усиления неравенства .
Следовательно, введение вязких добавок
в травящий раствор и понижение температуры
должны улучшать полирующее действие
травителя за счет снижения коэффициента
диффузии
.
Следовательно, введение вязких добавок
в травящий раствор и понижение температуры
должны улучшать полирующее действие
травителя за счет снижения коэффициента
диффузии ,
в то время как интенсивное перемешивание
раствора может оказать обратное действие
в результате уменьшения эффективной
толщины диффузионного слоя
,
в то время как интенсивное перемешивание
раствора может оказать обратное действие
в результате уменьшения эффективной
толщины диффузионного слоя .
.
Кинетическая
область травления
реализуется при
 или
или .
В этом случае из двух стадий процесса
наиболее медленной (лимитирующей)
стадией является собственно химическая
реакция, при этом
.
В этом случае из двух стадий процесса
наиболее медленной (лимитирующей)
стадией является собственно химическая
реакция, при этом и
и .
Процесс травления протекает в кинетической
области, так как его скорость ограничивается
скоростью химической реакции, а быстрая
диффузионная доставка молекул травителя
.
Процесс травления протекает в кинетической
области, так как его скорость ограничивается
скоростью химической реакции, а быстрая
диффузионная доставка молекул травителя обеспечивает практически постоянную
их концентрацию на поверхности
обеспечивает практически постоянную
их концентрацию на поверхности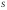 ,
равную
,
равную .
Так как константа травления
.
Так как константа травления чувствительна к дефектности поверхности
и имеет различные значения для разных
граней кристалла, для кинетической
области протекания процесса характерно
селективное и анизотропное травление.
чувствительна к дефектности поверхности
и имеет различные значения для разных
граней кристалла, для кинетической
области протекания процесса характерно
селективное и анизотропное травление.
Селективность
травления проявляется в преимущественном
вытравливании дефектных мест на
поверхности в форме ямок травления
(например, в районе выходов дислокаций).
Здесь активационный барьер для константы
 понижен, что увеличивает локальную
скорость травления. Анизотропность
травления связана с различной скоростью
травления разных кристаллографических
граней, характеризуемых различными
индексами Миллера. Обычно (например,
для Si и GaAs) выполняются неравенства
понижен, что увеличивает локальную
скорость травления. Анизотропность
травления связана с различной скоростью
травления разных кристаллографических
граней, характеризуемых различными
индексами Миллера. Обычно (например,
для Si и GaAs) выполняются неравенства .
В результате этого даже на бездефектных
поверхностях, ориентированных по
плоскостям {100} или {111}, при локальном
травлении через специальные окна в
защитной маске можно получить
профилированные углубления, ограниченные
плоскостями, характеризующимися малыми
скоростями травления.
.
В результате этого даже на бездефектных
поверхностях, ориентированных по
плоскостям {100} или {111}, при локальном
травлении через специальные окна в
защитной маске можно получить
профилированные углубления, ограниченные
плоскостями, характеризующимися малыми
скоростями травления.
