
Энтальпия
.docФедеральное агентство по образованию
Нижегородский государственный университет
им. Н.И.Лобачевского
Химический факультет
Кафедра неорганической химии
Определение энтальпий химических реакций и теплоёмкости веществ
Отчёт по лабораторной работе
Преподаватель:
Р.М.Шапошников
Студенты группы 211 (II):
Т. Г. Огурцов,
О. А. Шилягина
Нижний Новгород, 2008
Задания лабораторной работы:
-
Определение энтальпии реакции нейтрализации.
Определение энтальпии реакции нейтрализации
Цель работы: определить энтальпии реакции нейтрализации щёлочи с различными кислотами.
Оборудование и реактивы: калориметр, стеклянные стаканы, бюретка, пипетки, резиновая груша, термометр, секундомер, раствор щёлочи NaOH 0.1 Н, 0.2 Н, индикатор фенолфталеин, дистиллированная вода, растворы соляной кислоты (HCl) 2Н., уксусной кислоты (CH3COOH) 0.4H, щавелевой кислоты (C2H2O4), лимонной кислоты (C6H8O7), концентрированной азотной кислоты (HNO3) неизвестных концентраций.
Теоретическая часть:
Энтальпия характеризует состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня с грузом Р = pS, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной. Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV; H = E = U + pV
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния ΔH = H2 − H1
Изменение энтальпии не зависит от пути процесса, так как изменение объёма при постоянном давлении определяется только начальным и конечным состоянием системы.
Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра равно нулю, а отсюда ΔU = 0 и ΔH = 0.
В основе термохимических расчетов лежит закон Гесса. Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учетом коэффициентов в уравнении реакции.
Закон Гесса может быть записан в виде следующего математического выражения:
.
![]()
С помощью этого закона можно рассчитать энтальпии образования веществ, которые невозможно измерить.
Измерение тепловых эффектов производится в калориметрах различных конструкций. Калориметром называют прибор, служащий для измерения тепловых эффектов различных физико-химических процессов, а так Рис. 1
же для измерения теплоемкостей. Простейший калориметр (рис. 1) состоит из сосуда, изготовленного из материала, не проводящего тепло, в который помещается исследуемое вещество и защитной оболочки, уменьшающей тепловое взаимодействие калориметра и исследуемого вещества с окружающей средой.
Для
определения концентрации растворов
применяют титрование. Титрование
представляет собой лабораторный приём
при определении неизвестной концентрации
раствора одного из реагирующих веществ
по известной концентрации раствора
другого реагирующего вещества путём
измерения объёмов вступающих в реакцию
растворов этих веществ. Объёмы
взаимодействующих растворов обратно
пропорциональны их нормальностям -
основное уравнение титриметрического
анализа
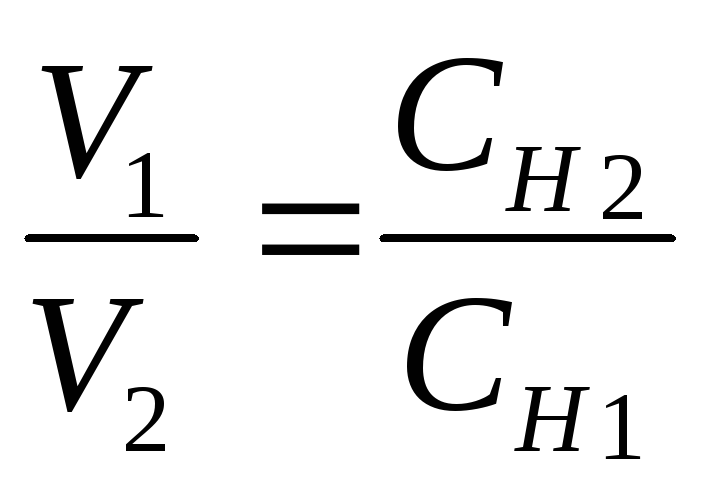 .
.
Практическая часть:
-
По принятой технологии титрования были определены концентрации щавелевой, лимонной и концентрированной азотной кислот.
Щавелевая кислота: 0,5Н;
Лимонная кислота: 0,5Н;
Азотная кислота: 1,35Н.
-
В калориметрический стакан налили 10 мл. гидроксида натрия и в течении 5 минут при перемешивании регистрировали изменение температуры;
-
Затем прилили 1 мл. соляной кислоты и так же при перемешивании наблюдали дальнейшее изменение температуры до тех пор, пока раствор не начинал остывать.
-
Такой опыт повторили с участием такого же количества гидроксида натрия и 5 мл. уксусной кислоты, 4 мл. лимонной кислоты, 4 мл. щавелевой кислоты, 1,5 мл. азотной кислоты;
N aOH
+ HCl
NaCl
+ H2O
– 1 опыт;
aOH
+ HCl
NaCl
+ H2O
– 1 опыт;
N aOH
+ CH3COOH
CH3COONa
+ H2O
– 2 опыт;
aOH
+ CH3COOH
CH3COONa
+ H2O
– 2 опыт;
Na Na![]()
![]()
3 Na
![]()
![]()
2 Na Na
N aOH
+ HNO3
NaNO3
+ H2O
– 5 опыт.
aOH
+ HNO3
NaNO3
+ H2O
– 5 опыт.
-
Результаты занесём в таблицу: Таблица 1
|
Время, cек |
tºС, NaOH (10 мл.) |
tºС, NaOH (10 мл.) |
tºС, NaOH (10 мл.) |
tºС, NaOH (10 мл.) |
tºС, NaOH (10 мл.) |
|
0 |
23,2 |
23,8 |
23,4 |
22,5 |
23,1 |
|
30 |
23,3 |
23,8 |
23,55 |
23,1 |
23,15 |
|
60 |
23,4 |
23,9 |
23,6 |
23,2 |
23,35 |
|
90 |
23,5 |
23,9 |
23,7 |
23,3 |
23,6 |
|
120 |
23,6 |
24,05 |
23,9 |
23,4 |
23,8 |
|
150 |
23,7 |
24,2 |
24 |
23,6 |
24 |
|
180 |
23,8 |
24,35 |
24,1 |
23,8 |
24,2 |
|
210 |
23,85 |
24,5 |
24,2 |
23,9 |
24,4 |
|
240 |
23,9 |
24,6 |
24,3 |
24,05 |
24,55 |
|
270 |
24 |
24,7 |
24,35 |
24,15 |
24,6 |
|
300 |
24,1 |
24,7 |
24,4 |
24,3 |
24,7 |
|
|
+соляная кислота (1 мл.) |
+уксусная кислота (5 мл.) |
+лимонная кислота (4 мл.) |
+щавелевая кислота (4 мл.) |
+азотная кислота (1,5 мл.) |
|
10 |
24,1 |
25,1 |
25,2 |
24,7 |
25,2 |
|
20 |
24,5 |
25,2 |
25,3 |
24,9 |
25,6 |
|
30 |
24,9 |
25,25 |
25,4 |
25,3 |
25,7 |
|
40 |
25 |
25,3 |
25,6 |
25,6 |
25,8 |
|
50 |
25 |
25,4 |
25,6 |
25,7 |
25,85 |
|
60 |
25,1 |
25,5 |
25,6 |
25,8 |
25,9 |
|
90 |
25,15 |
25,55 |
25,6 |
25,9 |
25,9 |
|
120 |
25,2 |
25,65 |
25,6 |
25,9 |
26 |
|
150 |
25,25 |
25,7 |
25,6 |
25,9 |
26,1 |
|
180 |
25,25 |
25,8 |
25,6 |
26 |
26,1 |
|
210 |
25,3 |
25,8 |
25,6 |
26 |
26,1 |
|
240 |
25,3 |
25,9 |
25,6 |
26,1 |
26,1 |
Энтальпия
реакции нейтрализации (![]() )
рассчитывается из уравнения:
)
рассчитывается из уравнения:
![]()
Построим графики зависимости увеличения температуры от времени:
-
Для первого опыта (рис. 2)

р ис.2
ис.2
![]()
![]()
-
Для второго опыта (рис. 3)
t0С
рис.3
![]()
![]()
-
Для третьего опыта (рис.4)
t0С
рис.4
![]()
![]()
-
Для четвёртого опыта (рис.5)
t0С
рис.5
![]()
![]()
-
Для пятого опыта (рис.6)
t0С
р ис.6
ис.6
![]()
![]()
Таким образом вы видим, что в течении первых пяти минут при перемешивании щёлочи её температура повышается прямолинейно – прямопропорционально к времени, затем наблюдаем резкий скачок изменения температуры, соответствующий приливанию кислоты к щёлочи, а затем дальнейшее повышение температуры.
Вывод:
В ходе работы были определены энтальпии нейтрализации кислот различной силы, при этом по мере увеличения силы кислоты возрастало и значение энтальпии нейтрализации.
Список литературы:
-
Фролов В. И. Практикум по общей и неорганической химии. – М., 2002. – С. 83-88.
-
Ландау Л. Д., Китайгородский А.И. Физика для всех. Молекулы. – М., 1984. – 66-70, 180-190
-
Гаммет Л. Основы физической органической химии. – М., 1985. – С. 14-27
-
Еллиев Ю. Е., Карякин Н. В. Элементы физической химии в курсе общей химии. – Нижний Новгород, 1998. – С. 34-37, 41-43, 48-52
