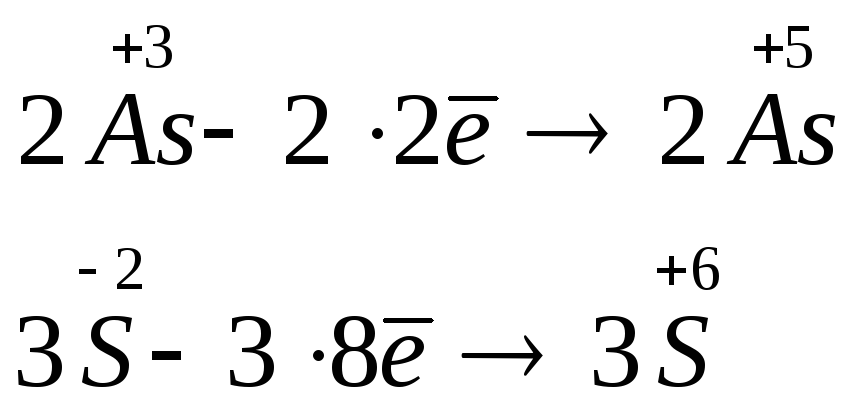- •Раздел 4
- •Определение молекулярной массы газа.
- •Теоретическая часть.
- •Газовые законы.
- •Закон объемных отношений (Гей-Люссака, 1808 г.)
- •Закон Бойля – Мариотта (1660 – 1667 г.Г.)
- •Закон Гей-Люссака (1802 г.)
- •Закон Шарля (1787)
- •Закон Авогадро (1811 г.)
- •Определение молярной массы газа.
- •1. Определение молярной массы газа по относительной плотности к другому газу.
- •Экспериментальная часть.
- •Порядок оформления результатов опыта.
- •Вопросы для самоконтроля.
- •Задачи.
- •Раздел 5
- •Способы выражения концентрации растворов
- •Размерность молярной концентрации эквивалента [моль/л]
- •Методы определения концентрации растворов
- •Способы приготовления растворов заданной концентрации
- •1. Растворением вещества в растворителе
- •2. Приготовление растворов заданной концентрации разбавлением
- •3. Приготовление раствора промежуточной концентрации из
- •Экспериментальная часть
- •Относительные плотности растворов и массовая доля растворённого вещества
- •Пример записи результатов измерения
- •1. Находят разность величин относительных плотностей растворов и массовых долей, выраженных в процентах, по табличным данным:
- •Вопросы для самопроверки
- •Задачи и упражнения
- •Раздел 6 Жесткость воды. Методы определения и устранения жесткости
- •Общие сведения
- •Методы устранения жесткости
- •Практическая часть
- •Раздел 7 окислительно-восстановительные реакции
- •Теоретическая часть Степень окисления
- •Окислительно-восстановительные реакции
- •Типы окислительно-восстановительных реакций
- •Алгоритм расстановки коэффициентов в уравнениях овр
- •Важнейшие окислители и восстановители
- •Практическое применение окислительно-восстановительных реакций
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Задачи и упражнения
Алгоритм расстановки коэффициентов в уравнениях овр
Существует несколько методов определения коэффициентов в уравнениях окислительно-восстановительных реакций. Мы используем метод электронного баланса, при котором составление полного уравнения ОВР проводится в следующей последовательности:
1. Составляют схему реакции, указав вещества, вступившие в реакцию, и вещества, получившиеся в результате реакции, например:
![]()
2. Определяют степень окисления атомов и пишут ее знак и величину над символами элементов, отмечая элементы, степень окисления которых изменилась:
![]()
3. Записывают электронные уравнения реакций окисления и восстановления, определяют число электронов, отданных восстановителем и принятых окислителем, и затем уравнивают их, умножая на соответствующие коэффициенты:
|
|
число
|
Коэф-ты |
процесс |
|
|
2 |
3 |
окисление |
|
|
6 3 |
2 |
восстановление |
4. Полученные коэффициенты, отвечающие электронному балансу, переносят в основное уравнение:
![]()
5.Уравнивают число атомов и ионов, не меняющих степени окисления (в последовательности: металлы, неметаллы, водород):
![]()
6.Проверяют правильность подбора коэффициентов по числу атомов кислорода в левой и правой части уравнения реакции – они должны быть равны (в этом уравнении 24 = 18 + 2 + 4, 24 = 24).
Рассмотрим более сложный пример:
![]()
Определим степени окисления атомов в молекулах:
![]()
Составим электронные уравнения реакций окисления и восстановления и уравняем число отданных и принятых электронов:
|
|
Число
|
Коэф-ты |
процесс |
|
|
28 84 |
3 |
окисление |
|
|
3 |
28 |
восстановл-е |
Перенесем коэффициенты в основное уравнение:
![]()
Уравняем число атомов, не меняющих степень окисления:
![]()
Подсчитав число атомов кислорода в правой и левой части уравнения, убедимся, что коэффициенты подобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительные свойства элементов зависят от строения электронной оболочки атомов и определяются их положением в периодической системе Менделеева.
Металлы, имея на внешнем энергетическом уровне 1-3 электрона, легко их отдают и проявляют только восстановительные свойства. Неметаллы (элементы IV-VII групп) могут как отдавать, так и принимать электроны, поэтому они могут проявлять и восстановительные и окислительные свойства. В периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ ослабевают, а окислительные усиливаются. В группах с повышением порядкового номера восстановительные свойства усиливаются, а окислительные ослабевают. Таким образом, из простых веществ лучшими восстановителями являются щелочные металлы, алюминий, водород, углерод; лучшими окислителями являются галогены и кислород.
Окислительно-восстановительные
свойства сложных веществ зависят от
степени окисления атомов, входящих в
их состав. Вещества,
содержащие атомы с низшей степенью
окисления, проявляют восстановительные
свойства.
Важнейшими восстановителями являются
оксид углерода
![]() ,
сероводород
,
сероводород![]() ,
сульфат железа(II)
,
сульфат железа(II)
![]() .
Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства.
Важнейшими окислителями являются
перманганат калия
.
Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства.
Важнейшими окислителями являются
перманганат калия
![]() ,
дихромат калия
,
дихромат калия![]() ,
пероксид водорода
,
пероксид водорода![]() ,
азотная кислота
,
азотная кислота![]() ,
концентрированная серная кислота
,
концентрированная серная кислота![]() .
.
Вещества,
содержащие атомы с промежуточной
степенью окисления, могут вести себя
как окислители или восстановители
в зависимости от свойств веществ, с
которыми они взаимодействуют, и условий
протекания реакции. Так в реакции с
![]() сернистая кислота проявляет
восстановительные свойства:
сернистая кислота проявляет
восстановительные свойства:
![]() ,
,
а при взаимодействии с сероводородом является окислителем:
![]()
Кроме того, для таких веществ возможны реакции самоокисления-самовосстановления, протекающие с одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, например:
![]()
Сила многих
окислителей и восстановителей зависит
от рН среды. Например,
![]() в щелочной среде восстанавливается до
в щелочной среде восстанавливается до![]() ,
в нейтральной до
,
в нейтральной до![]() ,
в присутствии серной кислоты — до
,
в присутствии серной кислоты — до![]() .
.