
Лабораторная работа № 8 а
Изучение спектра атома водорода
План работы
I. Теория вопроса
Понятие о спектре
Теоретическое объяснение спектров
Спектр атома водорода
Расчет длин волн видимых линий спектра атома водорода
II. Порядок выполнения работы
Описание установки
Изучение спектра водорода
Расчеты:
а) вычисление постоянной Ридберга
б) вычисление энергии ионизации атома водорода
в) вычисление погрешностей
I. Теория вопроса
1. Понятие о спектре
Свет представляет собой электромагнитные волны, излучаемые атомами или молекулами, а также твердыми и жидкими телами. Излучение происходит при так называемых квантовых переходах между уровнями энергии этих систем. Тело, излучающее свет, обычно является источником многих электромагнитных волн, каждая из которых имеет свою длину волны.
Оптический спектр получается
при разложении излучения по длинам волн
спектральными приборами и характеризуется
функцией
![]() ,
дающей распределение
энергии испускаемого света в зависимости
от длины волны
,
дающей распределение
энергии испускаемого света в зависимости
от длины волны
![]() .
.
Таким образом, под спектром понимается распределение энергии излучаемого света по длинам волн.
Различают три вида спектров − линейчатые, полосатые и сплошные. Линейчатый спектр представляет собой набор нескольких цветных линий на черном фоне. Он характерен для атомов и возникает при квантовых переходах между электронными уровнями энергии. Сплошные спектры испускаются при так называемом равновесном излучении.
Линейчатые спектры различных элементов отличаются числом линий, их расположением по шкале длин волн, интенсивностью линий. Каждый химический элемент имеет свой собственный, ему присущий спектр. Таким образом, спектр может служить для определения присутствия элементов. На этом основаны качественный и количественный спектральные анализы.
2. Теоретическое объяснение спектров
Классическая электродинамика Максвелла, прояснившая связь между волновой оптикой и электромагнетизмом, оказалась неспособной объяснить закономерности, наблюдаемые в спектрах испускания атомов. Это относится, в частности, к экспериментально установленной формуле, описывающей линейчатые спектры водородоподобных атомов. Классическая электродинамика не смогла объяснить также и устойчивость атома в планетарной модели, предложенной Резерфордом.
В 1913 г. Н. Бор сформулировал “полуклассическую” теорию, в рамках которой были объяснены и спектральные закономерности водородоподобных атомов, и устойчивость атомов. Эта теория базировалась на следующих постулатах, отражающих наиболее общие из экспериментально установленных к тому времени закономерностей, наблюдаемых в атомных спектрах:
1) атомы и атомные системы
могут длительно пребывать в определенных
энергетических состояниях с дискретным
спектром значений энергии (![]() ,
,![]() ,
,![]() ,...,
,...,![]() ,...),
причем в этих состояниях атомы и атомные
системы, несмотря на происходящее в них
ускоренное движение заряженных частиц,
не излучают и не поглощают энергию;
переход из одного энергетического
состояния в другое происходит скачкообразно
(постулат стационарных состояний);
,...),
причем в этих состояниях атомы и атомные
системы, несмотря на происходящее в них
ускоренное движение заряженных частиц,
не излучают и не поглощают энергию;
переход из одного энергетического
состояния в другое происходит скачкообразно
(постулат стационарных состояний);
2) поглощение и испускание
излучения атомом происходит скачкообразно
при его переходах из одного стационарного
состояния в другое. Частота испускаемого
или поглощаемого атомом света при
переходах
![]() определяется формулой (правило частот
Бора):
определяется формулой (правило частот
Бора):
![]() ,
(1)
,
(1)
где
![]() ,
,![]() − энергии атомав
− энергии атомав
![]() и
и
![]() -состояниях,
-состояниях,
![]() Дж*с− постоянная Планка (
Дж*с− постоянная Планка (![]() Дж*с).
Дж*с).
Электрон в атоме может
двигаться только по избранным стационарным
орбитам с определенным радиусом, не
поглощая и не излучая энергию. Среди
всевозможных стационарных электронных
орбит осуществляются только такие,
момент количества движения (момент
импульса) электрона на которых кратен
![]() :
:![]() ,
где
,
где![]() – момент импульса электрона,
– момент импульса электрона,![]() – масса электрона,
– масса электрона,![]() – его скорость,
– его скорость,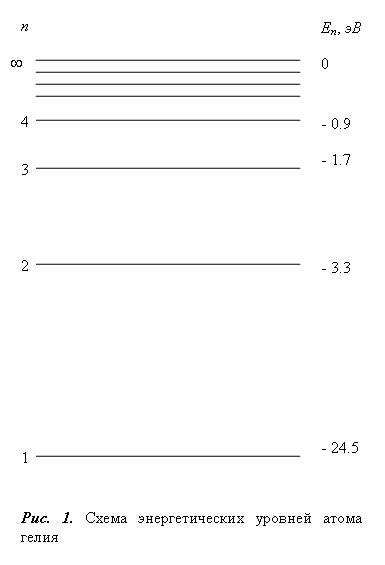
![]() – радиус орбиты,
– радиус орбиты,![]() ,
,![]() ,
,![]() ,...
Применяя эти постулаты к водородоподобному
атому (атом с одним электроном) и условие
квантования электронных орбит, Бор
теоретически получил эмпирически
установленную формулу (4), описывающую
линейчатые спектры водородоподобных
атомов.
,...
Применяя эти постулаты к водородоподобному
атому (атом с одним электроном) и условие
квантования электронных орбит, Бор
теоретически получил эмпирически
установленную формулу (4), описывающую
линейчатые спектры водородоподобных
атомов.
Графически возможные значения энергии атома изображают в виде схемы − уровней энергии − горизонтальных прямых, проведенных на расстояниях, соответствующих разностям «дозволенных» энергий.
На рис. 1 приведен, для примера, спектр атома гелия.
Самый нижний уровень
![]() ,
отвечающий минимальной
возможности энергии называется основным,
все остальные (
,
отвечающий минимальной
возможности энергии называется основным,
все остальные (![]() ,
при
,
при![]() ,
,![]() ,...)
− возбужденными, так как для перехода
на них атом необходимо возбудить −
сообщить ему извне энергию
,...)
− возбужденными, так как для перехода
на них атом необходимо возбудить −
сообщить ему извне энергию![]() .
.
Атом в основном состоянии
может находиться неограниченно долго.
Если атому каким-либо образом передать
достаточную энергию, то он перейдет в
возбужденное состояние (например,
![]() ).
В возбужденном состоянии атом может
находиться недолго и через время ~ 10-8
с
спонтанно (самопроизвольно) переходит
в на более низкий уровень энергии
(например,
).
В возбужденном состоянии атом может
находиться недолго и через время ~ 10-8
с
спонтанно (самопроизвольно) переходит
в на более низкий уровень энергии
(например,
![]() ).
Поскольку при переходе на более низкий
уровень энергия атом; уменьшается, то
атом излучает излишек энергии в виде
электромагнитного излучения. Другими
словами, при таком переходе испускается
квант света − фотон. Частота фотона
определяется из закона сохранения
энергии
).
Поскольку при переходе на более низкий
уровень энергия атом; уменьшается, то
атом излучает излишек энергии в виде
электромагнитного излучения. Другими
словами, при таком переходе испускается
квант света − фотон. Частота фотона
определяется из закона сохранения
энергии
![]() .
(1/)
.
(1/)
Каждому возможному переходу
из состояния с энергией
![]() в состояние
в состояние![]() соответствует электромагнитная волна
определенной частоты, т.е. каждому
переходу соответствует определенная
спектральная линия. Таким образом,
появляется спектр.
соответствует электромагнитная волна
определенной частоты, т.е. каждому
переходу соответствует определенная
спектральная линия. Таким образом,
появляется спектр.
Процесс отрывания электрона от атома называется ионизацией. Энергия, которую необходимо сообщить атому для отрывания электрона и удаления его на большое расстояние от атома называется энергией ионизации. Энергию ионизации атома легко определить, зная энергетический спектр атома: она, очевидно, будет равна разности энергий конечного состояния (атом ионизирован) и начального состояния (атом находите: в основном состоянии).
В соответствии со сказанным
энергия ионизации гелия равна
![]() эВ.
эВ.
