
- •Минобрнауки россии
- •Введение
- •Правила работы и поведения в лаборатории
- •Список необходимого оборудования
- •Порядок выполнения работ и оформления лабораторного журнала
- •Тема 1. Техника микроскопирования (1 ч)
- •Тема 2. Приготовление препаратов микроорганизмов прижизненное изучение микроорганизмов (1 ч)
- •Тема 3. Питательные среды, их приготовление, разливка. Получение элективных культур (1 ч)
- •Тема 4. Экология микроорганизмов. Основы санитарно-бактериологического анализа
- •1000 Л – х микробов
- •Критерии для санитарной оценки воздуха жилых помещений (число микроорганизмов в 1 м3 воздуха) по а.И.Шафиру
- •Тема 5. Получение чистых культур. Изучение особенностей микроорганизмов с целью их идентификации (4 ч)
- •Обнаружение волютина
- •Обнаружение гликогена и гранулезы
- •Тема 6. Изучение ветвящихся и образующих плодовые тела форм бактерий методом элективных культур
- •Тема 7. Трансформация микроорганизмами соединений азота
- •Изучение культуры
- •Закладка элективной культуры азотобактера
- •Изучение культуры
- •Закладка элективных культур первой и второй фаз нитрификации
- •Изучение первой фазы нитрификации
- •Изучение второй фазы нитрификации
- •Закладка элективной культуры
- •Изучение культуры
- •Тема 8. Участие микроорганизмов в круговороте углерода (3 ч)
- •Закладка элективной культуры
- •Изучение культуры
- •Закладка элективной культуры
- •Закладка элективной культуры тионовых серобактерий
- •Закладка элективной культуры десульфатирующих бактерий
- •Изучение культур
- •Рецепты некоторых красителей, индикаторов и растворов
- •Литература
Тема 5. Получение чистых культур. Изучение особенностей микроорганизмов с целью их идентификации (4 ч)
Идентификацию микроорганизмов проводят путем изучения морфологических, культуральных и физиологических свойств.
Морфологические свойства исследуются при микроскопировании, культуральные устанавливаются по особенностям роста на питательных средах (рис. 6), физиологические изучаются при выращивании на дифференциально-диагностических средах.
Работа 16. Получение чистой культуры бактерий
Оборудование: чашки Петри с колониями, полученными при анализе воздуха, микробиологические иглы, спиртовка, пробирки со стерильными питательными средами: МПА (СПА) прямой, МПА (СПА) косой, МПБ, МПЖ, молоко, картофельные среды.
Ход работы
Описание выбранной колонии
Описание проводят по схеме:
Размер колонии: точечные (Д меньше 1 мм), средние (Д – 2-4 мм), крупные (Д – 4-6 мм и более).
Форма (округлая, неправильная, амебовидная, ризоидная, мицелиальная).
Оптические свойства (прозрачная, матовая, флюоресцирующая, полупрозрачная, непрозрачная, блестящая).
Цвет и выделение пигмента в среду.
Поверхность (гладкая, шероховатая, складчатая, бугристая).
Профиль (плоский, выпуклый, кратерообразный, конусовидный).
Край (ровный, волнистый, лопастной, ризоидный).
Структура (однородная, мелко- и крупнозернистая, струйчатая, волнистая).
Консистенция (маслянистая, тестообразная, вязкая, пленчатая).
Составив описание колонии, делают пересев в чистую культуру на твердые и жидкие среды.

Рис. 6. Характеристика колоний:
форма: а – округлая, б – неправильная, в – амебовидная, г – ризоидная, д – мицелиальная; профиль: а – плоский, б – выпуклый, в – кратерообразный, г – конусовидный; край: а – ровный, б – волнистый, в – лопастной, г – бахромчатый; структура: а – однородная, б – мелкозернистая, в – крупнозернистая, г – струйчатая, д – волнистая.
Пересев микроорганизма в чистую культуру
А. На прямой МПА (СПА) (микробиологической иглой):
Берут микробиологическую иглу в правую руку (рис. 7), прокаливают ее на пламени спиртовки, дают остыть, приоткрывают чашку Петри, дотрагиваются до агара (агар не должен плавиться), захватывают часть выбранной колонии.
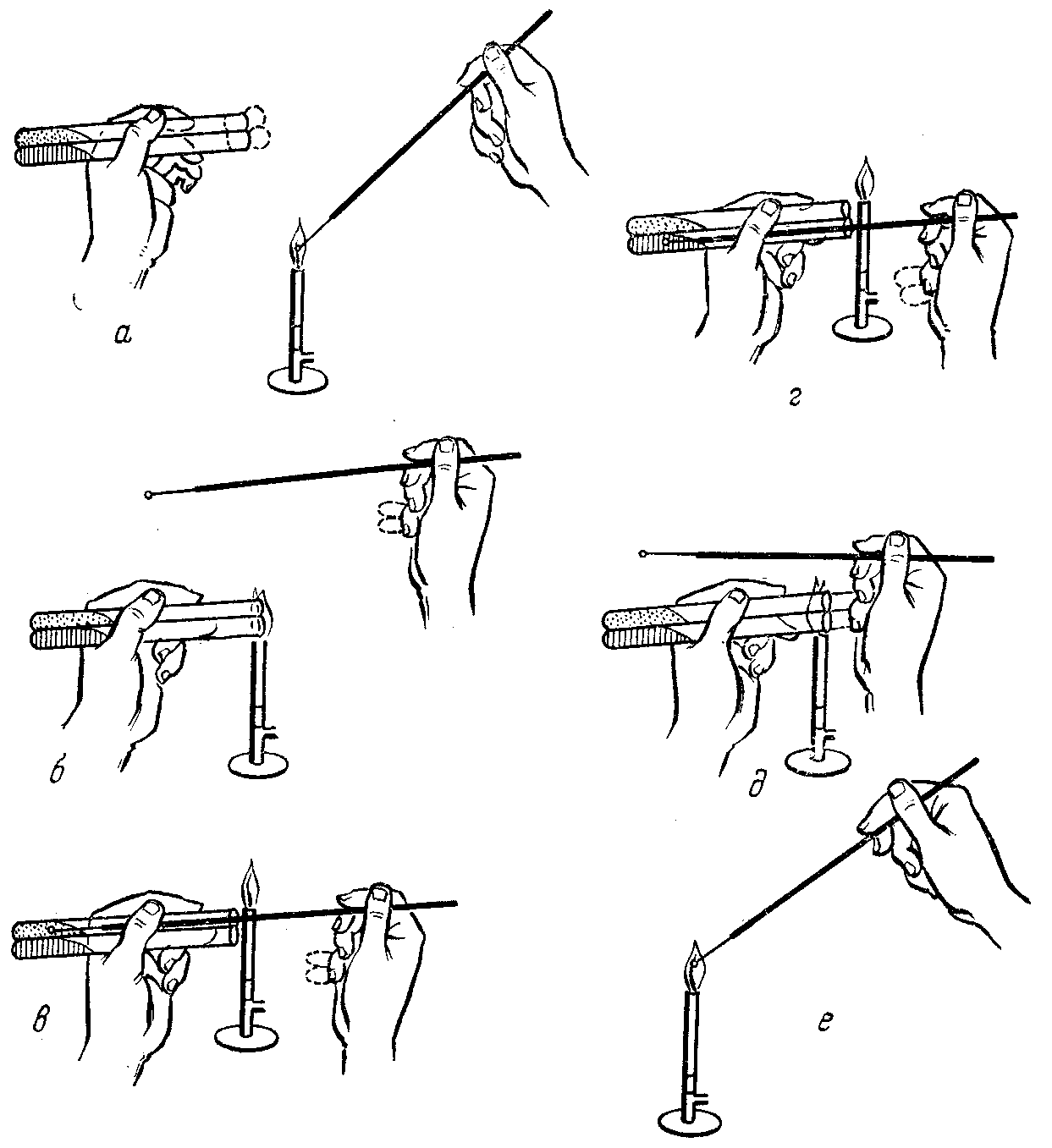
Рис. 7. Посев культуры микроорганизмов в пробирки со средой:
а, е – стерилизация петли; б – стерилизация краев пробирки;
в, г – взятие и посев материала; д – закрытие пробирок пробками
Тремя пальцами левой руки берут пробирку с агаром, мизинцем и безымянным пальцем правой руки вынимают из нее ватную пробку, обжигают края.
Вводят иглу в пробирку, вертикально делают укол почти до дна, вынимают иглу.
Обжигают горло пробирки и пробку, закрывают пробирку, этикетируют.
Б. На косой МПА (СПА) (микробиологической петлей):
Разогревают агар и размещают на подставке для косого наклона среды. Среда должна иметь наибольшую площадь и не должна касаться пробки.
Соблюдая те же правила, что и при посеве уколом, совершают посев штрихом по поверхности агара. Этикетируют.
Посев на дифференциально-диагностические среды
Из выращенной чистой культуры, соблюдая правила стерильности, производят посев на: 1 – МПБ, 2 – МПЖ, 3 – молоко, 4 – картофельную среду. В МПЖ – уколом иглой, в остальные – микробиологической петлей или шпателем Дригальского (рис. 8).
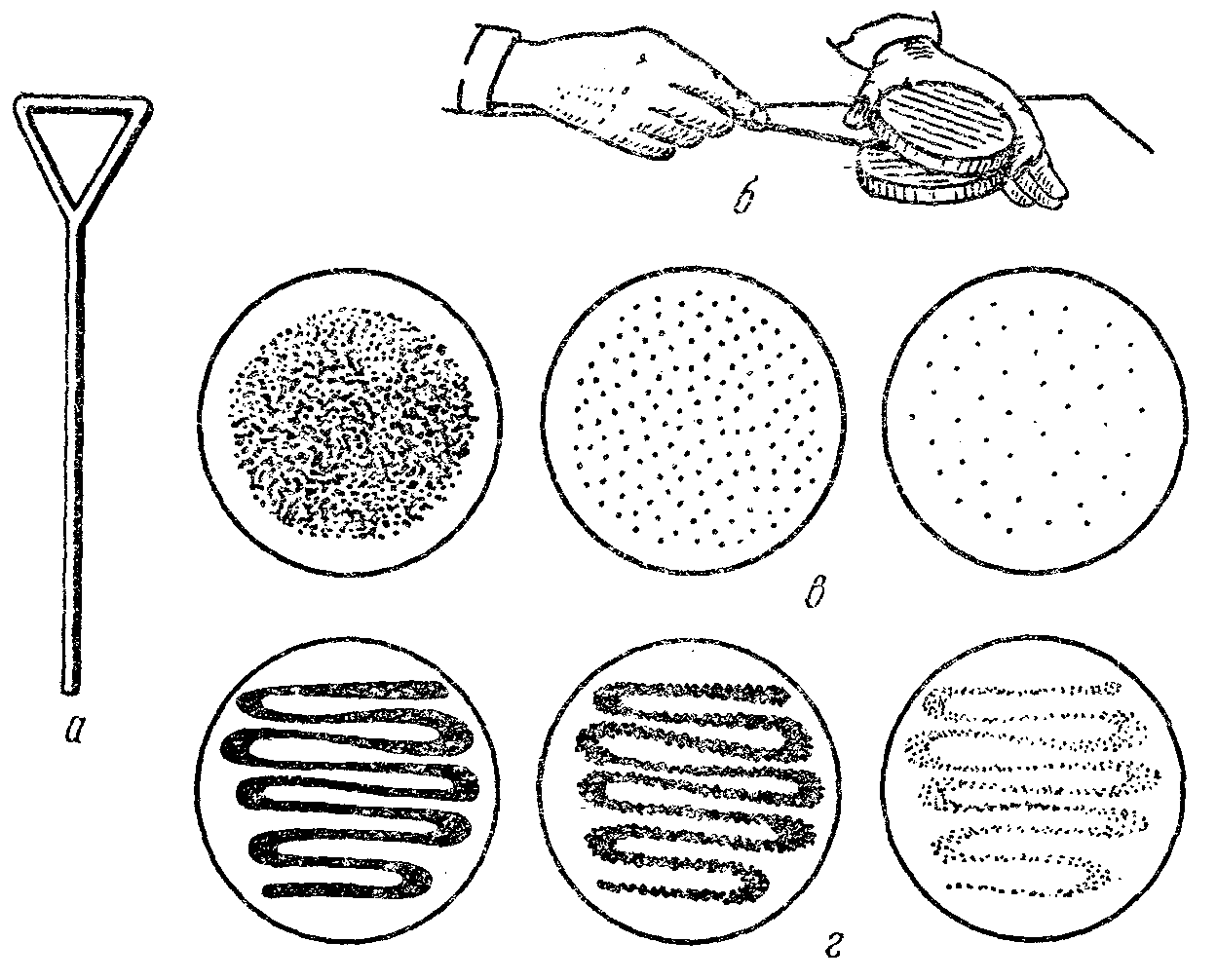
Рис. 8. Посев микроорганизмов на поверхность плотной среды в чашках Петри:
а – шпатель Дригальского; б – положение чашки и руки при посеве шпателем; в – рост микроорганизмов после рассева шпателем; г - рост микроорганизмов после рассева петлей
Работа 17. Окраска бактерий по Граму
Оборудование: пробирки с чистой культурой, обезжиренные предметные стекла, петли, спиртовка, кристаллизатор с подставкой, промывалка с водой, однопроцентный раствор кристаллвиолетта, раствор Люголя, 95-процентный этанол (ацетон), 0,1-процентный раствор фуксина, микроскоп с иммерсионной системой.
Ход работы
Тонкий мазок высушить, зафиксировать, нанести раствор кристаллвиолетта на 1-2 минуты.
Залить раствором Люголя на 1-2 минуты.
Промыть водой и этанолом (ацетоном) в течение 60 сек или в течение 10 сек.
Промыть водой. Докрасить фуксином 2 мин.
Высушить. Микроскопировать.
Грамположительные бактерии окрашиваются в сиренево-фиолетовый цвет, грамотрицательные – в малиновый.
Работа 18. Обнаружение капсул на негативном прижизненном
препарате
Оборудование: чистая культура, предметные стекла, карболовый фуксин Циля, черная тушь, спиртовка, петли, микроскоп.
Ход работы
Каплю культуры на предметном стекле окрасить фуксином в течение 2-3 минут.
П
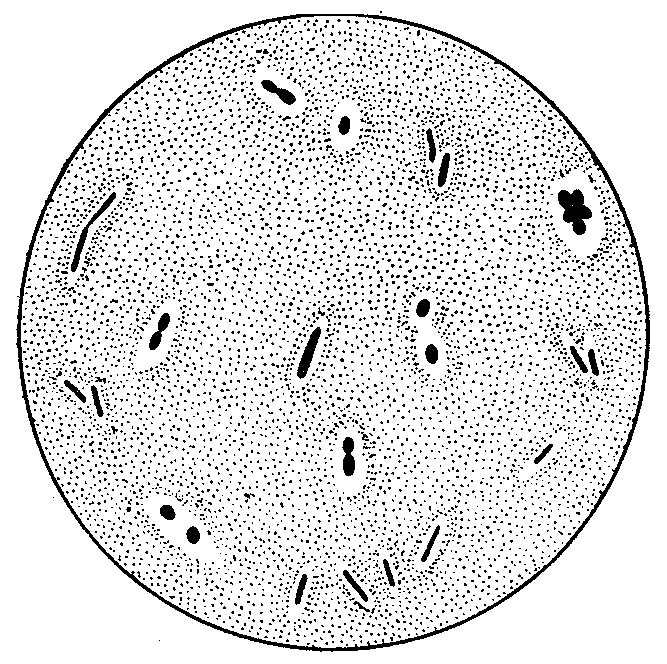 рибавить
черную тушь, накрыть покровным стеклом.
рибавить
черную тушь, накрыть покровным стеклом.Микроскопировать (рис. 9). Зарисовать в альбом.
Рис. 9. Капсулы у бактерий
Работа 19. Окраска спор
Оборудование: предметные стекла, петли, исследуемая культура, спиртовка, фильтровальная бумага, кристаллизатор с подставкой, промывалка с водой, однопроцентный раствор серной кислоты, пятипроцентный раствор хромовой кислоты, карболовый фуксин Циля, раствор метиленового синего (1:40), микроскоп с иммерсией.
Ход работы
Приготовить мазок, высушить, зафиксировать. Протравить пятипроцентным раствором хромовой кислоты в течение 5 минут.
Промыть водой, залить карболовым фуксином Циля. Окрашивать в течение 5 минут, нагревая над пламенем до появления паров и добавляя краситель.
Промыть, обесцвечивать в течение 2 минут серной кислотой.
Промыть, докрасить метиленовым синим в течение 10-15 минут.
Промыть, высушить, микроскопировать. Клетки должны быть синими, а споры - красными.
Работа 20. Обнаружение запасных включений
Оборудование: предметные и покровные стекла, петли, спиртовка, вода, пинцет, фильтровальная бумага, кристаллизатор с подставкой, микроскоп с иммерсией, метиленовый синий (1:40), раствор Люголя, судан III, 40-процентный формалин, исследуемая культура.
Ход работы
