
- •Лабораторний практикум з генетики
- •Методи та об’єкти генетичних досліджень.
- •Мітоз. Мейоз.
- •Моно- та дигібридні схрещування.
- •Взаємодія неалельних генів.
- •Стать та генетика статі. Ознаки та стать.
- •Кросинговер.
- •Пошкодження днк та репарація.
- •Спадкова та неспадкова мінливість.
- •Генетика людини.
- •Спадкування кількісних та мультифакторіальних ознак.
- •Популяційна генетика.
- •Теми для самостійного опрацювання.
- •IV. Генетика індивідуального розвитку.
- •Афанасьєва Катерина Сергіївна
Пошкодження днк та репарація.
Питання для обговорення:
Мутагени та механізми їх дії. Промутагени.
Основні пошкодження ДНК.
Механізми прямої репарації.
Системи непрямої репарації пошкоджень (ексцизійна репарація, репарація місметчів, негомологічне з’єднання кінців ДНК, постреплікативна (рекомбінаційна) репарація, SOS-репарація).
Лабораторна робота 5. Визначення рівня пошкоджень ДНК та дослідження кінетики репарації за допомогою методу електрофорезу ДНК ізольованих клітин.
Електрофорез ДНК ізольованих клітин (кометний електрофорез) — це один із сучасних методів дослідження нестабільності геному. Останнім часом він широко використовується для біомоніторингу популяції людей з метою виявлення мутагенних та канцерогенних агентів, визначення рівня пошкодження ДНК та ризику появи злоякісних пухлин. Сутність методу полягає в тому, що ізольовані клітини заплавляються в агарозу на поверхні предметного скла, піддаються лізису з метою видалення мембран та зв'язаних з ДНК білків (при збереженні зв'язку ДНК з ядерним матриксом), після чого здійснюється електрофорез в нейтральних умовах. Під дією електричного струму ДНК виходить із клітини та формує зону, що нагадує хвіст комети (звідси і виникла назва електрофорезу ізольованих клітин – кометний електрофорез, яку запропонував Oliver у 1989 році) (рис. 5).
Численні експерименти свідчать про те, що вихід ДНК полегшується – а за думкою багатьох авторів, взагалі стає можливим – після дії пошкоджуючих чинників (таких, наприклад, як іонізуюче випромінювання, що здатне індукувати розриви в ДНК).

При застосуванні методу електрофорезу ізольованих клітин було встановлено, що максимальний рівень міграції ДНК виявляється одразу після опромінення клітин. Проте, якщо опромінені клітини витримувати у поживному середовищі після опромінення, довжина хвостів зменшується. Це можна пояснити наявністю в клітинах швидкого репараційного процесу. За швидкістю вкорочення “хвостів” та за зменшенням проценту комет через певні проміжки часу після опромінення можна оцінити кінетику репарації ДНК.
Для аналізу пошкодженості ДНК використовують такі параметри:
1. Кількість клітин, що формують зону “хвоста” комети, тобто мають пошкоджену ДНК, серед усіх досліджуваних клітин;
2. Довжину “хвоста” комети, що визначається як максимальна довжина пробігу ДНК, яка вимірюється від центру “голови” комети і до останнього найменшого фрагменту ДНК;
“Хвостовий момент”, що визначається як довжина “хвоста” комети, помножена на долю ДНК у “хвості”.
Останнім часом, для спрощення підрахунку рівня пошкодженості ДНК окремої клітини запропоновано розрізняти 5 класів комет в залежності від морфології “хвоста” – від 0 (не пошкоджена ДНК) до 4 (максимальна кількість розривів).
Принципи розподілу комет за класами наступний:
а) нульовий клас (С0) – інтактні ядра.
б) перший клас (С1) – спостерігається „хвіст”, довжина якого не перевищує радіусу інтактного ядра.
в) другий клас (С2) – спостерігається „хвіст”, довжина якого не перевищує діаметру інтактного ядра.
г) третій клас (С3) – спостерігається „хвіст”, довжина якого перевищує діаметр інтактного ядра. Ядро комети видно чітко, але воно значно менше за ядро комети С0.
д) четвертий клас (С4) – спостерігається „хвіст”, довжина якого значно перевищує діаметр інтактного ядра. Ядро комети майже відсутнє.
Н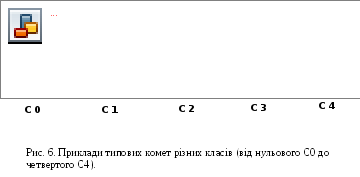 а
рисунку 6 показані фотокартки типових
комет різних класів.
а
рисунку 6 показані фотокартки типових
комет різних класів.
Відносну пошкодженість ДНК визначають за формулою:
P=C1+C2×2+С3×3+С4×4, де С1-С4 – доля клітин відповідного класу комет.
Мета роботи: дослідити кінетику репарації розривів ДНК.
Матеріали та обладнання: мікрофотографії опромінених лімфоцитів людини після електрофорезу, лінійки.
Завдання 1. Визначити процент „комет”, середню довжину хвостів (в міліметрах) та за класами комет відносну пошкодженість ДНК на мікрофотографіях опромінених лімфоцитів.
Завдання 2. Визначити процент „комет”, середню довжину хвостів (в міліметрах) та за класами комет відносну пошкодженість ДНК на мікрофотографіях опромінених лімфоцитів після різної витримки опромінених клітин в поживному середовищі.
Завдання 3. Побудуйте графіки залежності досліджуваних параметрів від часу інкубації клітин після опромінення та опишіть кінетику репарації розривів. Зробіть висновок про інформативність кожного з параметрів відносно пошкодженості ДНК та кінетики репарації.
Приклади задач за темою:
1. Клітини E. coli інкубують з міченим метил-нітро-нітрозо-гуанідином – мутаген, що призводить до утворення модифікованої основи O6MetG. Виділяють ДНК, гідролізують її до нуклеотидів, визначають кількість мічених модифікованих основ. ДНК, що містить 0,26 рМ модифікованої основи, інкубують з 2,5 нг метилтрансферази (молекулярна маса 19 000), яка забезпечує репарацію метильованої основи, вивчають кінетику репарації – залежність від часу кількості мітки, що залишається в ДНК. Через незначний час ця кількість виходить на плато, залишаючись на рівні 50% від вихідної кількості модифікованих основ. Розрахуйте число метильних груп, видалених однією молекулою ферменту на момент виходу на плато. Поясніть, чому спостерігається вихід на плато, і фермент припиняє роботу?
Приклади модульно-рейтингових питань за темою:
Дайте визначення термінів: мутаген, мутагенез,про мутаген, канцероген, кластоген.
Які є типи мутагенів?
Який з типів мутагенів є більш специфічним щодо пошкоджень ДНК, які індукуються?
Які пошкодження ДНК викликає ультрафіолет?
Які типи пошкоджень характерні для іонізуючого випромінювання?
Що таке непряма дія радіації?
Що таке пряма репарація?
Які типи репарації не порушують цілісність ДНК?
Який механізм лежить в основі постреплікативної репарації?
Яка система репарації є більш „універсальною” до типів пошкоджень ДНК?
За допомогою якого ферменту під впливом видимого світла відбувається ферментативна фотореактивація?
Як здійснюється ексцизійна репарація основ?
Порівняйте ексцизійну репарацію основ і нуклеотидів.
Якій білковий комплекс впізнає пошкодження при ексцизійній репарації нуклеотидів у прокаріот?
Як відбувається місметч репарація у прокаріот?
Як здійснюється репарація дволанцюгових розривів ДНК?
Завдяки якій модифікації азотистих основ здійснюється впізнання ланцюга, який треба замінити, при репарації помилково спарених нуклеотидів?
За яким механізмом відбувається постреплікативна репарація?
Який фермент виконує пряму репарацію тимінових димерів?
Який тип "репарації" не репарує пошкодження ДНК?
Заняття 9,10
