
- •Задачи и разделы физической химии.
- •1.2 Основные понятия химической термодинамики.
- •1.3 Первый закон термодинамики.
- •1.4 Расчет работы расширения идеального газа в различных процессах.
- •1.5 Теплота процессов при постоянном объеме (qv) и постоянном давлении (Qp).
- •1.6 Закон Гесса.
- •1.7 Связь между Qp и qv для химических реакций.
- •1. 8 Теплоемкость вещества
- •1.9 Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа.
1.5 Теплота процессов при постоянном объеме (qv) и постоянном давлении (Qp).
Рассмотрим химическую реакцию νАА+νВВ→νсС
Для нее А = 0, А = рdV, тогда первый закон термодинамики в дифференциальной форме можно записать следующим образом:
Q = dU + рdV. (17)
1). Рассмотрим изохорный процесс (V = const).
В этом случае dV = 0. Отсюда получим: QV = dU или, интегрируя:
QV = U.
То есть, если реакция протекает при постоянном объеме, то ее тепловой эффект QV равен изменению внутренней энергии системы в результате реакции. Однако, поскольку внутренняя энергия есть функция состояния системы, то QV приобретает свойства является функции состояния системы.
2). Рассмотрим изобарный процесс (р = const).
Тогда рdV = d(pV);
Qр = dU + d(pV) = d(U+ pV) (18)
Под знаком дифференциала стоит некоторая функция состояния. Обозначим ее через Н = U + pV (19)
и назовем энтальпией.
Тогда получим:
Qр = dН, Qр = Н.
Таким образом, тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии Н и обладает свойствами функции состояния.
1.6 Закон Гесса.
Этот закон был открыт Гессом в 1840 г. на основании обобщения множества экспериментальных данных.
Формулировка закона Гесса:
Тепловой эффект реакции, протекающей при постоянном давлении (Qp = Н) или при постоянном объеме (QV = U) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (т.е. реакцию можно проводить в одну, две, три и т.д. стадии).
Закон Гесса основан на том, что Qp и QV – функции состояния (в отличие от Q).
QV = ∆U, V= const,
QP = ∆H, p= const (20)
Рассмотрим процесс перехода от исходных веществ к продуктам реакции при р = const, Т = const. Тогда Qp = Н. Составим так называемый термохимический цикл. Пусть от исходных веществ к продуктам реакции можно перейти тремя различными путями - в одну, две или три стадии:

По закону Гесса Н1 = Н2 + Н3 = Н4+Н5+Н6.
Следствия из закона Гесса.
Первое следствие из закона Гесса.
Тепловой эффект реакции равен разности между суммой теплот образования из простых веществ (fH) продуктов реакции и суммой теплот образования из простых веществ исходных веществ (с учетом стехиометрических коэффициентов).
Математическое выражение для первого следствия из закона Гесса можно записать в следующем виде:
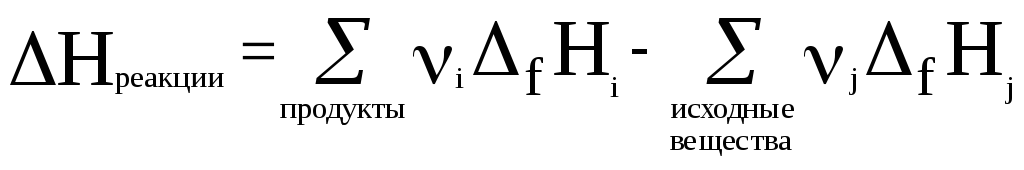 (21)
(21)
Теплота образования ∆fН - это тепловой эффект реакции образования 1 моль соединения из простых веществ.
Стандартное состояние характеризуется и давлением р = 1 атм = 1·105Па .
Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами.
Стандартная энтальпия (теплота) образования соединения из простых веществ (f0298) – это есть тепловой эффект реакции образования 1 моль данного соединения из соответствующих количеств простых веществ при стандартных условиях .
Простые вещества-это химические элементы или вещества , взятые в тех агрегатных состояниях или кристаллических модификациях, в которых они устойчивы при стандартном состоянии.
Принято, что для простых веществ f0298 = 0.
Второе следствие из закона Гесса.
Тепловой эффект реакции равен разности между суммой теплот сгорания (cH) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов).
Математическоевыражение для вторго следствия из закона Гесса можно записать в следующем виде:
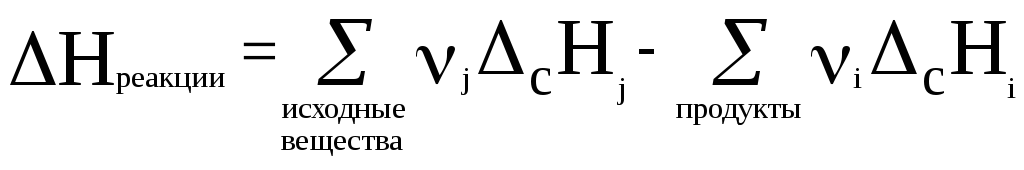 (22)
(22)
Стандартная энтальпия (теплота) сгорания соединения (обозначаемая как c0298) – это есть тепловой эффект реакции окисления 1 моль данного сединения газообразным молекулярным кислородом при стандартном условиях с образованием соответствующих количеств следующих веществ (если не указано иначе): СО2, газ, Н2Ожидк., N2, газ,. Hhal,(Cl,Br), SO2 газ. и др.
Единицы измерения [fН] и [сН] равны кДж/моль, [] = моль, [Нреакции] = кДж!
Пример 1.1 Рассчитать тепловые эффекты двух следующих реакций:
а)
![]() ;
;
б)
![]() ,
,
если известны стандартные теплоты образования всех компонентов данных реакций.
Решение. Выполним расчеты для 250С и давления 1 атм, приняв условие постоянства давления в ходе реакций. В этом случае тепловой эффект должен быть равен изменению энтальпии системы:
а) ![]() ;
;
б) ![]() .
.
Пример 1.2 Рассчитать тепловой эффект полиморфного превращения 1 моль графита в алмаз при стандартных условиях, если известны стандартные теплоты сгорания графита и алмаза при Т = 298,15 К и Р = 1атм.
1. ![]() ;
;
2. ![]()
Решение. Запишем реакцию полиморфного превращения графита в алмаз:
![]() .
.
Расчет показывает, что
![]()
Следовательно, процесс превращения графита в алмаз при стандартных условиях (если бы он имел место) должен был бы происходить с поглощением небольшого количества тепла.
