
- •Лекция 2
- •2.1 Второй закон термодинамики.
- •2.2 Энтропия и термодинамическая вероятность системы.
- •2.3 Расчет изменения энтропии в различных процессах.
- •2.3 Постулат Планка. Третий закон термодинамики.
- •2.4 Термодинамические потенциалы. Энергия Гиббса. Энергия Гельмгольца
- •2.5 Характеристические функции. Уравнения Гиббса–Гельмгольца.
- •Самопроизвольное протекание химической реакции. Расчет изменения энергии Гиббса в химических реакциях
- •Химический потенциал.
- •Полный дифференциал внутренней энергии открытой системы можем записать
- •2.8 Активность и летучесть.
Лекция 2
Второй закон термодинамики. Энтропия. Вычисление изменения энтропии для различных процессов. Постулат Планка. Энергия Гиббса и энергия Гельмгольца. Уравнение Гиббса-Гельмгольца. Самопроизвольное протекание химических реакций. Расчет изменения энергии Гиббса в химических реакциях. Химический потенциал. Активность и летучесть.
2.1 Второй закон термодинамики.
Первый закон термодинамики не дает критериев направления самопроизвольных и несамопроизвольных процессов и условий, при которых наступает состояние равновесия. Лишь с появлением в термодинамике понятия энтропия появляется строгий критерий направления самопроизвольных процессов. Термин энтропия, как и второй закон термодинамики, были введены Клаузиусом в середине ХIХ века. Карно показал, что в тепловых машинах теплота, полученная от источника тепла, не может быть полностью переведена в механическую работу, а часть ее должна быть передана третьему телу – холодильнику. Это обобщение по существу выражает второй закон термодинамики и может рассматриваться как одна из формулировок второго закона термодинамики. Рассмотрим также некоторые другие формулировки второго закона:
Формулировка Клаузиуса (1850 г.).Не возможен самопроизвольный процесс передачи теплоты от холодного тела к горячему.
Формулировка Кельвина (Томсона) (1851 г.). Не возможно превратить теплоту какого-либо тела в работу, не производя никакого другого действия, кроме охлаждения этого тела;
Формулировка по Оствальду.Вечный двигатель второго рода невозможен (т.е. не существует машины, которая бы полностью превращала теплоту в работу).
Клаузиус, рассматривая
обратимый циклический процесс, состоящий
из двух изотерм и двух адиабат (см.
учебники), разбил его на бесконечно
малые участки, просуммировал (учитывая
знаки Q) все величины![]() (элементарная приведенная теплота),
и показал, что для обратимого процесса
(элементарная приведенная теплота),
и показал, что для обратимого процесса
![]() .
.
Если вспомнить свойства
функции состояния, то для какой-то
функции состояния Z интеграл
![]() ,
поэтому величина
,
поэтому величина![]() связана с какой-то функцией состояния.
Эту функцию состояния назвалиэнтропией
(S).
связана с какой-то функцией состояния.
Эту функцию состояния назвалиэнтропией
(S).
![]() или
или ![]() , (1)
, (1)
Выражение
![]() (равенство Клаузиуса) – это дифференциальная
форма записи второго закона термодинамики
для обратимых процессов. Для необратимых
процессов, как показал Клаузиус,
справедливо неравенство
(равенство Клаузиуса) – это дифференциальная
форма записи второго закона термодинамики
для обратимых процессов. Для необратимых
процессов, как показал Клаузиус,
справедливо неравенство
dS
>
![]() , (2)
, (2)
это дифференциальная форма записи второго закона термодинамики для необратимых процессов. В общем виде дифференциальная форма записи второго закона термодинамики для обратимых и необратимых процессов может быть представлена в виде:
dS
![]()
![]() , (3)
, (3)
Единица измерения
энтропии - такая же как и у соответствующей
теплоемкости: молярной (мольной) –
![]() ,
удельной –
,
удельной –![]()
![]() .
.
Энтропия – экстенсивная величина, т.е. пропорциональна массе системы.
Из дифференциальной формы записи второго закона термодинамики легко можно получить интегральную форму записи этого закона:
![]() ;
;
![]() (4)
(4)
Первый и второй законы термодинамики можно объединить в так называемый объединенный первый и второй закон термодинамики, который дляобратимых процессов можно записать следующим образом:
ТdS = dU + A + pdV. (5)
Если работа производится системой только против внешнего давления, то A = 0 и получаем:
ТdS = dU + pdV(6)
Отсюда вытекает, что:
![]() , (7)
, (7)
т.е. энтропия S является функцией внутренней энергии U и объема V: S = f(U,V).
В общем виде объединенный первый и второй закон термодинамики можно записать следующим образом:
ТdS![]() dU+A+pdV(8)
dU+A+pdV(8)
Если рассматривать только объемную работу, то получим:
TdS
![]() dU + pdV (9)
dU + pdV (9)
Второй закон термодинамики для изолированных систем.
Для изолированной системы Q = 0, m = const, U = const, V = const. Для необратимых процессов, протекающих в такой системе, можно записать, что
dSнеобр. > 0
Sнеобр. > 0 т.е. S2 > S1 (11)
Выражения dS > 0 и S > 0 можно рассматривать как математическую запись второго закона термодинамики, который для изолированной системы формулируется следующим образом:
в изолированной системе любой самопроизвольный процесс протекает только с увеличением энтропии, причем процесс закончится тогда, когда энтропия S достигнет своего максимального значения (когда наступит состояние равновесия).
При равновесии S2 = Smax = const и S = 0. Схематически все сказанное можно изобразить на графике зависимости S от пути процесса:
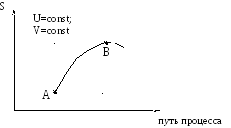
Путь процесса – это какая-либо величина, которая меняется при протекании процесса и поддается опытному определению.
Участок АВ – необратимый самопроизвольный процесс (S > 0), энтропия возрастает; участок ВA – необратимый нeсамопроизвольный процесс (S < 0), энтропия уменьшается; точка В – равновесное состояние (S=Smax).
Следует отметить, что если процесс протекает в неизолированной системе, то для оценки необратимости процесса необходимо иметь величину изменения энтропии системы и величину изменения энтропии окружающей среды.
