
методичка Миронова.Жереб.Чижевская.Химия.2013
.pdfТакие реакции характерны для V, Nb, W, Mn и других металлов, имеющих высшие степени окисления в соединениях.
Интенсивность действия водных растворов кислот на металлы соответствует положению металлов в ряду стандартных электродных потенциалов (прил. 8) и окислительным свойствам кислот. Чем больше разбавлена кислота и чем активнее металл, тем глубже идет восстановление.
Действие кислот на металлы, окислительная способность которых обусловлена окислительными свойствами недиссоциированных молекул и даже анионов, обладает определенными особенностями.
Особенность действия азотной кислоты на металлы состоит в том, что она окисляет металлы без выделения водорода даже из разбавленного раствора азотной кислоты. Степень окисления азота в азотной кислоте, равная +5, меняется до +4, +3, +2, +1 и 0 степени, и даже концентрированная азотная кислота действует на все металлы, кроме благородных.
Серная концентрированная кислота действует на металлы средней и малой активности только при нагревании, сера восстанавливается от степени +6 до степени +4 или до 0.
Концентрированные кислоты, анионы которых не обладают окислительными свойствами, как правило, с металлами не взаимо- дей-ствуют.
Методика и порядок выполнения работы
Опыт 1. Взаимодействие металлов с водой
В 4 пробирки налейте по 6 капель дистиллированной воды, добавьте в каждую пробирку по 1 капле фенолфталеина и опустите
впервую пробирку кусочек магния, во вторую – кусочек железа,
втретью – кусочек алюминия, а в четвертую – кусочек меди. Наблюдаются ли какие-либо изменения? Нагрейте содержимое пробирок
впламени спиртовки до кипения. Отметьте наблюдаемые изменения
впробирке с магнием. Почему не появилось окрашивание в остальных пробирках? Чем оно вызвано?
Опыт 2. Взаимодействие металлов с кислотами
Рассмотрим некоторые случаи взаимодействия алюминия с кислотами.
Взаимодействие алюминия с разбавленной и концентрированной соляной кислотой. В две пробирки положите по кусочку алюминия и добавьте в одну 5–8 капель разбавленной, а в другую –
71
5–8 капель концентрированной соляной кислоты. Есть ли разница во взаимодействии? Какой газ выделяется? Запишите уравнение реакции.
Взаимодействие алюминия с разбавленной и концентрированной серной кислотой. В 2 пробирки поместите по кусочку алюминия и добавьте по 5–8 капель разбавленной (2н) и концентрированной серной кислоты. Какова активность взаимодействия алюминия
ссерной кислотой по сравнению с соляной? Осторожно подогрейте обе пробирки на пламени спиртовки. Какой газ выделяется при взаи-
модействии с разбавленной H2SO4? Установите по запаху выделение сернистого газа при взаимодействии алюминия с концентрированной серной кислотой, а также наблюдайте выпадение серы при взаимодействии с разбавленной кислотой. Чем вызвана разница во взаимодействии? Напишите уравнения реакций взаимодействия алюминия
скислотами разной концентрации на холоде и при нагревании, учитывая, что серная кислота по мере разбавления восстанавливается до
SO2, H2S или S.
Взаимодействие алюминия с разбавленной и концентриро-
ванной азотной кислотой. В 2 пробирки положите по кусочку алюминия и прилейте по 5–8 капель разбавленной и концентрированной азотной кислоты. Наблюдается ли взаимодействие? Осторожно одогреете пробирки. Что выделяется в обоих случаях? Напишите уравнение реакции взаимодействия алюминия с азотной кислотой разной концентрации, учитывая, что азотная кислота по мере разбавления восстанавливается до NO2 или NО.
Пассивирующее действие холодной концентрированной азотной кислоты на алюминий. Кусочек алюминия зачистите наждачной бумагой, опустите в пробирку и прилейте 5–10 капель концентрированной азотной кислоты. Через 5 мин слейте кислоту и промойте алюминий водой, после чего внесите 5–10 капель концентрированной соляной кислоты. Будет ли реагировать алюминий так же, как в п. 1? Почему?
Взаимодействие железа с кислотами. Налейте в 4 пробирки по 5, 6 капель кислот: 2н НСl, 2н H2SO4, концентрированной H2SO4, 2н HNO3. В каждую пробирку внесите кусочек железной стружки. Затем добавьте во все растворы по 1 капле 0,01н раствора роданида калия KCNS или аммония NH4CNS. В каких пробирках образовались ионы Fe+3? Какие ионы образовались в пробирках, где не произошло окрашивание? Чем объяснить, что при взаимодействии железа с серной кислотой разной концентрации образуются ионы железа различной степени окисления? Запишите уравнения соответствующих реакций.
72
Взаимодействие меди с кислотами. В 3 пробирки налейте по 5, 6 капель 2н растворов соляной, серной и азотной кислот. В каждую пробирку внесите кусочек меди.
Что наблюдаете? Нагрейте пробирки на пламени спиртовки. Наблюдайте выделение газа в пробирке с азотной кислотой.
Проделайте аналогичный опыт с концентрированными кислотами. Что отмечается? Напишите уравнения реакций.
Сделайте общий вывод о реакционной способности металлов различной активности с кислотами.
Опыт 3. Взаимодействие металлов с растворами щелочей
В 4 пробирки налейте по 5, 6 капель 2н раствора щелочи и поместите в первую два микрошпателя порошка алюминия, во вторую – кусочек цинка, в третью – кусочек железа, а в четвертую – кусочек меди. Что наблюдаете? Подогрейте пробирку в пламени спиртовки. Видны ли изменения? Запишите уравнения реакции для тех металлов, где наблюдалась реакция.
Какие ионы в данных реакциях являются окислителями? Назовите еще 2, 3 металла, которые ведут себя подобно алюминию.
Опыт 4. Взаимодействие металлов с растворами солей
В 3 пробирки налейте по 1/3 их объема: в одну – раствор дихлорида олова, в другую – раствор сульфата меди, а в третью – раствор сульфата магния. Опустите во все пробирки по грануле цинка. Что образуется на поверхности металла? Составьте уравнения реакции. Какими химическими свойствами обладают положительные ионы металлов?
Опыт 5. Анализ сплавов
Открытие железа. На чистую поверхность сплава, содержащего железо, нанесите 3 капли разбавленной азотной кислоты, через минуту добавьте 2 капли концентрированной азотной кислоты. Через 2 мин перенесите этот раствор с помощью пипетки в две микропробирки. В одну из пробирок добавьте 2 капли раствора гексацианоферрата (III) калия. Растворы в пробирках окрашиваются в темно-крас- ный и синий цвета. Составьте уравнения реакций.
Открытие никеля. На чистую поверхность стали нанесите 2, 3 капли азотной кислоты. Через 2–3 мин снимите этот раствор полоской фильтровальной бумаги и добавьте каплю раствора диметилглиокси-
73
ма (реактива Чугаева). Появление розово-красного пятна указывает на наличие никеля.
Открытие алюминия. На чистую поверхность сплава, содержащего алюминий, нанесите 2, 3 капли раствора щелочи. Если через 2–3 мин замечается «вскипание» жидкости и выделение газа (какого?), то данный сплав содержит алюминий.
Контрольные вопросы
1.Охарактеризуйте положение алюминия в Периодической системе элементов Д. И. Менделеева.
2.Почему, находясь в ряду напряжений намного левее водорода, алюминий не вытесняет его из воды, но легко вытесняет из водного раствора щелочи?
3.Почему алюминий легко реагирует с соляной кислотой и не взаимодействует с азотной кислотой?
4.Объясните валентность железа с точки зрения квантово-меха- нических представлений.
5.Объясните наличие высшей степени окисления у марганца.
6.Почему элементарные металлы проявляют восстановительные свойства?
7.Какие металлы используются на практике в качестве восстановителей?
8.Какие соединения металлов могут выступать в роли окисли-
телей?
9.Как взаимодействуют металлы с кислотами, щелочами, водой?
10.Как можно определить наличие алюминия, железа, никеля
всплавах?
Библиографический список
1.Коровин, Н. В. Общая химия / Н. В. Коровин. – М. : Высш. шк., 2000. – С. 341–381.
2.Фролов, В. В. Химия / В. В. Фролов. – М. : Высш. шк., 1979. –
С.302–413.
74
ЗАКЛЮЧЕНИЕ
Химия, изучающая вещества и законы их превращения, охватывает огромную область человеческих знаний. Вместе с тем перед химией стоят многие нерешенные пока задачи, такие как разработка общей теории растворов, катализа, развитие химии твердого тела и др.
Теоретические законы и эксперименты позволяют химикам синтезировать новые химические соединения, которые находят применение в практике, например, соединения благородных газов, соединения, обладающие высокотемпературной сверхпроводимостью, высокой ионной проводимостью (суперионики), фуллерены, полимеры с особыми свойствами, например, полимерные проводники первого и второго рода, соединения включения (клатраты) и слоистые соединения, конструкционная керамика, композиты и т. д.
В значительной мере благодаря успехам химии создаются новые области промышленности, например, получение топлива для атомной энергетики, полупроводниковая техника, производство интегральных и компьютерных схем, средств телекоммуникации, новых источников, крио-, плазмохимические и мембранные технологии и др.
Важная роль отводится химии в решении кардинальных проблем, стоящих перед человечеством, таких как более полная комплексная переработка природного сырья, в том числе ископаемого топлива, освоение энергии Солнца, использование сырьевых богатств Мирового Океана, борьба с болезнями, повышение плодородия почвы и продуктивности животноводства. Особенно ответственные задачи стоят перед химией в решении экологических проблем, сохранении природной среды. Кроме того развитие химии приведет к открытию новых явлений, эффектов и процессов, и новых материалов.
Химия находится в непрерывном развитии. К особенностям современной химии можно отнести более глубокое раскрытие основных законов и развитие теоретических ее основ (законов поведения электронов в атомах и молекулах, теории химической связи, разработка методов расчета структур молекул и твердых тел, теорий химической кинетики, растворов и электрохимических процессов и др.).
В практикуме изложены общие законы химии и химические процессы, которые либо не изучались, либо частично изучались в школе: квантово-механическая модель атомов и периодический закон элементов Д. И. Менделеева, модели химической связи в молекулах и твердых телах, элементы химической термодинамики, законы химической кинетики, химические процессы в растворах, а также окислительно-восста- новительные, электрохимические процессы и системы. Многие из этих вопросов закреплены соответствующими химическими опытами.
75
ПРИЛОЖЕНИЯ
Приложение 1
Образец оформления титульного листа
Сибирский государственный аэрокосмический университет имени академика М. Ф. Решетнева
Кафедра инженерной экологии
Отчеты
о лабораторных работах по химии
Выполнил студент группы
Проверил
Красноярск 2013
76
Приложение 2
Образец формы отчета о лабораторной работе
Название работы
Цель работы:
Теоретические сведения:
Экспериментальная часть:
Опыт 1:
название опыта; краткое описание опыта; наблюдения; уравнение реакции.
Вывод по результатам опыта.
Опыт 2 и т. д.
Вывод по результатам работы (исходя из цели лабораторной работы)
77
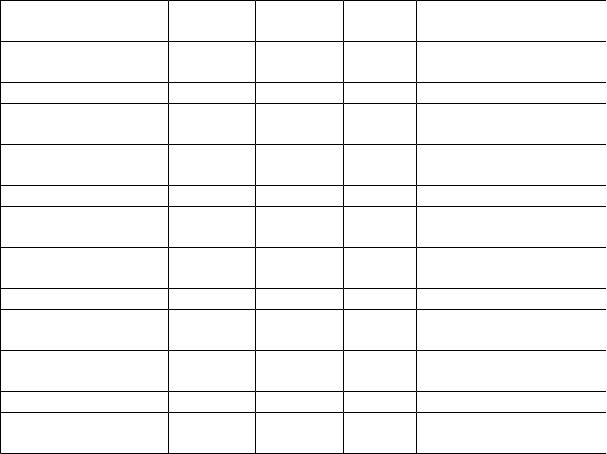
Приложение 3
|
Растворимость некоторых солей и оснований в воде |
|
||||
Анионы |
Cl– |
Br– |
I– |
NO3– |
CH3COO– |
S2– |
Катионы |
|
|
|
|
|
|
Li+ |
р |
р |
р |
р |
Р |
Р |
Na+ |
р |
р |
р |
р |
Р |
Р |
K+ |
р |
р |
р |
р |
Р |
Р |
NH+ |
р |
р |
р |
р |
Р |
Р |
Cu2+ |
р |
р |
– |
р |
Р |
Н |
Ag+ |
н |
н |
н |
р |
Р |
Н |
Mg2+ |
р |
р |
р |
р |
р |
– |
Ca2+ |
р |
р |
р |
р |
р |
Р |
Sr2+ |
р |
р |
р |
р |
р |
Р |
Ba2+ |
р |
р |
р |
р |
р |
Р |
Zn2+ |
р |
р |
р |
р |
р |
Н |
Hg+ |
р |
м |
н |
р |
р |
Н |
Al3+ |
р |
р |
р |
р |
р |
– |
Sn2+ |
р |
р |
р |
– |
– |
Н |
Pb2+ |
м |
м |
н |
р |
р |
Н |
Bi3+ |
– |
– |
– |
р |
– |
Н |
Mn2+ |
р |
р |
н |
р |
р |
Н |
Fe3+ |
р |
р |
– |
р |
– |
Н |
Fe2+ |
р |
р |
р |
р |
р |
Н |
78
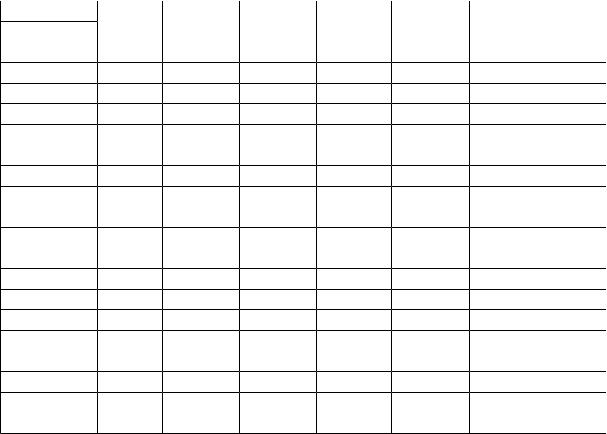
|
|
|
|
|
|
Окончание прил. 3 |
|
Анионы |
SO32– |
SO42– |
CO32– |
SiO22– |
CrO42– |
PO43– |
OH– |
катионы |
|
|
|
|
|
|
|
Li+ |
р |
Р |
р |
Р |
р |
р |
Р |
Na+ |
р |
Р |
р |
Р |
р |
р |
Р |
K+ |
р |
Р |
р |
Р |
р |
р |
Р |
NH+ |
р |
Р |
р |
– |
р |
р |
Р |
Cu2+ |
н |
Р |
– |
– |
н |
н |
Н |
Ag+ |
н |
М |
н |
– |
н |
н |
– |
Mg2+ |
н |
Р |
н |
Н |
р |
Н |
Н |
Ca2+ |
н |
М |
н |
Н |
м |
Н |
М |
Sr2+ |
н |
Н |
н |
Н |
м |
Н |
М |
Ba2+ |
н |
Н |
н |
Н |
н |
Н |
Р |
Zn2+ |
н |
Р |
н |
Н |
н |
Н |
Н |
Hg+ |
н |
– |
– |
– |
н |
Н |
– |
Al3+ |
– |
Р |
– |
н |
– |
Н |
Н |
Sn2+ |
– |
Р |
– |
– |
– |
Н |
– |
Pb2+ |
н |
Н |
н |
н |
н |
Н |
Н |
Bi3+ |
н |
– |
н |
– |
н |
Н |
Н |
Mn2+ |
н |
Р |
н |
н |
н |
Н |
Н |
Fe3+ |
– |
р |
– |
н |
– |
Н |
Н |
Fe2+ |
н |
р |
н |
н |
– |
Н |
н |
79
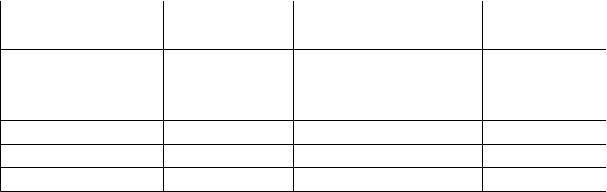
|
|
|
Приложение 4 |
Энтальпии растворения некоторых солей при 20 °С |
|||
Вещество |
Hраств, |
Вещество |
Hраств, |
|
кДж/моль |
|
кДж/моль |
Na2CO3(т) |
–23,31 |
Na2CO3 · 10H2O(т) |
+67,35 |
Na2SO4(т) |
–2,30 |
Na2SO4 · 10H2O(т) |
+78,54 |
CaCl2(т) |
–75,32 |
CaCl2 · 6H2O(т) |
+19,09 |
CuSO4(т) |
–66,53 |
CuSO4 · 5H2O(т) |
+11,93 |
ZnSO4(т) |
–77,16 |
ZnSO4 · 7H2O(т) |
+17,84 |
Na2HPO4(т) |
–23,61 |
Na2HPO4 · 12H2O(т) |
+95,58 |
Примечание. Значения энтальпий растворения относятся к растворению 1 моля вещества в 400 (в некоторых случаях и большем числе) молей воды. При дальнейшем разбавлении растворов значения энтальпий растворения существенно не изменяются.
80
