
методичка Миронова.Жереб.Чижевская.Химия.2013
.pdf
протекают катодные, а на других – анодные процессы. В качестве примера электрохимической коррозии рассмотрим действие серной кислоты H2SO4 на технический цинк, содержащий примеси железа.
На поверхности такого цинка возникает множество микроскопических гальванических элементов Zn || H2SO4 || Fe.
При контакте двух металлов анодом всегда является тот, у которого меньше величина потенциала, т. е. цинк служит анодом, а железо – катодом. На цинке протекает анодный процесс:
Zn0 ®Zn+2 +2e– (окисление, коррозия цинка).
Катодный процесс протекает на железе и связан с выделением водорода (водородная деполяризация происходит в кислой среде,
если pH < 7):
2H+ +2e– ® 2H0 ®H2 (восстановление, водородная деполяризация).
Обычно при электрохимической коррозии катодные процессы зависят от рН среды: если рН < 7 (кислая среда), то на катоде происходит водородная деполяризация (см. выше); при рН > 7 (нейтральная или основная среда) происходит ионизация (восстановление) кислорода или кислородная деполяризация. За катодный процесс отвечает вода и растворенный в ней кислород: они присоединяют электроны, образуя гидроксогруппу:
pH ³ 7: 2Н2О + О2 + 4e– ®4ОН– (катодный процесс).
При описании коррозионных явлений окисляющийся металл называют анодом, а процесс окисления – анодным. Металл, на котором электроны переходят к окислителю, называют катодом, а процесс восстановления – катодным (по аналогии с гальваническими элементами).
В случае контакта разнородных металлов в результате различия стандартных электродных потенциалов этих металлов возникает разность потенциалов. При этом более активный электрохимический металл разрушается и становится анодом, а менее активный металл – катодом.
Однако даже на безукоризненно однородной поверхности металла, согласно уравнению Нернста:
DЕ = DЕ0 + RT ´ln C1 nF C2
61
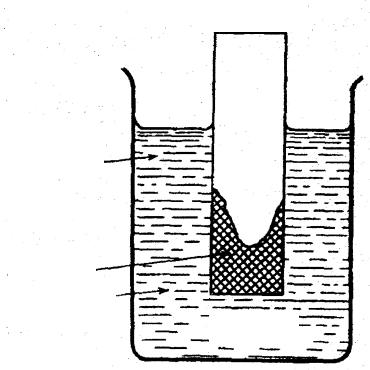
могут образоваться анодные и катодные участки, если на различных частях поверхности разная концентрация электролита. Примером может служить электрохимическая коррозия вследствие неравномерной аэрации (насыщения воздухом). Замечено, что пластина металла, опущенная в воду, ржавеет вследствие неодинаковой доставки кислорода к различным участкам поверхности металла (рис. 7.1). Участки металла, соприкасающиеся с раствором, содержащим больше кислорода, становятся катодными: в них металл не растворяется, а на металле происходит катодная реакция:
2Н2О + О2 + 4e– →4ОН–
Участки с меньшей концентрацией кислорода являются анодами, и там начинается коррозия:
Fe0 →Fe2+ + 2e–
Воздух
Железо
Много
кислорода
Ржавчина
Мало кислорода Раствор
Рис. 7.1. Коррозия железа вследствие неравномерной аэрации
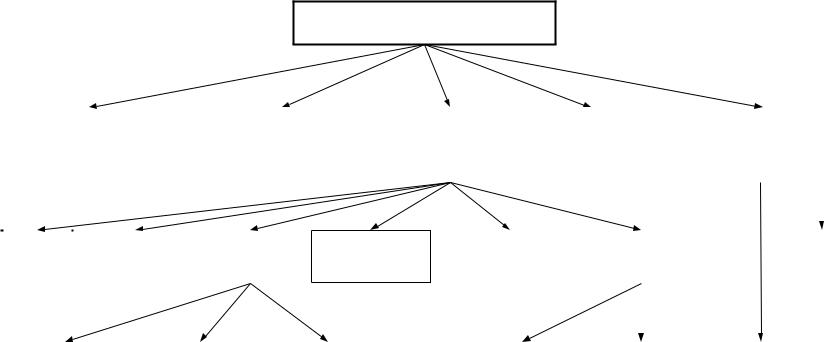
Способы защиты металлов от коррозии. Цель защитных мер – максимально затормозить скорость коррозионного процесса. Этого обычно достигают воздействием либо на металл, либо на среду, либо на поверхность раздела металл-среда (рис. 7.2).
Радикальным методом защиты от коррозии путем воздействия на металл является замена самого металла на его оксид или полимер
62
либо создание коррозионно-стойких сплавов. К средствам воздействия на металл относится электрохимическая защита, когда защищаемый
63
Способы защиты откоррозии
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изменение свойств |
|
Применение |
|
Защитные по- |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
Замена |
|
|
|
Электрохимическая |
|
||||
|
Изменение свойств |
|
|
|
Применение коррозионно- |
|
|
|
Защитные |
|
|
|
металлов |
|
|
|
Электрохимическ я защита |
|
|
|
коррозионной среды |
|
|
|
коррозионно-стойких |
|
|
|
крытия |
|
|
|
|
|
|
|
|||
|
коррозионной среды |
|
|
|
стойких сплавов |
|
|
|
покрытия |
|
|
|
полимерами |
|
|
|
защита |
|
|
|
|
|
|
|
сплавов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Смазки, |
|
|
|
|
|
|
|
|
Адсорбционные |
|
|
|
|
|
|
|
|
Протектор- |
|
|
|
|
|
|
|
Химическиеие |
|
|
|
|
|
|
|
Металли- |
|
|||||
|
|
|
Эмалирование |
|
|
|
|
|
|
Полимерные |
|
|
||||||||
|
лаки, |
|
|
Эмалирование |
|
|
защитные |
|
|
Адсорбционные |
|
|
|
|
Металлические |
|
|
Протекторная |
||
|
|
|
|
|
|
|
защитные |
|
|
покрытия |
|
|
чес-кие по- |
|
|
ная защита |
||||
|
краски |
|
|
|
|
|
пленкие |
|
|
защитные пленки |
|
|
|
|
покрытия |
|
|
защита |
||
|
|
|
|
|
|
|
|
пленки |
|
|
|
|
|
крытия |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оксидирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Катоднаяи |
|
|
|
|
Фосфа- |
|
Пасси- |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Катодныеные |
|
|
|
Анодные |
|
|||||
|
Оксидирование |
|
|
|
Фосфатирование |
|
|
|
Пассивирование |
|
|
|
|
|
|
Анодные |
|
|
ианодная |
|
|
|
|
|
|
тиро-вание |
|
|
|
виро-вание |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 7.2. Схема способов защиты металлов от коррозии
64
металл подвергается катодной поляризации от внешнего источника (катодная защита) или созданием электрического контакта с более активным металлом (протекторная защита).
Воздействовать на среду можно путем удаления агрессивных агентов (окислителей). Если этого сделать нельзя, то для замедления процесса в жидкой и газовой среде следует применять специальные вещества – ингибиторы коррозии. Наиболее широко используются для защиты от коррозии средства воздействия на поверхность раздела металл – окружающая среда. Как правило, это защитные покрытия. Нанесение защитных покрытий механически изолирует поверхность металла от окружающей среды, а также изменяет ее электрохимические свойства.
Пассивирование металлов осуществляется путем образования на их поверхности пассивирующих пленок из оксидов или труднорастворимых солей.
При оксидировании происходит уплотнение защитной оксидной пленки. Оксидирование осуществляется химическим и электрохимическим способами.
Металлические покрытия из металлов, устойчивых к коррозии (Zn, Sn, Ni, Ag, Cr), наносят путем электролиза (гальваностегии).
По характеру защитного действия различают анодные и катодные металлические покрытия. Анодными называются такие покрытия,
вкоторых покрывающий металл имеет более отрицательный потенциал. Например, анодным является цинковое покрытие на железо. При нарушении целостности покрытия возникают гальванопары,
вкоторых роль анода будет выполнять цинк. Катодными являются такие покрытия, в которых покрывающий металл имеет более положительный электродный потенциал, например, железо покрыто оловом (Sn на Fe).
Методика и порядок проведения работы
Опыт 1. Коррозия, возникающая при контакте двух различных металлов
Впробирку внесите 8–10 капель 1н раствора серной кислоты
ипоместите туда гранулу цинка. Наблюдайте медленное выделение водорода. Введите в раствор медную проволоку, не доводя ее до соприкосновения с цинком. Наблюдается ли выделение водорода на меди? Погрузите медную проволоку глубже, чтобы она контактирова-
65
ла с цинком. Объясните выделение водорода на меди в этом случае. Составьте схему действия образовавшейся гальванопары. Как повлиял на коррозию цинка контакт с медью?
Опыт 2. Коррозия в результате различного доступа кислорода (аэрационная коррозия)
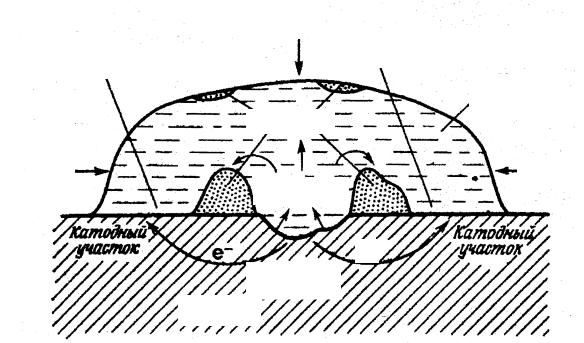
Очистите стальную пластинку наждачной бумагой, промойте и вытрите фильтровальной бумагой. На чистую поверхность нанесите каплю специального реактива, состоящего из 3%-го раствора хлорида натрия, к которому добавлен фенолфталеин и гексацианоферрат (III) калия K3[Fe(CN)6] (рис. 7.3). Наблюдайте появление синего окрашивания в центре капли и розового по ее окружности.
Составьте схему действия гальванопары, возникающей при различной аэрации металлической поверхности. Чем вызвано появление розовой окраски у краев капли?
Примечание. Гексацианоферрат (III) калия K3[Fe(CN)6] добавлен как реактив на ионы Fe+2.
Опыт 3. Активирующее действие ионов хлора
Поместите в 2 пробирки по кусочку алюминиевой проволоки и прилейте к ним раствор сернокислой меди, слегка подкисленный серной кислотой.
В одну из пробирок добавьте 4, 5 капель 10%-го раствора хлорида натрия. В каком случае скорее протекает реакция? Объясните результат опыта и составьте схему действия образовавшихся гальванопар.
Опыт 4. Электрохимическая коррозия оцинкованного и луженого железа
Налейте в 2 пробирки на 0,5 ее объема специальный раствор, состоящий из гексацианоферрата (III) калия и 2н раствора серной кислоты. Две железные проволочки очистите наждачной бумагой. Концом одной проволочки плотно обмотайте кусочек цинка, другой – кусочек олова. Опустите каждую проволочку в одну из пробирок с приготовленным раствором.
66
О2
2Н2О + О2 + 4е– → 4ОН–
2Н2О + О2 + 4е– → 4ОН–
Капля
раствора
Ржавчина
О2 |
О2 |
Fe2+ |
Fe2+ |
Катодный |
|
|
|
|
|
|
е– |
Катодный |
|
участок |
|
е– |
участок |
|
|
|
|
|
|
|
|
|
|
|
Анодный
участок
Железо
Рис. 7.3. Коррозия железа под каплей раствора хлорида натрия
Через несколько минут наблюдайте появление окрашенного в синий цвет раствора, в который погружена проволочка с оловом. Объясните образование ионов Fe+2 в этом растворе, учитывая, что железо и олово образуют гальваническую пару. На поверхности какого металла выделяется в этом случае водород? Почему раствор не окрасился в синий цвет, когда была опущена проволочка с цинком? Приведите схему перехода электронов в гальванической паре железо-цинк. Ионы какого металла переходят в раствор в данном случае? Почему?
Составьте схему электрохимической коррозии луженого и оцинкованного железа, сопровождающейся образованием микрогальванопар. В каком случае при местном разрушении защитного покрытия (цинка или олова) будет проходить коррозия железа под остающимся неизменным защитным покрытием? В каком случае будет разрушаться защитное покрытие при относительной неизменности железного изделия?
Опыт 5. Оксидирование стали
Очистите наждаком две стальные пластинки. Одну из них нагрейте в пламени спиртовки до появления окисных пленок, которые из-за своей различной толщины вызывают различную интерференцию света и поэтому окрашены в разные цвета. Нанесите по капле раствора сульфата меди на оксидированный и неоксидированный образцы.
По скорости появления темного пятна на образцах оцените защитные свойства нанесенной пленки.
67
Опыт 6. Электрохимическая защита
В пробирку внесите 5–10 капель 1н уксусной кислотой и прибавьте несколько капель раствора йодида калия KI, поместите цинк и свинец в контакте друг с другом. Другой образец свинца для сравнения поместите в другую пробирку с тем же раствором. Где скорее появится желтое окрашивание (йодид свинца имеет желто-золотистый цвет)?
Составьте схему действия гальванопары. Объясните результаты опыта.
Опыт 7. Применение ингибиторов
В3 пробирки внесите по 7 капель 0,2н раствора серной кислоты
ипо 1 капле раствора гексацианоферрата (III) калия (индикатор на ионы Fe2+ – синее окрашивание). В первую пробирку добавьте микрошпатель уротропина. Опустите в первую и вторую пробирки железные проволоки, предварительно протравленные соляной кислотой, а в третью – проволоку, покрытую ржавчиной. Отметьте время появления и интенсивность синей окраски в каждой пробирке. Почему они различны? Какова роль уротропина и ржавчины?
Контрольные вопросы
1.Дайте определение понятия «коррозия металлов».
2.Перечислите виды коррозии.
3.Как в случае нарушения целостности покрытия будет протекать в кислой среде коррозия железа: а) покрытого медью; б) покрытого марганцем?
4.Коррозия железа будет протекать быстрее в случае а) луженого железа; б) оцинкованного железа. Приведите схему работы микрогальванопар.
5.Какие методы защиты металлов от коррозии существуют?
6.Какие покрытия называются катодными, а какие – анодными?
7.Напишите уравнения химических процессов, протекающих на электродах при электролитическом никелировании.
8.Какой процесс называется оксидированием? Приведите пример.
Библиографический список
1.Коровин, Н. В. Общая химия / Н. В. Коровин. – М. : Высш. шк., 2000. – С. 310–340.
2.Фролов, В. В. Химия / В. В. Фролов. – М. : Высш. шк., 1979. –
С.522–548.
68
Лабораторная работа 8
МЕТАЛЛЫ
Цель работы: ознакомиться с общими свойствами металлов.
Теоретические сведения
Свойствами металлов обладает большинство элементов, входящих в периодическую систему Д. И. Менделеева (прил. 9). Элементы с металлическими свойствами могут относиться к типу s-, p-, d- или f-элементов.
Все металлы обладают общими так называемыми металлическими свойствами, но каждый элемент проявляет их в соответствии с его положением в периодической системе Д. И. Менделеева, т. е. в соответствии с особенностями строения его атома. В зависимости от того, какой подуровень у атома металла заполняется электронами, проявляются общие химические свойства. Особенностью металлов является их способность к образованию металлической связи, которая определяет их физические свойства.
Металлы служат основным конструкционным материалом в машиностроении и приборостроении. Это объясняется тем, что они подвергаются механической обработке благодаря таким их свойствам, как прочность, пластичность, ковкость, тягучесть, обладают хорошей тепло- и электропроводностью. Металлам присущи также металлический блеск, обусловленный их способностью хорошо отражать свет, и непрозрачность. В высокодисперсном состоянии металлы обычно имеют черный цвет и не блестят. Атомы элементов, обладающих металлическими свойствами, содержат мало электронов на внешних электронных уровнях (1–3), и из-за сравнительно больших размеров атома они значительно удалены от ядра. Поэтому в химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов:
Me0 →Men+ +ne–
и, как следствие, способностью образовывать положительно заряженные ионы. В связи с этим металлы в свободном состоянии способны проявлять только восстановительные свойства, хотя и в различной степени.
69
Металлы проявляют в своих соединениях только положительную степень окисления, а низшая степень окисления, которой они обладают только в свободном состоянии, равна нулю.
Если металлу присущи несколько степеней окисления, то соединения, в которых он проявляет низшую из них, также обычно являются восстановителями, например соединения меди (I), олова (II), железа (II). Окислителями могут быть те соединения, металлов, в которых степень окисления металла велика: равна номеру группы, в которой находится металл, или близка к нему. На практике в качестве окислителей применяют аммиачный раствор оксида серебра, хлорид железа (III), диоксид свинца, диоксид марганца, хромат и дихромат калия, перманганат калия и др.
Восстановительная способность свободных металлов проявляется при взаимодействии их с элементарными окислителями, обладающими окислительными свойствами.
Большинство металлов легко взаимодействуют с галогенами с образованием высших галогенидов металлов. Металлы взаимодействуют с кислородом менее энергично. С образованием нормальных оксидов. С азотом многие металлы вообще не взаимодействуют, что объясняется очень большой энергией диссоциации окислителя.
Взаимодействие металлов с кислотами, щелочами и водой различно и зависит от активности металлов и их специфических свойств, определяемых положением в Периодической системе элементов Д. И. Менделеева.
Химически активные металлы вступают во взаимодействие с водой при комнатной температуре, выделяя водород:
Me + nH2O →Me(OH)n + n/2H2 −
Металлы менее активные взаимодействуют с водой лишь при нагревании:
Me + nH2O →MeO + n/2H2 −
Действие воды на металлы усиливается в присутствии растворенного в воде кислорода. Некоторые малоактивные металлы при этом окисляются по следующей схеме:
Me + n/2H2O + n/4O2→Me(OH)n
Со щелочами могут реагировать металлы, образующие амфотерные оксиды, или соединения металлов в высшей степени окисления, в присутствии сильных окислителей:
Me0 + H2O + OH– →MeO2– + 3/2H2 2Me0 + 7Na2O2 + 6H2O →2NaMeO4 + 12NaOH
70
