
6 курс / Эндокринология / ЭХОСЕМИОТИКА_АУТОИММУННЫХ_ЗАБОЛЕВАНИЙ_ЩИТОВИДНОЙ_ЖЕЛЕЗЫ
.pdf
260
Глава 7
ЭХОСЕМИОТИКА АУТОИММУННЫХ ЗАБОЛЕВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Одноизцентральныхмествструктуретиреоиднойпатологиизанимают«зоб»Хашимото [9, 13, 24, 35] идиффузный токсический зоб (ДТЗ) [7, 13, 16]. Они представляют собой две отдельные нозологические формы заболеваний ЩЖ и отличаются друг от друга по характерупатоморфологическихизмененийтиреоиднойпаренхимы,клиническойсимптоматикеисвоим последствиям[3, 6, 7]. МетодылеченияДТЗи тиреоидитаХашимото также принципиально отличаютсядруг отдруга [1, 10, 26].
ВосноверазвитияДТЗлежитдиффузнаягиперплазияклетокфолликулярногоэпителия ирезкоевозрастаниеихгормонопродуцирующейактивности[7, 10, 11, 18].Врезультате возрастанияуровня ТЗи Т4вкрови, убольныхДТЗпоявляютсяипрогрессируютсимптомы тиреотоксикоза(стойкаятахикардия,экзофтальм,похуданиеприповышенномаппетитеи др.). До разработки адекватных методов лечения больные ДТЗ умирали в очень молодом возрасте,вбольшинствеслучаев—вследствиенарастающейсердечнойнедостаточности («тиреотоксическое сердце»). Широко применяемые в настоящее время методы радиойод- ихимиотерапиипозволяютдобиться сниженияуровня ТЗи Т4 [7, 10, 18], уменьшения илиполногоисчезновения симптомов тиреотоксикоза [11, 13, 16] и, какследствие, значительного увеличения продолжительности жизни больныхДТЗ [19, 26]. В основе этого лечебногоэффекталежитразрушениечаститиреоиднойпаренхимыподвлияниемвысоких доз облучения радионуклидами йода («радиорезекция» ЩЖ) или резкое угнетение функциональнойактивностиклетокфолликулярногоэпителияЩЖподдействиемтиреостатиков[11, 13, 18, 19].
ВотличиеотДТЗ,тиреоидитХашимотонеимеетпатогномоничныхсимптомовипротекает обычно «под маской» узлового эутиреоидного зоба [1, 3, 6, 17, 20]. В основе этого заболевания лежит инфильтрация лимфоцитов в ткань ЩЖ [24, 35]. Здесь происходит размножение идифференцировка лимфоидных клеток, их взаимодействие с фолликулярными клетками ЩЖиразрушение тиреоидной паренхимы [23, 27]. Эти изменения сочетаютсясразвитиемфибробластическойреакцииперифолликулярнойстромыЩЖ[1,3,17]. Конечным итогом суммы этихпроцессовявляется замещение фолликулярного эпителия соединительной тканью с образованием полей фиброза [3, 20]. В отличие от ДТЗ, для позднихстадийтиреоидитаХашимотохарактерноразвитиесимптомовгипотиреоза,обусловленное уменьшением в крови уровня ТЗ и Т4 [1, 3, 35]. Соответственно, в комплексном лечениибольных«зобом»Хашимотоважноеместозанимаютметодызаместительнойтерапии тироксином [23].
Несмотря на описанные выше различия патоморфологических изменений ЩЖ и особенностиклиническойсимптоматики, тиреоидитХашимотоидиффузныйтоксическийзоб нередко объединяют в одну группу заболеваний [19, 28, 29]. В настоящее время убедительно доказано, что в патогенезе этих, казалось бы, различных заболеваний, ключевую рольиграютаутоиммунныепроцессы[9,13,23,35].Причинойразвитиягиперплазиитире- оцитовприДТЗ[8,14,22,36]иинфильтрациилимфоцитов—притиреоидитеХашимото [6, 13, 23] являются нарушения в системе взаимодействия иммунокомпетентных клеток со щитовидной железой. В обоих случаях в организме больных происходят изменения, в результатекоторыхмакромолекулярныекомпонентыихсобственнойщитовиднойжелезы начинают восприниматься иммунной системой как чужеродные антигены [29, 33]. И при тиреоидите Хашимото [4, 6, 9, 12] и при ДТЗ [5, 8, 25] вырабатываются «антитиреоидные» антитела, поступающие в кровь (циркулирующие аутоантитела) или встраивающиеся в

261
мембранулимфоцитов(«фиксированныеаутоантитела»).ТиреоидитХашимотоиДТЗявляютсятипичнымипримерамит.наз.органоспецифическихаутоиммунныхзаболеваний(29, 35). «Органом-мишенью» при каждом из них является щитовидная железа [1, 3, 5, 9, 12, 28].
До сих пор продолжаются дискуссии о причинах, приводящих к развитию аутоиммунных сдвиговпритиреоидитеХашимотоиДТЗ[29,33].Вместестем,динамикаэтихпроцессов изучена достаточно подробно. Так, детально охарактеризованы многие из макромолекулярныхкомпонентов ткани ЩЖ, ккоторымвырабатываютсяаутоантитела [6, 9, 24, 33, 35]. Показано, что особенности патологических изменений, развивающихся в ткани ЩЖ при ДТЗ и тиреоидите Хашимото, во многом обусловлены спецификой «антиген-распознаю- щих»участковэтихантител[14, 22, 32].Другимисловами, иммуноглобулины, титр которых резковозрастаетприэтихзаболеваниях, взаимодействуют, посути, сразнымибелками тиреоцитов [6, 33, 35].
Ключевым звеном в патогенезе диффузно-токсического зоба является продукция иммунокомпетентнымиклеткамибольногоциркулирующихаутоантител,направленныхпротив белков поверхностноймембраны тиреоцитов[5, 8, 14, 22, 25]. ПриДТЗ вырабатываются циркулирующиеантитела,взаимодействующиесТСГ-рецепторамитиреоцитов(структура ифункцияТСГ-рецепторов—см.главуIмонографии).Эти,т.наз.«тиреоид-стимулирую- щиеантитела»(ТСА)обладаютспособностьюимитироватьдействиетиреотропногогормона: вызывать резкое возрастание скорости синтеза и секреции тироксина [22, 25, 36, 37].ТСАиндуцируюттакжеувеличениепролиферативнойактивноститиреоцитовивызываютдиффузнуюгиперплазиюфолликулярногоэпителияЩЖприДТЗ[21,30].Вразвитии симптомов тиреотоксикоза важное место отводяти т.наз. «thyrotropin binding inhibitings immunoglobulin»(TBII). Считают, чтоТСАиТВНпредставляютсобойдваклассаиммуноглобулинов, отличающихся друг от друга антиген связывающими центрами [31, 36, 37]. ОбщимконечнымэффектомТВНиТСАявляетсяихспособностьвызыватьвозрастаниефункциональнойактивноститиреоцитов[32, 35].
Вкровибольныхаутоиммуннымтиреоидитомтакжепоявляются«антитиреоидные»антитела [1, 2, 6, 9, 28]. Однако, в отличие от ТСА и ТВН, циркулирующие аутоантитела при тиреоидитеХашимотонаправленыпротивдругихмакромолекулярныхкомпонентовтиреоцитов - тиреоглобулина (структура и функция ТГ— см. более подробно в главе I) и микросомальногоантигена(МА)щитовиднойжелезы[2, 6,24,35]. Микросомальныйантигенна самомделепредставляетсобойтиреоидпероксидазу-ключевойферментсинтезатирок- сина и трийодтиронина (структура и функция 7770 — см. более подробно I главу монографии).МолекулыэтогоферментапрочносвязанысмембранойэндоплазматическогоретикулумаиприультрацентрифугированиивыходятвсоставемикросомальнойфракцииЩЖ [9, 12, 24, 35]. ОпределениеуровняантителкТГиМАширокоиспользуетсявдиагностике тиреоидита Хашимото [2, 6, 9, 23, 24, 33].
Появление циркулирующихаутоантителк ТГиМА в крови больныхтиреоидитомХашимотоявляетсяважным, нонеединственныминеглавнымфеноменом, приводящимкразрушениютканиЩЖ.Значительноболеесущественнымидляразвитияэтогозаболевания представляютсобой клеточные иммунныереакции [4, 23, 27, 33, 35]. При тиреоидитеХашимотопроисходитразмножениет.наз.«запрещенныхклонов»лимфоцитов[28,33].Эти лимфоцитыспособныксинтезуаутоантителпротивбелковсобственнойщитовиднойжелезы [29]. Уздоровыхлюдей эти клетки находятся в неактивном состоянии и не способны к делению [32]. В силу ряда до сих пор еще не установленных причин у больных тиреоидитомХашимотопроисходитактивизация«запрещенныхклонов»лимфоцитов.Онивыходят из костного мозга в кровь и, при прохождении по кровеносным сосудам ЩЖ «задерживаются»втиреоиднойпаренхиме.Приэтомвкачестве«вектора»,осуществляющеговзаимодействие«запрещенных»лимфоцитовсклеткамиЩЖ,используютсят.наз.«фиксирован-
ныеантитела».ЭтиантителанаправленыпротивбелковсобственнойЩЖ,но,вотличиеот циркулирующихаутоантителкТГиМА, «встроены»вповерхностнуюмембранулимфоцитов — клеток, которыми они и былисинтезированы [33, 35]. После фиксации в ткани ЩЖ

262
лимфоциты подвергаются делению с образованием т.наз. «центров размножения» [1, 23]. Морфологическиэтопроявляется ввидеинфильтрации тканиЩЖлимфоиднымиэлементами[26].
Лимфоциты,поступившиевтканьЩЖ,выделяютрядбиологическиактивныхсоединений, индуцирующих развитие деструктивных изменений в тиреоидной паренхиме [24, 28, 33].Вреализацииэтогоэффектаважнаярольпринадлежиттакжемакрофагам,выделяющимгидролитическиеферментыибиологическиактивныефакторы, обладающиеразрушающимдействием [35]. Деструкция тиреоидной паренхимы происходит и в результате процессов,опосредуемыхциркулирующимиантителами(антитело-зависимаяклеточная цитотоксичность).Вэтихслучаяхиммуноглобулины,главнымобразом—антителакмик- росомальномуантигену—активизируютт.наз.клетки-киллеры(отсловаtokill—убивать).
Этиклеткилимфоцитарногопроисхожденияобладаютнаиболеевыраженнойспособностью к разрушению [33].
Представленныевышеданныесвидетельствуютотом, чтокнастоящемувремениполученыубедительныедоказательстваключевойролиаутоиммунныхпроцессоввпатогенезе тиреоидита Хашимото и ДТЗ. Различия патоморфологических изменений ЩЖ и особенности клинической симптоматики при этих заболеваниях связаны со спецификой белков ЩЖ, ккоторым вырабатываются аутоантитела, и преобладаниемреакций клеточного иммунитетапритиреоидитеХашимото.ДоказательствомправомерностивыводовоцелесообразностиобъединениябольныхДТЗибольныхтиреоидитомводнугруппуслужаттакже многиефакты, подробного изложенные вряде обзоров имонографий [23, 33, 35]. Детальный анализ этихданных не входит в задачи настоящей монографии.
В последние годы сформировалось мнение, что в диагностике аутоиммунного тиреоидита идиффузного токсического зоба важнуюдополнительную информацию можно полу- читьспомощьюультрасонографии,дополненнойУЗ-ТПАБ[1,17,20].Возможностьнепос- редственной визуализации щитовидной железы с детальным изучением изменений ее размеров, эхогенности иэхоструктуры открываетширокие перспективыдляраннегораспознавания этих аутоиммунных заболеваний. В процессе накопления опыта мы убедились в том,чтодиагностическиезадачи,которыемогутбытьрешеныприпримененииультрасо- нографиииУЗ-ТПАБубольныхтиреоидитомХашимотоиДТЗ,такжеимеютмногообщего. Обэтом, вчастности, свидетельствуютиматериалынастоящейглавы. Здесьжемысочли целесообразным сообщить основные сведения о месте ультразвуковых методов в диагностикетиреоидитов.Этимтерминомобозначаютразнообразныепоэтиологии,патогенезу и клиническим проявлениям заболевания щитовидной железы, в основе которыхлежат воспалительные изменения тиреоидной паренхимы. Такой план изложения казался нам тем более уместным, что в последние годы аутоиммунномукомпонентууделяютвсе большеевниманиеприизученииподострыхтиреоидитов — например, тиреоидитадеКарвена.

264
7 . 1 .ТИРЕОИДИТХАШИМОТО
Аутоиммунный (хронический лимфоцитарный) тиреоидит (AT) занимает одно из центральных мест в структуре заболеваний щитовидной железы [2, 56, 66, 67]. Наиболее часто AT диагностируется у женщин старше 40 лет [1, 3, 9, 92].
Причины развития тиреоидита Хашимото до сих пор окончательно не установлены. Считают, что предрасполагающими факторами этого заболевания являются наследственные отклонения антигена гистосовместимости [6, 27, 73, 93] и возрастные изменения гормонального статуса [56, 92]. В этиологической структуре AT определенное место принадлежит вирусной инфекции [35]
иизбыточному поступлению йода с пищей
иводой [18]. В последние годы особое внимание уделяют радиогенному фактору в развитии AT [24]. Эта проблема приобрела важную практическую значимость после аварии на Чернобыльской АЭС.
Патогенез.Хроническийлимфоцитарный тиреоидит является наиболее типичным примером аутоиммунного заболевания [7- 9, 16, 17, 20, 21, 23]. Из крови больных AT выделены антитела, направленные против макромолекулярных компонентов фолликулярного эпителия собственной ЩЖ [13, 25, 91, 92]. К настоящему времени наиболее детально изучены аутоантитела к тиреоглобулину [59, 73, 78, 80], т.н. второму компоненту коллоида ЩЖ [16, 17, 72], и микросомальному антигену фолликулярного эпителия (тиреоидпероксидазе) [23, 29, 36, 37, 65]. Методы количественной идентификации антител к тиреоглобулину и к тиреоидпероксидазе широко используются в диагностике AT [16, 65, 92].
Патоморфологические изменения щитовидной железы при аутоиммунном тиреоидите обусловлены инфильтрацией лимфоцитов из крови в ткань щитовидной железы, их размножением и последующей дифференцировкой в плазматические клетки [5, 6, 88, 91]. В результате в щитовидной железе развиваются деструктивные, воспалительные и склеротические процессы [45, 48, 61, 64]. Это приводит к гетерогенным по структуре морфологическим изменениям ткани ЩЖ.
Схематически выделяют три варианта AT: 1) лимфоидный (при котором в тиреоидной паренхиме преобладают лимфоциты); 2) фиброзный (для которого характерно изобилие соединительно-тканных рубцов) и 3) фибролимфоидный (для которого характерно разрастание фиброзной и лимфоидной ткани одинаковой степени выраженности). Эта, как и многие другие классификации, не отражает всего многообразия морфологических изменений ЩЖ при хроническом лимфоцитарном тиреоидите [5, 6, 88, 92]. С практической точки зрения значительно больший интерес представляют классификации, в которых выделены диффузная и очаговая формы AT. В отличие от диффузной формы хронического тиреоидита, при которой лимфоплазмоцитарная инфильтрация поражает всю паренхиму ШЖ, при очаговой форме этого заболевания изменения происходят в ее отдельных участках [22, 43, 48, 57, 87].
Диагностика тиреоидита Хашимото затруднена из-за отсутствия четкой симптоматики [3, 4, 11, 12, 15]. Во многих случаях это заболевание протекает под «маской» диффузного и, еще чаще, многоузлового эутиреоидного зоба [22, 68, 75]. Диагностические проблемы осложняются гетерогенностью морфологических изменений щитовидной железы при AT [5, 63, 88].
Достижения в изучении механизмов развития AT стали основой для совершенствования методов иммуно-химической диагностики этого заболевания. В ранних исследованиях для диагностики AT использовались, в основном, методы определения содержания в крови аутоантител к тиреоглобулину. Однако позднее были получены данные о недостаточной информативности «антитиреоглобулинового теста» [7, 8, 18, 23, 51, 58]. Было показано, что диагностически более эффективным у больных AT является определение титра аутоантител к микросомальному антигену (МА) [16-18, 24, 59, 66, 91]. Такие данные получили и научное обоснование при оценке роли этих аутоантител в патогенезе заболевания [76-78, 92]. Установлено, что именно аутоантитела к МА (или, как оказалось позднее — аутоантитела к ти-
Раздел подготовлен совместно с Т.И.Беляевой и Н.П.Нарховой

реоидпероксидазе) взаимодействуют с системой комплемента [29, 65], обладают самостоятельным цитотоксическим действием [13, 92, 93], включают в процесс разрушения ткани ЩЖ «клетки-киллеры» [7, 8, 73, 77] и служат «вектором» для лимфоцитов, регулируя процесс инфильтрации этих клеток в тиреоидную паренхиму [25, 36, 78, 92].
Следует, однако, отметить, что несмотря на высокую информативность иммунохимических методов, с помощью только серологических тестов решить весь комплекс диагностических проблем у больных аутоиммунным тиреоидитом не представляется возможным. Это заболевание часто сочетается с развитием кист [6], аденом [5, 14] и рака щитовидной железы [50, 52, 53, 71, 90]. Еще более известны факты, указывающие на взаимосвязь AT со злокачественными лимфомами [79, 84, 86]. Пальпаторно отличить лимфоплазмоцитарные инфильтраты от других объемных образований ЩЖ очень трудно, если вообще возможно. Чрезвычайная плотность узлов при AT и их частичная неподвижность всегда вызывают подозрение на злокачественное новообразование [22, 31, 33, 46]. Это диктует необходимость дальнейшего совершенствования методов распознавания аутоиммунного тиреоидита и его отличительного разграничения от узлового эутиреоидного зоба. В последние годы для этой цели все шире используют ультрасонографию, дополненную прицельной биопсией из ЩЖ [22, 33, 43, 48, 49, 64, 88]. Такой методический подход
2 6 5
способствует не только улучшению ранней диагностики хронического лимфоцитарного тиреоидита, но и становится основой для определения стадии развития заболевания, а также подтверждения (или исключения) злокачественных опухолей ЩЖ и лимфом, часто сочетающихся с тиреоидитом Хашимото [26, 54, 57, 61, 71, 74, 82, 90]. Об этом, в частности, свидетельствуют и результаты проведенных нами исследований.
Ультрасонографияиприцельная биопсиявдиагностикетиреоидитаХашимото. Под нашим наблюдением находился 501 больной аутоиммунным лимфоцитарным тиреоидитом. Диагноз был установлен во время клинико-инструментального скрининга заболеваний ЩЖ у населения Калужской, Тульской, Смоленской и Брянской областей, а также — в ходе комплексного исследования пациентов, находившихся на стационарном лечении в МРНЦ РАМН.
Основой для формулирования окончательных заключений о наличии признаков аутоиммунного тиреоидита служили данные ультразвукового исследования ЩЖ, определения титра антител к микросомальному антигену ЩЖ, результатов цитологического исследования аспиратов, полученных с помощью тонкоигольной аспирационной биопсии под ультразвуковым контролем (УЗ ТПАБ) гистологических заключений. Среди находившихся под нашим наблюдением больных AT преобладали женщины в возрасте старше 21-50 лет (таблица 47).
Таблица 47
Распределение больных аутоиммунным тиреоидитом по возрасту и полу
Возраст (годы) |
Пол |
|
|
Всего |
|
|
|
|
|
|
Ж |
М |
абс. |
% |
До 10 лет |
32 |
30 |
62 |
12.4 |
11-20 |
42 |
26 |
68 |
13.6 |
21 - 30 |
47 |
21 |
68 |
13.6 |
31 -40 |
75 |
34 |
109 |
21.8 |
41 - 50 |
82 |
21 |
103 |
" 20.4 |
51 и более |
73 |
18 |
91 |
18.2 |
Всего |
351 |
150 |
501 |
100.0 |

2 6 6 |
|
|
|
|
Эхосемиотика. При развитии хроничес- |
эхогенности ткани ЩЖ в виде множествен- |
|||
кого лимфоцитарного тиреоидита на ульт- |
ныхгипоэхогенныхучастков(рис.223).Ло- |
|||
расонограммах регистрируются, по крайней |
кальные изменения акустической плотнос- |
|||
мере, два и иногда три типа изменений: 1) |
ти ткани ЩЖ приводят к нарушению гомо- |
|||
изменение эхогенности в виде гипоэхо- |
генности тиреоидной паренхимы (таблица |
|||
генных участков различного размера и фор- |
48). На ультрасонограммах визуализируют- |
|||
мы, нарушающих гомогенность железы; 2) |
ся гипоэхогенные участки различных разме- |
|||
изменение размеров ЩЖ в виде умень- |
ров, не имеющие четких границ и опреде- |
|||
шения или увеличения объема органа; 3) из- |
ленной локализации (см.рис. 223). Обнару- |
|||
менение эхоструктуры в виде формиро- |
жение на эхограммах ЩЖ гипоэхогенных |
|||
вания объемных образований различной |
участков обусловлено появлением лимфо- |
|||
морфологической природы — кист, аденом, |
идноплазмоцитарных инфильтратов в тирео- |
|||
рака, узлов и др. |
идной паренхиме [56]. Такое заключение |
|||
Дополнительными критериями, указыва- |
было нами подтверждено в специально про- |
|||
ющими на развитие AT, являлось появле- |
веденном исследовании, основанном на рет- |
|||
ние гиперэхогенных участков, сглаживание |
роспективном сопоставлении результатов |
|||
границ между передним краем ЩЖ и мыш- |
ультразвукового исследования ЩЖ и дан- |
|||
цами шеи, бугристая деформация ЩЖ в |
ных УЗ-ТПАБ. При цитологическом изучении |
|||
области ее задней поверхности. |
материала из участков с пониженной эхо- |
|||
Изменение эхогенности ЩЖ. Наиболее |
генностью в большинстве случаев в аспи- |
|||
ратах были идентифицированы лимфоциты |
||||
патогномоничным ультразвуковым призна- |
||||
и плазматические клетки. |
|
|||
ком AT является неравномерное снижение |
|
|||
|
|
|
||
|
|
|
Таблица 48 |
|
Особенности эхосемиотики щитовидной железы |
|
|
||
у больных аутоиммунным тиреоидитом |
|
|
||
Ультразвуковые признаки патологии |
|
Частота |
|
|
|
абс. |
|
% |
|
Неравномерное снижение эхогенности ткани ЩЖ |
|
|
||
за счет гипоэхогенных участков |
|
|
|
|
+ |
501 |
|
100 |
|
Размеры гипоэхогенных участков |
|
|
|
|
до 3 мм |
175 |
|
35 |
|
до 6 мм |
150 |
|
30 |
|
до 10 мм |
150 |
' |
30 |
|
свыше 10 мм |
26 |
. |
5 |
|
Площадь гипоэхогенных участков |
|
|
|
|
до 20% |
40 |
|
8 |
|
до 50% |
250 |
|
50 |
|
более 50% |
211 |
|
42 |
|
Гиперэхогенные включения |
|
|
|
|
+ |
126 |
|
25 |
|
|
375 |
|
75 |
|
Характеристика контуров переднего края |
|
|
|
|
не изменены |
110 |
|
22 |
|
незначительное снижение четкости |
210 |
|
42 |
|
резкое снижение четкости |
181 |
" |
34 |
|
Характеристика контуров задней поверхности |
|
|
|
|
не изменены |
4 |
|
0.8 |
|
незначительная деформация |
159 |
|
31.6 |
|
резко выраженная деформация |
338 |
|
67.6 |
|
(по типу бугристых изменений)
267
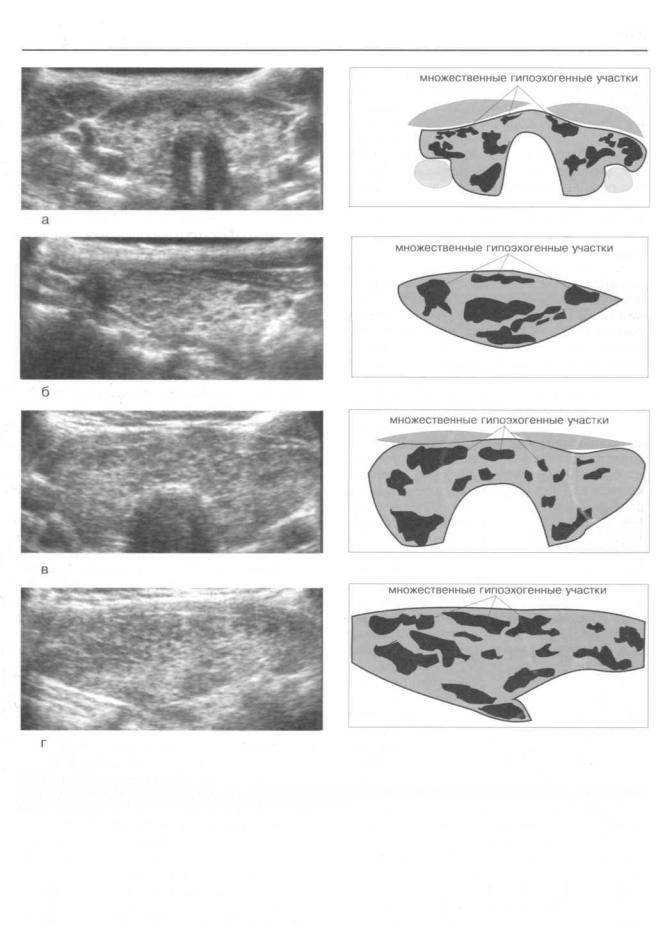
Рис.223. Аутоиммунный тиреоидит.
Эхограммы щитовидной железы, выполненные в поперечной (а, в) и продольной (б, г) плоскостях сканирования. Гипоэхогенные участки обусловлены лимфоидноплазматическими инфильтратами.

268
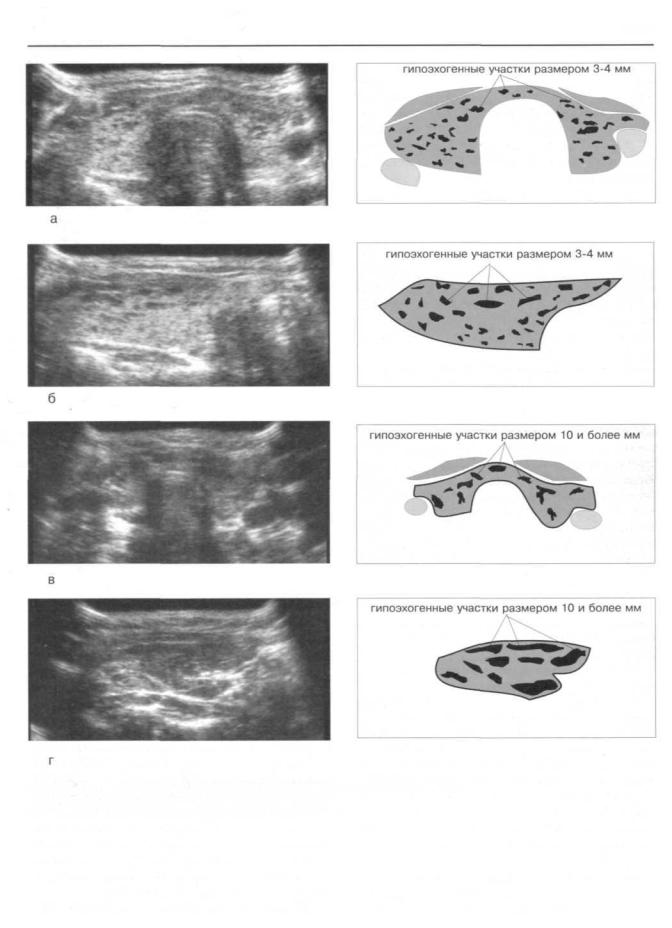
В 35% наблюдений размеры гипоэхогенных участков достигали 2-3 мм, в 30% — 4- 6 мм, в 30% — до 10 мм и в 5% — более 10 мм (рис. 224). Количество гипоэхогенных участков в ЩЖ мы выразили в виде их суммарной площади, занимаемой на эхограммах. Оказалось, что у 8% больных суммарная площадь достигала 20%, у 42 процентов больных она составила половину всей железы и у 50% больных гипоэхогенные участки занимали более двух третей объема органа (см. табл. 48).
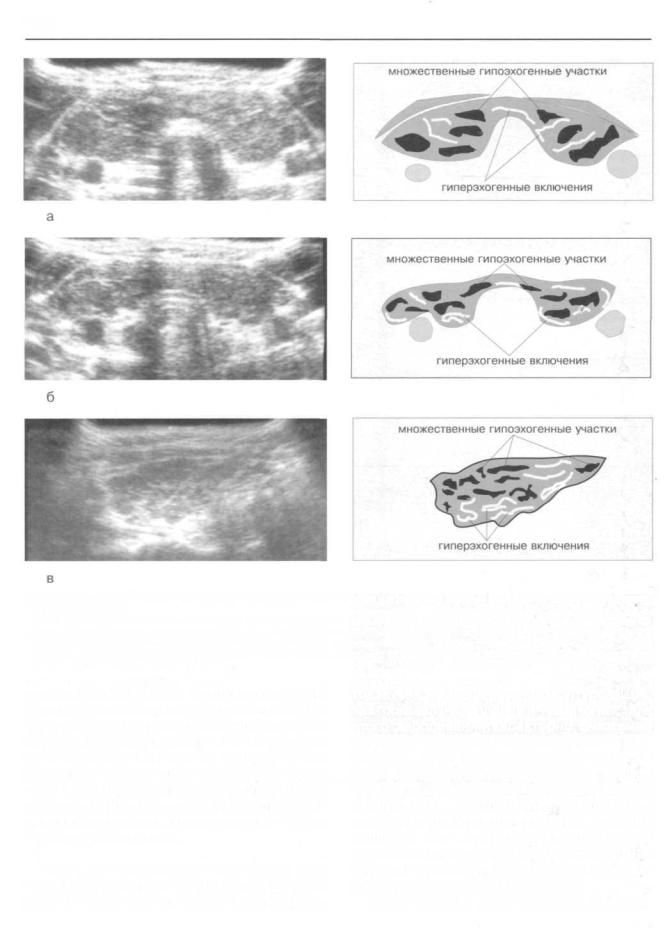
Одновременно с появлением беспорядочно расположенных гипоэхогенных очагов, приводящих к нарушению гомогенности ткани ЩЖ, в ряде случаев (по нашим наблюдениям у 25% из всех исследованных больных, см.табл. 48), на ультрасонограммах визуализируются мелкие гиперэхогенные включения неправильной формы (рис. 225). Количество гиперэхогенных включений и их размеры значительно варьировали. Считают, что зоны с повышенной акустической сопротивляемостью при тиреоидите Хашимото являются ультрасонографическим изображением участков фиброза, развивающихся вследствие соединительно-тканной реакции перифолликулярной стромы ЩЖ [19, 27, 32, 35, 42]. Такие данные свидетельствуют о целесообразности применения ультрасонографии не только для ранней диагностики AT, но и для прижизненной оценки характера и степени выраженности изменений ЩЖ при этом заболевании. Так, у 26 больных AT (как правило, женщин в возрасте 50-65 лет) на ультрасонограммах ЩЖ регистрировалось появление обширных гиперэхогенных зон размером 3-5 мм.
В зависимости от соотношения степени выраженности описанных выше патологических процессов, ряд авторов выделяют
лимфопролиферативную, фиброзную и фибролимфоиднуюформыаутоиммунноготиреоидита[19,34,38,55],чтонаходит отражение при ультразвуковом исследовании (см. рис. 223, 224, 225).
Описанные выше особенности ультразвуковых изменений ЩЖ могут представлять определенный интерес. Не исключено, что на основании данных ультрасонографии можно производить прижизненную оценку характера и степени выраженности лимфоидной инфильтрации и фиброзных изменений в ткани ЩЖ у больных AT. Такие сведе-
ния могут иметь важное практическое значение при выборе метода иммуносупрессивной терапии этого заболевания и оценки результатов такого лечения.
УльтразвуковаяхарактеристикаЩЖу больных очаговой и диффузной формами ЩЖ. Наряду с выделением лимфоидной, фиброзной и фибролимфоидной форм аутоиммунного тиреоидита, в клинической литературе широкое применение получила классификация этого заболевания, основанная на оценке степени выраженности патологических изменений тиреоидной паренхимы [5, 6]. Согласно этой классификации,
выделяют очаговую идиффузную формыхроническоголимфоцитарноготиреоидита. Применение ультразвукового исследования позволяет производить разграничение больных аутоиммунным тиреоидитом, отличающиеся друг от друга по типу изменений тиреоидной паренхимы.
Так, среди 501 обследованного нами больного у 124 пациентов на первый план выступили очаговые изменения паренхимы ЩЖ. В этих случаях гипоэхогенные участки размером до 27 мм локализовались в виде отдельных локусов в различных отделах ЩЖ (рис. 226 а, б). По нашему мнению больные с описанными выше ультразвуковыми изменениями ткани ЩЖ могут быть отнесены к группе пациентов с очаговой формой AT.
Вторую группу больных AT составили 271 пациент, у которых при ультразвуковом исследовании ШЖ на первый план выступали диффузные изменения ее эхогенности (рис. 226в). В этих случаях на ультрасонограммах регистрировались гипоэхогенные участки диаметром 4-9 мм, беспорядочно расположенные по всей поверхности ультразвуковых срезов железы. Характерным для диффузной формы AT было и появление мелких гиперэхогенных включений, столь же беспорядочно расположенных по всей площади ультразвуковых томограмм ЩЖ. По нашему мнению, больные с описанными выше изменениями ЩЖ должны быть отнесены к группе пациентов с диффузной формой аутоиммунного тиреоидита.
Наконец, у 106 больных отмечалось сочетание локальных изменений в одних отделах ЩЖ (например, в правой доле и перешейке) с диффузными нарушениями — в других ее отделах. Такие данные являются дополнительным доказательством схематич-
269
Рис.224. Ультрасонограммы ЩЖ больных аутоиммунным тиреоидитом Хашимото.
а,6) Размеры гипоэхогенных участков не превышают 3-4 мм. в,г) Размеры гипоэхогенных участков достигают 10 мм и более.
270
Рис. 225. Ультрасонографические признаки фиброзных изменений щитовидной железы больных аутоиммунным тиреоидитомХашимото.
а) Мелкие гиперэхогенные включения неправильной формы, беспорядочно расположенные в различных отделах щитовидной
железы. Визуализируются также гипоэхогенные участки, нарушающие гомогенность органа. |
ре |
б) Обширные зоны с повышенной акустической плотностью, расположенные в центральном отделе доли. |
|
в) Поздняя стадия фиброзных изменений щитовидной железы. Отчетливо видны уменьшение размеров и деформация органа.
ности представлений, согласно которым выделяют только очаговую или только диффузную формы тиреоидита Хашимото. Обе эти формы AT являются проявлением одного и того же заболевания, возможно, это различные стадии одного и того же процесса [59, 61]. Полученные нами данные могут служить новым аргументом и в пользу концепции о существовании переходных форм тиреоидита Хашимото.
Сглаживаниеконтуровидеформация ЩЖ. В диагностике аутоиммунного тиреоидита важное значение приобретает и уль-
тразвуковое исследование контуров ЩЖ. Как показал накопленный нами опыт, для этого заболевания характерно снижение четкости переднего края железы (рис. 227 а, б, в) и бугристая деформация ее задней поверхности (рис. 228 а, б, в). При изучении ЩЖ у многих больных AT (76%) наблюдалась «размытость» границ между железой и прилегающими к ней передними мышцами шеи. Одновременно на этих же срезах во многих случаях (67,7% больных AT) отмечается бугристая деформация заднего края железы (таблица 48).
Вторая группа признаков, наблюдав-
