
6 курс / Эндокринология / Stroev_Endokrinologia_podrostkov
.pdf
ствии оказалось, что им присуща и продукция аминов, и выработка регуляторных пептидов, причём часто (вопреки догме «одна клетка -— один гормон») — в пределах одного клеточного типа. Так, В-клетки островков Лангерганса выделяют и инсулин, и ГАМК. Всеэти клетки, имеющие черты как эндокриноцитов, так и паранейронов, обладают маркерами последних: хромогранином А, ферментами декарбоксилазой и нейрон-специфичес- кой енолазой и, по существу, являются нейроэндокринными (Малашхия Ю.А. с соавт., 1990). Первоначально А. Дж. Э. Пирс постулировал, что все они расселяются по организмуизнейроэктодермынервного гребешка, но позже А. Эндрю (1981) доказала, что диффузные эндокриноциты могут иметь также и энтодермальное, и мезодермальноепроисхождение.
Еще в 1928 г. М. Шеррер открыл явление нейросекреции и описал гормональную активность нейронов гипоталамуса. Таким образом, им были заложены представления о нейросекреции. Принципиальное значение имело неожиданное наблюдение, что практически все пептидные гормоны, первоначально найденные в желудочно-кишечном тракте (гастрин,
вещество Р, холецистокинин, вазоактивный интестинальный полипептид, инсулин, глюкагон и дру-
гие) содержатся также и в центральной нервной системе. И, напротив, некоторые, первично открытые в ней нейропептиды (соматостатин, нейротензин,
эндогенные опиаты и пр.), позже были найдены как инкреторные продукты диффузных эндокриноцитов кишечника и островков Лангерганса. Более того, выяснилось, что эти пептиды, будучи гормонами в же- лудочно-кишечном тракте, служат нейротрансмиттерами в пептидэргических системах мозга или выделяются в безымпульсном режиме после антидромного распространения по афферентным нервным проводникам теми же нейронами, которые оперируют и аминными нейромедиаторами (Докрей Г. Дж.,
1978; Поляк Дж. 1YL, Блум С. М., 1977).
В настоящее время считают, что одни и те же сигнальные молекулы служат в мозге глобальным средствомхимическогокодированиятехформнейронной активности, которые связаны с отдельными древнейшими функциями (половым и пищевым поведением, поддержанием водно-электролитного баланса, позитивным и негативным подкреплением, памятью), а в других органах (например, в желудочно-кишечном тракте) используются локально как паракринные аутокоиды или гормо-
ны. Более того, поУ. Кэннону и А. Розенблюту (1951),
антидромное распространение и секреция афферентными нервами таких нейропептидных гормонов служит реальной основой явления «нервной трофики». Внасто-
ящее время развитие учения о нейропептидах привело к демистификации понятия «нервная трофика», которое трактуется, по существу, как эндокринная функция нейроцитов. А. Дж. Э. Пирс (1977) прямо заключил, что
«апудоциты продуцируют пептиды, действующие и как гормоны, и как нейромедиаторы. Они действуют как эффекторы третьего звена, поддерживая или модулируя функции соматических и вегетативных нейронов, служа фактически трофическими субстанциями как для нейронов, так и для соматичес-
ких клеток». Вышеизложенные факты привели к освоению эндокринологами концепции о нейроэндок-
ринном взаимодействии.
С открытием дисперсной эндокринной системы предметными стали вопросы эндокринной функции жировой ткани (лептин), сердца (атриопептины), почек
(ренин, эритропоэтин, производные кальциферола), печени (ангиотензиноген, производные кальциферо-
ла) и других органов. Оказалось, что многие диффузные эндокриноциты выделяют прогормоны-предше- ственники, а активные гормоны совсем не обязательно должны вырабатываться в конкретной железе, но мо-
гут даже формироваться вне клеток — в крови. При-
мером служат ангиотензины II и III, предшественник которых (ангиотензин I) возникает в печени и в диффузных эндокриноцитах разной локализации, а активные гормоны образуются прямо в плазме за счёт протеолитического эффекта почечного ренина и лёгочной ангиотензин-конвертазы.
Наконец-то, можно сказать, разрушилась та искусственная «берлинская стена», которая делила непримиримых представителей лагеря нервистов и лагеря гуморалистов, сломавших немало копий в попытке выяснить «кто главнее в организме?». Мозг фактически оказался крупнейшей эндокринной железой, а обе формы регуляции — двумя сторонами нейроэндокринной сети, в которой их функции не конкурируют, но разумно делят сферы преимущественной применимости и постоянно взаимодействуют.
Дальнейшее развитие эндокринологии поставило вопрос отом, чтои иммунная система, функции которой также основаны на комплементарном взаимодействии химических сигналов и рецепторов, не остаётся в стороне от нейроэндокринного аппарата. Более того, в настоящее время в эндокринологии принято исходить из существо-
вания иммунонейроэндокринных взаимодействий и триединого коммуникативно-регуляторного интегрирующего аппарата (КРИА), включающего не только нейроэндокринную, нои иммунную системы.
Еще в 60-е годы XX столетия была раскрыта эндокринная роль тимуса. Эта уникальная эндокрин-
11

ная железа не только посылает в системный кровоток типичные гормоны (тимозин и тимулин), но и служит местом паломничества лимфоидных клетокмишеней, которые, проходя через нее, подвергаются воздействию множества местных паракринных и юкстакринных (действующих в пределах межклеточного контакта) гуморальных регуляторов-цитокинов,
определяющих пути их дифференцировки (Миллер Дж., 1961). Затем стало ясно, что цитокины лимфоидных и макрофагальных клеток способны изменять функции гипоталамуса и гипофиза, а также обладают гормоноподобным действием на периферические эндокринные железы. Более того, оказалось, что гормоны (особенно пептидные), а также и их рецепторы часто служат обьектом физиологического аутоиммунного ответа, а при патологии — мишенью аутоаллергии. Из-за химического сходства (гомологии) многих биорегуляторов и рецепторов бактерий и высших организмов подобная аутоаллергия, имеющая мишенью эндокринную систему, бывает частой причиной первичных и вторичных, железистых и внежелезистых эндокринопатий. Аутоаллергия оказалась одним из самых частых и важных патогенетических механизмов эндокринных болезней. Так, например, рецептор микроорганизма Yersinia enterocolytica, подобный тиротропиновому рецептору фолликулярных клеток щитовидной железы, вызывает у индивидов, предрасположенных к аутоаллергии, перекрёстный аутоиммунный ответ, поражающий тироциты и приводящий, по современным представлениям, к диффузному токсическому зобу — болезни Базедова (Харис-сон Л., 1985).
Было показано существование в норме, при патологии и в экспериментальных условиях антиидиотипических антител, полностью или частично имитирующих либо блокирующих действие пептидных и аминокислотных гормонов на клетки-мишени. Все эти факты убедили современных эндокринологов в том, что иммунная система, биорегуляторными сигналами которой служат цитокины и антитела, в норме и при патологии включается в нейроэндокринные взаимодействия, вследствие чего и сложилась концепция им-
мунонейроэндокринного коммуникативно-регу- ляторного интегрирующего аппарата — КРИА
(Корнева Е.А., 1987; Зайчик А.Ш. с соавт., 1982, 1988, 2002; Беседовский X., 1989). Появилась даже оригинальная точка зрения, что некоторые лимфоциты представляют собой своего рода циркулирующую разновидность апудоцитов — теория нейроиммун-
ного дифферона (Абрамов В.В., 1986). Аксиомой физиологии стало учение о влиянии центральной не-
рвной системы, в частности, гипоталамуса на иммунный ответ через вегетативные нервы и гормоны (Корнева Е.А., 1962, 2003). Подробнее эти и другие воп-
росы иммунонейроэндокринологии освещены в ряде недавно изданных книг и обзоров (Зайчик А.Ш. с
соавт., 1988; Зайчик А.Ш., Чурилов Л.П., 1999, 2001, 2002; Корнева Е.А., 2003).
Для целей данного руководства важно подчеркнуть,
что современная эндокринология —это наука об эн-
докринной регуляции и ее нарушениях (а не только о функциях и болезнях эндокринных желез).
Метаболизм гормонов
В настоящеевремя открытооколо100 гормонов. Химически они подразделяются на три группы:
—пептиды и гликопротеиды;
—производные аминокислот;
—дериваты холестерина.
Важно отметить, что одна и та же клетка может вырабатывать одновременно или на разных стадиях своего онтогенеза разные гормоны одной химической группы, а иногда — даже гормоны разных химических групп. Например, адренокортикоциты в онтогенезе мигрируют от капсулы внутрь надпочечников, после-
довательно выделяя минералокортикоиды, глюко-
кортикоиды и андрогены, а некоторые из них, вероятно, способны трансформироваться впоследствии в смешанные клетки, секретирующие и катехолами-
ны.
БИОСИНТЕЗ ГОРМОНОВ
По современным данным, биосинтез гормонов протекает по-разному в зависимости от их химической природы и характеризуется следующими особенностями.
Пептидные гормоны
Пептидные гормоны образуются по схеме «препрогормон — прогормон — активный гормон», ил-
люстрируемой на рис. 2.
Вначале формируется гетерогенная ядерная рибонуклеиновая кислота, содержащая транскрипты экзонов и интронов, затем при сплайсингеинтроновыекопии удаляются, а из экзоновых формируется м-РНК препрогормона, снабжённая полиадениловым хвостом, длина которого определяет срок ее жизни в клетке. На её основе путём трансляции возникает препрогормон, имеющий сигнальную универсальную последовательностьнa N-конце,необходимуюдляпереноса молекулы

Рис. 2. Общая схема образования полипептидных гормонов
внутрь шероховатогозндоплазматического ретикулума
(ШЭР).
Далее в комплексе Гольджи эндокриноцита происходит протеолитическоеудаление (вырезывание) этого сигнального пептида, как правило, по связям между аргининовыми или аргининовым и лизиновым остатками. Образуется прогормон (например, проинсулин или прокалъцитонин), а иногда — сразу гормон (например,
пролактин или гормон роста). Прогормон пакуется в секреторныепузырьки и затем непосредственнов них или в пределах эндоплазматического ретикулума происходит дальнейший протеолиз с образованием актив-
ного гормона.
Так осуществляется, например, вырезывание С- пептида с формированием инсулина. Впрочем, часто прогормон секретируется как таковой вместе с готовым гормоном, а протеолиз и вычленение активного гормона (гормонов) идёт частично на перифе-
рии, причем — по-разному в различных тканях или на разных стадиях гормонального ответа. Примером может служить процессинг гипофизарного проопиомеланокортина (ПОМК) в надпочечниках при стрессе. В начале стресса ПОМК членится клетками гипофиза и надпочечников до АКТГ, а в конце начинает преобладать его протеолиз до опиатных пептидов. На разных стадиях онтогенеза один и тот же предшественник может процессироваться по-разному. Это относится, в частности, к ПОМК, который у плода и у взрослого образует попреимуществуразличныеварианты МСГ.
Некоторые пептидные гормоны (ТТГи все гонадотропины) перед секрецией гликозилируются в аппарате Гольджи, что способствует удлинению времени их жизни в крови.
Пептидные гормоны, как содержащие одну, так и имеющие две субъединицы, могут кодироваться одним геном {инсулин, паратгормон) или двумя генами
(хорионический гонадотропин, лютеинизиру-ющий гормон). Иногда один гормон в разных органах может получаться из различных предшественников,
закодированных неидентичными генами (соматостатин). Часто, наоборот, один прогормон служит предшественником нескольких гормонов, получаемых из него путем посттрансляционного протеолиза. Например, проопиомеланокортин аденогипофиза служит сырьем для продукции АКТГ, в-липотропи-
на, а-МСГ, в-МСГ, а-в-у-эндорфинов, энкефалина и кортикотропиноподобного промежуточного полипептида.
После транскрипции в разных эндокриноцитах одних и тех же генов гормонов возможен альтернативный сплайсинг гетерогенной ядерной РНК с образованием различных м-РНК, которые в дальнейшем приводят к трансляции неидентичных гормонов в различных тканях. Так, в С-клетках щитовидной железы формируется преимущественно калъцитонин, а в центральной нервной системе — пептид, связанный с геном калъцитонина, причём в обоих случаях — на основе об-
щего транскрипта препрокалъцитонина.
Важной особенностью характеризуется синтез пептидных либеринов гипоталамуса. Показано, что образование многих из них (тиролиберина, гонадо-
либерина, соматолиберина и пролактин-рилизинг фактора) идёт в цитозоле нейросекреторных клеток не рибосомальным путём. Оно не чувствительно к пуромицину и РНК-азе и напоминает механизм формирования глутатиона и антибиотических пептидов у микроорганизмов. Для осуществления этих процессов служит набор АТФ-зависимых цитоплазматических
13
либерин-синтетаз (Гэррин Л. с соавт., 1971). Это ускоряет синтез либеринов и делает ответ ней-роэндокринных клеток очень лабильным и пластичным.
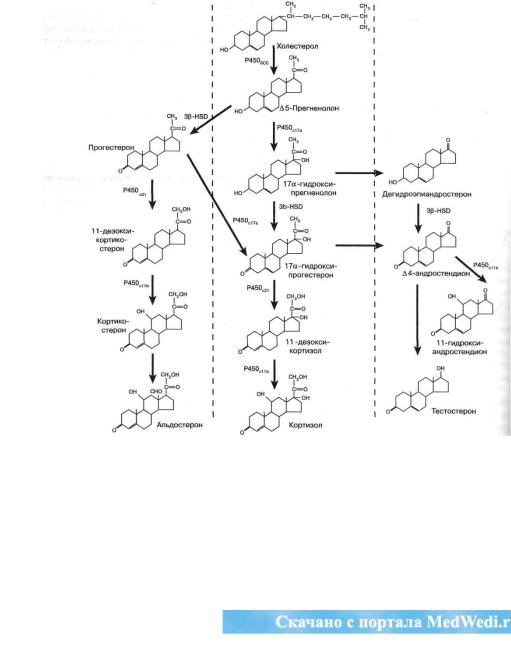
Стероидные гормоны
Стероидные гормоны синтезируются по совершенно иному пути. Сырьём служит либо холестерин (в коре надпочечников и гонадах — при образовании минера-локортикоидов, глюкокортикоидов, прогестинов, андрогенов и эстрогенов), либо 1 -дегидрохолесте-
МИНЕРАЛОКОРТИКОИДЫ
ГЛЮКОКОРТИКОИДЫ
рин (в коже, а затем — в печени, в стимулированных макрофагах и в почках) при образовании
кальциферола.
Превращения стероидов состоят в отщеплении алифатической боковой цепи, гидроксилировании и дегидрировании, либо ароматизации А-кольца. Читатель может обратиться к схеме этих процессов, представленной на рис. 3.
Находящийся в составе липосом холестерин и его дериваты претерпевают многократный перенос в митохондрии и эндоплазматический ретикулум, причёмнаблю-
АНДРОГЕНЫ
Рис. 3.Пути стероидогснеза вкоренадпочечников
14

дается характерный контакт и «мультипликация» мембранных структур, участвующих в биосинтезе органоидов и липосом.
Так как пути стероидогенеза предусматривают участие множества ферментов (например, при продукции эстрогенов — не менее шести), биосинтез стероидов зависитотмногихгенов, включаякакте, которыекодируют ферменты, так и те, которые кодируют внутриклеточные посредники действия стимуляторов стероидогенеза — ключевые белки (Дазо А., 1983). Поэтому существует много наследственных дефектов стероидогенеза, чрезвычайно часто встречающихся в подростковой практике, тогда как число наследственных дефектов продукции пептидных гормонов невелико.
Вместе с тем биосинтез пептидных гормонов нередко происходит эктопически, в опухолевых клетках, так как требует растормаживания всего лишь однойдвух генетических программ. Однако биосинтез стероидов в эктопических опухолях и неэндокринных тканях не типичен.
Стероиды чаще секретируются в готовом виде. Однако возможна и периферическая трансформация прогормонов стероидного происхождения в гормоны. Именно так складывается судьба витамина D в организме. Прогормон, полученный при ультрафиолетовом облучении в клетках кожи или поступивший с пищей, превращается в активную дигидроксифор-
му гормона (как уже сказано выше) с участием печени, почек, а иногда — и активных макрофагов.
Почки могут превращать половой гормон проге-
стерон в минералокортикоид — дезоксикортико-
стерон, что имеет значение при развитии отёков у беременных. Плацента переводит дегидроэпиандростерон фетальной зоны коры надпочечников плода в эстриол, который позволяет матери избежать вирилизации при беременности мальчиком и участвует в координации сложных процессов формирования эндокринного пола плода. Способность трансформировать некоторые андрогены в эстрогены присуща и трофобластическим опухолям. Липоциты превращают в эстриол андрогены, что имеет большое значение в патогенезе гиноидной формы ожирения (Строев Ю. И. с соавт., 2003). Соответственно как истощение, так и ожирение юношей и девушек могут по-разному сказываться на ходе полового созревания.
Гормоны — производные тирозина
Производные тирозина претерпевают при биосинтезе катехоламинов и дофамина (в мозговом ве-
щественадпочечников, парааортальных ганглиях пло-
да и новорожденного, апудоцитах) гидроксилирование и декарбоксилирование в свободном состоянии и также пакуются в специальные секреторные гранулы.
В щитовидной железе основные этапы превращений
тирозина на пути к тироидным гормонам, наоборот,
протекают при связывании тирозиновых остатков в составе особого белка — тироглобулина.
Эти предшественники сначала йодируются в двух положениях, образуя монойодтирозин (МИТ) и ди-
йодтирозин (ДИТ), затем окисляются и конденсируются между собой, формируя йодтиронины — тетрайодтиронин (тироксин) и трийодтиронин (лиотиронин).
Йодтиронины отщепляются от тироглобулина, который фолликулярные тироциты захватывают из коллоида щитовидной железы, и секретируются в кровь в виде тироксина (T4) и трийодтиронина (ТЗ). ТЗ
возникает из Т4 путём отщепления йода от наружного фенольного кольца (дейодирование). ТЗ намного более активен, чем Т4, и для него Г, фактически служит прогормоном.
Дейодирование идёт в клетках-мишенях и представляет дополнительный уровень регуляции эффективности тироидной функции, так как может сильно влиять на общую активность тироидных гормонов в разных ситуациях (стресс, голодание, адаптация к переохлаждению и перегреванию и т.п.).
ХРАНЕНИЕ И ВЫДЕЛЕНИЕ ГОРМОНОВ
Хранение и выделение гормонов в биологические среды организма—это важный этап их обмена, объект многочисленных расстройств при патологии. Гормоны выделяются в организме периодически, по потреб-
ности в них, и, следовательно, в той или иной мерехранятся в запасе.
Дольше всего хранится неполярный стероид кальциферол. Прекращение поступления и биосинтеза его предшественника у взрослого человека дает эффект в виде остеопороза лишь спустя несколько месяцев, но у ребенка и подростка сказывается значительно быстрее.
Тироглобулин щитовидной железы удерживает двухнедельный запас тироидных гормонов. Его лизис в ходе подострого тироидита Де Кервена может вы-
зывать выбросы в кровь порций гормонов и эпизоды гипертироза на фоне общей, свойственной этому заболеванию тенденции к ограничению функциональных возможностей железы — к гипотирозу.
В-клетки островков Лангерганса имеют инсулина не более чем на 5 дней секреции, причём его правильная
15

упаковка у ряда млекопитающих нарушается блокато- |
паракринным глюкагоном, АКТГ и СТГ. В то же время |
рами цинка, что позволило создать так называемую ди- |
она тормозится соматостатином, а-адренергически- |
тизоновую модель сахарного диабета на животных. |
ми влияниями, избытком самого инсулина, амилином, |
Другие пептидные гормоны запасаются в еще меньших |
галанином, лептином и многими цитокинами {напри- |
количествах. |
мер, ИЛ-1 и ФНОа). До воздействия секреторных сти- |
Кроме кальциферола, другие стероидные гормо- |
мулов выход катионов калия поляризует мембрану В- |
ны практически не запасаются в силу полярного харак- |
клеток и препятствует входному току ионов кальция |
тера их молекул. Семенники содержат тестостеро- |
через потенциал-зависимые кальциевые каналы. Цитоп- |
на не более чем 15-17 % от суточной потребности, |
лазматический уровень ионизированного кальция ос- |
поэтому стероидогенез в них характеризуется высокой |
таётся низким. |
постоянной интенсивностью и легко нарушается при |
При действии секреторного триггера, например, при |
острых поражениях яичек, например, при орхите. |
захвате глюкозы В-клеткой ситуация меняется. Глюко- |
|
Стероидные гормоны освобождаются в кровь по- |
за метаболизируется, что ведет к генерации АТФ, уси- |
||||
стоянно на основе разницы в концентрациях и связыва- |
лению работы калий-натрий-зависимой АТФ-азы плаз- |
|||||
ются с липопротеидами и стероидпереносящими белка- |
матической мембраны, снижению выходного калиевого |
|||||
ми. |
|
|
|
|
тока и захвату калия клеткой. Деполяризация приводит |
|
|
В отличие от них, белковые гормоны и производ- |
к открытию потенциалозависимых входных кальциевых |
||||
ные тирозина, как правило, поступают в кровь нерав- |
каналов. Катион кальция входит в цитоплазму извне и |
|||||
номерно. Секреция катехоламинов мозговым веще- |
из внутриклеточных компартментов, где его судьба оп- |
|||||
ством надпочечников происходит активно в ответ на |
ределяется ц-АМФ-зависимыми механизмами, активи- |
|||||
симпатический нервный сигнал. |
рованными стимулятором инсулиновой секреции. Каль- |
|||||
|
Тироидные |
гормоны |
секретируются путем |
ций влияет на микротрубочки и миозиновые филаменты, |
||
пиноцитоза и протеолиза тироглобулина, которые сти- |
способствуя движению цитоскелета и перемещению |
|||||
мулируются как симпатическими нервами, так и (в ос- |
секреторных гранул с инсулином, который подвергает- |
|||||
новном) гуморальными сигналами — ТТГ и mupocmu- |
ся экзоцитозу с участием белков-кальэлектринов, по- |
|||||
мулирующими иммуноглобулинами. Если печень и |
могающих слиянию плазматической мембраны и мем- |
|||||
другие неэндокринные клетки освобождают свои бел- |
бран секреторных пузырьков (фъюзогенный эффект). |
|||||
ки в кровь тонически, мало реагируя на специальные сти- |
Секреция других пептидных гормонов происходит |
|||||
мулы, то для секреции пептидных гормонов требует- |
не менее сложно и, как правило, тесно сопряжена с их |
|||||
ся, как правило, активный экзоцитоз секреторных |
биосинтезом, который она активирует. Например, при- |
|||||
пузырьков. Этот процесс предусматривает пусковой эф- |
ем глюкозы вызывает быстрый (через 10-15 минут) пик |
|||||
фект со стороны нервной системы, метаболитов или, |
выброса инсулина в кровь, связанный в основном с про- |
|||||
чаще всего, других гормонов. Требуется обеспечить |
цессами, описанными выше, нозатем этот пик перехо- |
|||||
работу цитоскелета — нужна затрата макроэргов. И |
|
|||||
здесь важна роль кальция. Именно так секретируют- |
|
|||||
ся гормон роста, глюкагон, инсулин. Рис. 4 на |
|
|||||
примере |
секреции инсулина дает |
|
|
|||
представление |
сложности |
этого |
|
|
||
процесса. |
|
|
|
|
|
|
|
Секреция инсулина В-клетками |
|
|
|||
|
островков Лангерганса стимулируется |
|
|
|||
|
глюкозой, |
некоторыми |
амино- |
|
|
|
|
кислотами (аргинин, лейцин), глюка- |
|
|
|||
|
гоноподобным полипептидом I и, |
|
|
|||
|
другими энтериновыми гормонами, |
|
|
|||
|
особенно |
желудочным |
ингиби- |
|
|
|
|
рующим полипептидом (ЖИП). |
|
|
|||
|
Секреция инсулина стимулируется |
|
|
|||
|
также холинергическими |
вагаль- |
|
|
||
|
ными и Р-адренергическими симпа- |
|
|
|||
|
тическими нервными окончаниями, |
|
|
|||
Рис. 4. Секрецияинсулина В-клетками
16

дит в длительное повышение секреции гормона, которое достигает плато примерно через час и вызвано активацией его биосинтеза de novo.
По этим же причинам тройные гормоны активируют как выброс, так и синтез гормонов клеток-мише- ней. Например, АКТГ уже через 3-12 минут вызывает выброс в кровь кортикостероидов, а в более отдалённые сроки (1-3 часа) под его влиянием развёртывается картина активации стероидогенеза.
Некоторые гормоны освобождаются в кровь постоянным, меняющимся по интенсивности потоком (па-
ратгормон, пролактин, тироидные гормоны). Но для большинства характерен импульсный режим секреции, когда гормон поступает в кровоток дискретными порциями-толчками. Инсулин сочетает и пульсовый, и постоянный режимы освобождения. Но многие другие гормоны — АКТГ, СТГ, гонадотропины, стероиды — секретируются только импулъсно.
В последнее время обнаружилось, что толчковый дискретный ритм секреции сам по себе несёт сигнальную информацию и важен для действия гормона, а его нарушения свойственны некоторым формам патологии, в том числе — типичным для подростков. Так, люлиберин при пульсовом введении стимулирует продукцию
лютеинизирующего гормона (ЛГ) в аденогипофизе,
но те же дозы этого гипоталамического рилизинг-фак- тора тормозят продукцию ЛГ, если вводятся в непрерывном режиме. Утрата импульсного характера секреции люлиберина при сохранении его продукции закономерно наблюдается у подростков, страдающих
психогенной анорексией-булимией.
Клинический опыт показал, что микроимпульсное введение инсулина (метод «малых доз») более эффективнодля контроля уровня глюкозы в крови, чем одномоментная инъекция той же общей дозы. Микроимпульсы поступления СТГ в кровь совпадают с периодами быстрого сна, что наиболее четко выражено у подростков (см. ниже).
В более долговременном плане освобождение гормонов в кровь подчиняется определённым биоритмам
(Дедов И.И., Дедов В.И., 1992).
У большинства, хотя и не у всех гормонов, их секреция повышена в ранние утренние часы. Максимальная секреция пролактина осуществляется во время сна. Резкий подъем уровня СТГ у здоровых подростков и молодых людей наступает практически в первый час сна, особенно в период засыпания (дрёмы), что сопровождается знакомым каждому из нас возникающим при засыпании вздрагиванием всего тела (чувство «проваливания»). Зимой многих гормонов (особенно
гормонов щитовидной железы) вырабатывается зна-
чительно больше. Тироидных и половых гормонов
гораздо больше секретируется в полнолуние, что объясняет романтику лунных ночей.
Под контролем супрахиазматического ядра гипоталамуса, серотонина и мелатонина эпифиза и в зависимости от уровня общей освещённости в видимом диапазоне спектра формируется циркадный (околосу-
точный) ритм секреции кортиколиберина, а следовательно — АКТГ и глюкокортикоидов. По А. Ша-
фарчику с соавт. (1983), у человека и дневных млекопитающих акрофаза секреции гипоталамо-гипо- физарных стимуляторов кортикостероидогенеза приходится на 7-8 часов утра, а минимум — на поздний вечер (20 часов). Установлено, что данный ритм накладывает отпечаток не только на стероидогенез, но
ина суточный ход пролиферативных процессов в коре надпочечников (Чурилов Л. П., 1986). Существуют гормональные ритмы с периодом, превышающим сутки {инфрадианные), и более коротким, чем циркадные (ультрадианные). Широко известны колебания продукции гонадотропинов и 'половых гормонов, связанные с околомесячным периодом. Они имеют особое значение при установлении месячных у девушек в периоде полового созревания. Не менее важна
иоколомесячная периодизация эндокринной регуляции у мужчин и юношей.
Инфрадианной периодизации подвержена активность секреции тироидных гормонов. Суммарный результат биоритмологических особенностей продукции гормонов определяет периодические околомесячные
исезонные изменения физической, психоэмоциональной и интеллектуально-поведенческой активности индивидов любого пола, что впервые описано концеп-
циями Г. Свободы-В. Флейса (1898) и А. Л. Чижев-
ского (1924).
Социально-поведенческая дизритмия является фактором риска многих нейроэндокринных заболеваний.
Описаны «болезнь акклиматизации», вызванная быстрой сменой часовых поясов, и учащение артериальной гипертензии у субъектов, занятых ночной работой. В обоих случаях отмечаются аномалии продукции гипоталамических, гипофизарных и надпочечниковых гормонов, гиперфункция ренин-ангиотензин-альдосте- роновой системы.
Вподростковом периоде, когда только лишь устанавливаются регуляторные взаимоотношения центрального и периферических звеньев нейроэндокринной системы, такие факторы, как акклиматизация, ночное бодрствование, резкая смена режима дня, перемена часовых поясов — могут быть весьма патогенными. Известен факт, что студенты-подростки чащестрадают гипертонической болезнью при совме-
17

щении учебы с ночной работой. Существующие наблюдения за здоровьем членов юношеских спортивных сборных команд, совершающих международные поездки, это наглядно демонстрируют (Левина Л. И. с соавт, 1999). При болезни смены часовых поясов отмечено лечебно-профилактическое действие эпифизарного гормона мелатонина и его лекар-
ственных форм — меланекса, мелатонекса. Исчез-
новение нормального циркадного ритма продукции АКТГ отмечается, например, при болезни Иценко-
Кушинга.
Нет сомнений, что биоритмологические подходы, яркоеи развёрнутое описаниекоторых можнопочерпнуть в учебнике «Патологическая физиология» В. А. Фролова с соавт. (1999) и в монографии И. И. Дедова и В. И. Дедова «Биоритмы гормонов» (1992), в будущем значительно скажутся на развитии эндокринологии, особенно —ювенильной.
Околосуточный (циркадный) и околомесячный ритмы секреции гормонов должны учитываться при трактовке результатов их исследования. Например, уже сейчас признано, что трактовка данных о содержании
тироидных (а половых гормонов — тем более) долж-
на проводиться с учетом того, на какой день месячного цикла брали пробудляанализа удевушек и женщин. Недопустимо, назначив стандартную дозу гормона, игнорировать сезонные и климатические перемены в жизни пациента и связанные с этим колебания потребности в гормонах. Современный эндокринолог, патронируя своих больных на протяжении длительного времени, обязательно должен вносить в дозировку назначенных гормонов коррекции, связанныес биоритмами.
ТРАНСПОРТ ГОРМОНОВ
Транспорт гормонов осуществляется с током крови, лимфы и межклеточной жидкости. После секреции гормоны попадают в равновесную систему, где концентрации связанного и свободного биорегулятора в крови соотносятся между собой и зависят от баланса скорости поступления и скорости удаления гормона из крови, а также от количества и аффинности белка-переносчика. Гормоны быстро разрушаются, однако, постоянно синтезируясь, находятся у здоровых в количествах, потребных для сохранения гомеостаза.
Деградация гормонов происходит в тканях-эффекто- рах, а такжев печени и почках, продуктыих распада выделяются в основном с мочой и желчью. О скорости использования гормонов судят по их клиренсу (Т1/2). В клинике о продукции гормонов можно сделать заключенияпоихконцентрациивбиологическихжидкостях,оп-
ределяемой иммуноферментными, иммунохемилюминесцентными или радиоиммунологическими (реже — биохимическими или биологическими) методами. Однако надо помнить, что концентрации (содержание, уровень) гормонов в крови — это параметры динамические, равновесные. В связи с этим очевиден архаизм традиционно неточных терминов—«гормональный статус (фон, зеркало)», которые авторы настоящего руководства никакнемогутрекомендоватькупотреблению.
У пептидных гормонов время их полужизни в крови — порядка 3-7 минут, а у гликопротеидных оно может быть более часа, но остается для всех этих гормонов принципиально весьма коротким, что позволяет эндокринной системе оперативно менять гормональный уровень.
Пептидные гормоны распространяются в свобод-
ном виде, но тироидные и стероидные гормоны в силу их гидрофобности требуют солюбилизаторов-перенос- чиков. Наиболее известные транспортёры гормонов —
транстиретин (преалъбумин), переносящий тироид-
ные гормоны и ретинол, а также такие белки, как:
ти-роксин-связывающий глобулин, тестостерон- связы-вающий глобулин, кортикостероидсвязывающий глобулин, альбумин, который неспецифически фиксирует тироидные и многие
стероидные гормоны. Стероиды и тироидные гормоны могут также переноситься липопротеидами, особенно липопротеидами высокой плотности. Тироидные гормоны за счет своих антиок-сидантных свойств препятствуют атерогенным окислительным изменениям липопротеидов. Под их влиянием снижается экспрессия высокоатерогенных липопротеидов (Дантес Л. Г., 2002).
Многие эндокринологические руководства к важным причинам эндокринопатий традиционно причисляют нарушения транспорта гормонов (по аналогии с фармакологическими данными о том, что связывание с белками крови очень существенно для определения биодоступности лекарств). Однако Дж. Уилсон (1994) справедливо указывает, что при интактной обратной связи в системе «гипоталамус — гипофиз — пери-
ферические железы» сдвиги концентраций свободного активного гормона, наступающие от изменения связывания с плазменными белками, не будут иметь стабильного характера. Ведь у здорового индивида они эффективно нейтрализуются компенсаторным изменением секреции гормона.
Так, эстрогены увеличивают содержание тирок-
син-связывающего глобулина и посему делают био-
доступность тироксина меньшей. В ответ на это у женщин в эстральную фазу месячного цикла гипота-
18

ламо-гипофизарный нейросекреторный аппарат по принципу обратной связи увеличивает продукцию тиролиберина и ТТГ, а щитовидная железа добавляет в кровь тироидные гормоны — и эффективная биодоступная концентрация этих регуляторов остается нормальной. В плазме наступает кажущееся увеличение концентрации общего Т4, не означающее наступления функционально-метаболического гипертироза. Однако у женщин это небезразлично при истолковании данных о концентрациях тироидных гормонов в их крови. То же имеет место при беременности и при пользовании гормональными контрацептивами.
Иное дело, когда имеются отклонения от нормы во взаимоотношениях центрального и периферического звеньев нейроэндокринной системы. При нарушении нормальных механизмов сервоконтроля гормональных концентраций колебания степени связывания гормонов в крови становятся существенным патогенетическим фактором эндокринопатий. Так, даже небольшие дозы глюкокортикоидов, вводимых с лечебной целью, способны вызывать синдром Кушинга у подростков с гипопротеинемическими состояниями и со снижением продукции кортикостероид-связывающего белка (при недоедании, печеночной недостаточности, нефротическим синдроме, микседеме).
ИНАКТИВАЦИЯГОРМОНОВ
Инактивация гормонов — важный этап их ме-
таболизма. Каждый, кому случалось иметь дело с запавшей кнопкой дверного звонка, помнит, как надоедливо звучит его непрекращающийся сигнал. Химический сигнал-гормон, как и любой другой, для эффективного использования должен своевременно прекращать своё действие — инактивироваться.
Выше уже упоминалось, что гормоны инактивируются как в клетках-мишенях после их проникновения во внутриклеточное пространство, так и в нетаргетных органах, главным образом, в печени и в почках. Иммунные комплексы с участием гормонов подвергаются клиренсу в фагоцитах.
Основной путь инактивации пептидных гормонов
— протеолиз. Хотя исторически сложились представления о существовании для некоторых гормонов специальных протеаз, на деле эти процессы осуществляются в основном неспецифическими протеолитическими ферментами клеток-мишеней. Так, до сих пор еще
не обнаружено специальной «инсулиназы», хотя ус-
ловно этим понятием оперируют многие эндокринологические руководства. Вместе с тем для многих паракринных пептидов — например, интерлейкинов,
кининов, ангиотензинов — имеются специальные конвертазы (например, интерлейкин-конвертаза ICE, анги- отензин-конвертаза АСЕ, калликреин).
Гормоны тирозинового происхождения инакти-
вируются специальными ферментами. Катехоламины разрушаются моноаминоксидазой (МАО) и кате- хол-ортометилтрансферазой (КОМТ) тканей-мишеней и печени. Окислительное дезаминирование и орто-ме- тилирование этих гормонов ведет к образованию и к экскреции с мочой таких продуктов, как ванилил-мин-
далъная кислота, норметанефрин и метанефрин,
концентрации которых определяют в диагностических целях в моче. Блокада ферментов катаболизма катехоламинов, например, с помощью лекарств приводит
кзначительному увеличению чувствительности тканей
ккатехоламиновым сигналам.
Тироидные гормоны дейодируются в тканях-ми- шенях и печени, дезаминируются и деконденсируются в печени, а затем окисляются, выводятся в кишечник с желчью и оттуда в небольших количествах — рециркулируют.
Стероиды подвергаются в печени восстановлению (для чего имеются специальные энзимы), затем
— неспецифическому гидроксилированию. Наконец, они образуют гидрофильные парные соединения с активными формами серной или глюкуроновой кислоты и поступают в желчь и мочу. Из желудочно-ки- шечного тракта их дериваты могут реабсорбироваться, а содержание продуктов распада стероидов в моче (например, 17-КС, 17-ОКС) измеряют в диагностических целях.
Как указывалось выше, в связи с закономерностями гормонального транспорта сами по себе колебания скорости деградации гормонов напрямую не приводят к эндокринной патологии, если только функционирует сервостатический механизм гипота- ламо-гипофизарного контроля над их эффективными концентрациями. Может быть, единственным примером такого рода патологии служит резистентность к экзогенному инсулину из-за его аномально быстрого расщепления при подкожных инъекциях.
Вместе с тем надо помнить, что при патологии обратные связи в системе могут быть нарушены, и клиренс гормонов становится важной детерминантой их эффективной концентрации. Так, гипертироз ускоряет катаболизм стероидов, делая подростков с базедовой болезнью относительно «резистентными» к глюкокортикоидам. Печеночная недостаточность за-
медляет клиренс алъдостерона, серотонина,
эстрогенов, кортизола и других гормонов, что на-
19

кладывает отпечаток на симптомы, наблюдаемые у больных. Скажем, такие клинические проявления циррозов печени у мужчин, как импотенция, гинекомастия, отёки, эритема ладоней и сосудистые «звёздочки» объясняют избытком соответствующих гормонов, недоразрушенных плохо функционирующими гепатоцитами.
МЕХАНИЗМЫ ДЕЙСТВИЯ ГОРМОНОВ И ВАЖНЕЙШИЕ ПРИНЦИПЫ ЭНДОКРИНОЛОГИИ:
ПЕРМИССИВНОСТЬ И СЕРВОКОНТРОЛЬ
Механизмы действия гормонов обладают некоторыми общими чертами. Гормоны действуют целена-
правленно, специфично и высокоэффективно. Эф-
фективность — свойство гормонов, в отличие от рефлексов, действовать, по сути, без порогов, то есть даже в ничтожно малых концентрациях.
Целенаправленность — это воздействие на конкретные, снабжённые комплементарными приёмниками гормонального сигнала—рецепторами — таргетные клетки или органы («мишени»). Специфичность действия гормонов может быть анатомически относительно избирательной (так, глюкагон действует прежде всего на печень) или очень многоцелевой (тироидные гормоны располагают рецепторами во всех клетках).
Специфичность не означает абсолютной уникальности и независимости действия разных гормонов на процессы обмена. Отдельные гормоны в разных концентрациях и на различном контекстном фоне дополняют и даже взаимозамещают друг друга. На последнем обстоятельстве основано получение синтетических аналогов гормонов (преднизолон, декса-
метазон, контрацептивы и др.), а также антигормонов (спиронолактоны, альдактон, верошпирон).
Наиболее важный принцип, на котором основано современное понимание механизмов влияния гормонов на клетки, — принцип пермиссивного взаимодей-
ствия гормонов. Образ гормона как пальца, нажимающего на клавишу пишущей машинки, устарел. Еще в первой половине XX века бытовало представление о том, что роль гормонов сводится к независимому запуску определенного стандартного набора клеточных ответов через чувствительный к данному гормону рецептор.
Однако ряд авторов и, прежде всего, первооткрыватель липидной природы гормонов коры надпочечников А.А. Богомолец (1908) справедливо указывали на теоретическую недостаточность таких построений, подчёркивая, что близость или противоположность
того или иногоконкретногоэффекта двух гормонов еще неравнозначна синергизмулибоантагонизмувзаимных влияний соответствующих желёз. А.А. Богомолец прозорливо указывал на множественность и неоднозначность эффектов гормонов.
Особое значение он придавал полученным его уче-
ником Л.Р. Перельманом данным о пермиссивном действии гормонов. Будучи еще очень молодым ученым, помощник прозектора из г. Саратова Л.Р. Перельман (1924) показал, что предварительная кастрация у котов и самцов собак снимает судорожный синдром, вызванный удалением паращитовидных желёз, несмотря на то, что уровень кальция в крови кастрированных паратиропривных животных остаётся низким. Таким образом, «конечный результат опыта определяется физиологическим состоянием периферического органа... Состояние периферии оказывается решающим моментом в реакции её на гормональные и нервные влияния» (А.А. Богомолец,
1937). Ныне представление о пермиссивном действии одного гормона (биорегулятора) на эффекты другого — один из краеугольных камней эн-
докринологии. Эффект одного биорегулятора может меняться под действием другого на пострецепторном уровне, на эффекторном уровне или путём влияния одних гормонов на экспрессию рецепторов других. На-
рушения пермиссивного действия гормонов способ-
ны приводить к патологии. Так, глюкокортикоиды контролируют экспрессию катехоламинового рецептора и пермиссивно влияют на концентрации ц- АМФ в клетках, облегчая действие катехолами-нов и на пострецепторном уровне. Поэтому в условиях гипокортицизма адреналин не оказывает должного гликогенолитического действия, и болезнь Аддисона протекает с тенденцией к гипогликемии. В то же время гиперкортицизм усиливает гипертен-зивное действие катехоламинов, что имеет значение в патогенезе многих форм повышения артериального давления. Это особенно актуально для подростков, у которых даже относительно повышенная активность коры надпочечников может способствовать дебюту артериальной гипертензии (например, при гипоталамическом синдроме пубертатного периода или ожирении с розовыми стриями).
Пермиссивностъ означает, что в общей эндокринной оркестровке, кроме суммации, прямого антагонизма или синергизма, имеет место важнейшее явление, когда гормон действует не просто в качестве компле-
ментарного рецептору сигнала-триггера, но и вы-
20
