
- •Майкл а. Гриппи патофизиология легких
- •Предисловие к изданию на русском языке
- •Часть I
- •Глава 1
- •Майкл а. Гриппи
- •Глава 2 Механика дыхания
- •Закладка
- •I лава с.. Тслагтиа «цылапуш
- •Глава 3. Распределение вентиляции
- •Глава 4. Физиологические основы тестирования функЦий лэтКих
- •Глава 5
- •Глава V
- •Глава 7
- •Глава 8
- •Часть II
- •14 800/Мм3', полиморфноядерные - 71 %, палочкоядерные - 6 %, лимфоциты -
- •Часть III
- •Глава 12
- •Глава 13
- •V/q отношения в нормальном легком
- •Глава 15
- •Часть IV
- •Глава 17
- •Глава 7 9
- •308______Приложение 1. Символы и понятия, общепринятые в физиологии дыхания
- •Глава 10;
- •Часть I Структурно-функциональные связи легких,
- •Глава 1. Структура воздухоносных путей и паренхимы легких
- •Глава 2. Механика дыхания (Майкл а. Гриппы)..............................................................
- •Глава 3. Распределение вентиляции (Майкл а. Гриппы).....,.........................................
- •Глава 4. Физиологические основы тестирования
- •Глава 5. Механизм бронхоконстрикции и бронхиальная астма
- •Глава 6. Хроническая обструктивная болезнь легких
- •Глава 7. Иммунология легких и интерстициальные
- •Глава 8. Клинические примеры: механика дыхания, обструктивные
- •Глава 9. Обмен газов в легких (Майкл а. Гриппи)......................................................139
- •Глава 10. Транспорт газов к периферическим тканям
- •Глава 11. Клинические примеры: обмен газов и их транспорт
- •Часть III. Легочное кровообращение и его отношение
- •Глава 12. Легочное кровообращение (Гарольд и. Належки)....................................179
- •Глава 13.Вентиляционно-перфузионные отношения (Пол н. Ланкен)...............195
- •Глава 14. Кардиогенный и некардиогенный отек легких
- •Глава 15. Клинические примеры: легочное кровообращение
- •Часть IV. Интегрированные дыхательные функции:
- •Глава 16. Гуморальная и нервная регуляция дыхания (Скотт Менакер)...............237
- •Глава 17. Регуляция дыхания во время сна (Ричард Шваб)........................................251
- •Глава 18. Патофизиология дыхательной недостаточности (Пол я. Ланкен)..........265
- •Глава 19. Физиология мышечной деятельности
- •Глава 20. Клинические примеры: нарушения регуляции дыхания и дыхательная недостаточность (Майкл л. Гриппы) .........................................297
- •194021, Ул. Политехническая, д. 26 телефакс (812) 247-9301
- •109202, Перовское шоссе, д. 10 телефакс (095) 170-6674 e-mail: poznkn@orc.Ru
- •703475, Москва, ул. Краснопролетарская, д. 16
Часть IV
.Интегрированные дыхательные функции: регуляция дыхания, дыхательная недостаточность, дыхание при физической нагрузке
I У/CTOGl I \*J
Гуморальная и нервная регуляция дыхания
Скотт Менакер
В предыдущих главах обсуждались функциональная анатомия, механика и биофизика дыхательной системы, управляющие обменом О2 и СО2 между вдыхаемым воздухом и циркулирующей кровью. Чтобы потребление О2 и продукция СО2 соответствовали разнообразным требованиям организма, связанным с повседневной активностью, а величины Ра()2 и РаС()2сохранялись в узких физиологических пределах, необходимы приспособительные изменения минутной вентиляции (Vl<;). Для достижения этого гомеостатического эффекта существует сложная система регуляции дыхания.
Эта глава посвящена главным образом хемо- и механорецепторам системы регуляции дыхания. Кроме того, рассматриваются ее интегрированные ответы на значительные патофизиологические возмущения.
Обзор системы регуляции дыхания
Подобно многим физиологическим системам контроля, система управления дыханием организована как контур отрицательной обратной связи (рис. 16-1). Вдыхаемый газ поступает по ВП к альвеолам, где он участвует в обмене газов на уровне альвеолярно-капиллярной мембраны (гл. 9). Рецепторы откликаются на информацию о механических явлениях (например, о наполнении легких) и гуморальных параметрах (например, Ра()2 и РаС()2). Эта информация интегрируется в дыхательном центре продолговатого мозга, который модулирует нервный импульс к мотонейро-мам, иннервирующим дыхательные мышцы. Координированное возбуждение респираторных мотонейронов приводит к синхронному сокращению дыхательных мышц, создающему воздушный поток.
Когда химические возмущения, подобные гипоксии или гиперкапнии, распознаются хеморецепторами, их сигналы в дыхательном центре реализуются повышенной нервной импульсацией к респираторным мотонейронам, что вызывает повышение минутной вентиляции. Артериальная гипокапния, напротив, вызывает уменьшение вентиляции.
Гуморальная регуляция дыхания
Дыхательная система поддерживает адекватные уровни О2 в артериальной крови, обеспечивая метаболизм периферических тканей, и предотвращает накопление СО2, количество которого увеличивается в процессе метаболизма. Высокоспециализированные ткани контролируют уровень О2 в артериальной крови и уровень СО2 в обильно перфузируемом органе — головном мозге. Эти два сенсорных механизма обеспечивают быстрое изменение характера вентиляции в зависимости от отклонений в газообмене.
Рис. 16-1. Система регуляции .мхамим как копту р отри uaKvib-ioii обратной свя:ш

Центральные хеморецепторы
Из нескольких хемосенсоров, контролирующих обмен газов, ответственность за обнаружение отклонений в гомеостазисе СО2 лежит в основном на центральных хеморецепторах. Несмотря на то, что нейроны, частота импульсации и возбудимость которых модулируются отклонениями Рсо2, обнаружены во многих областях центральной нервной системы, клетки, способные передавать информацию в дыхательный центр, расположены в продолговатом мозге.
Центральные хеморецепторы располагаются вблизи вентральной поверхности продолговатого мозга, где корешки подъязычного нерва выходят из мозгового ствола. Хотя их точное расположение, нервные контакты и нейрохимия изучены недостаточно, эти хемочувствительные клетки, вероятно, отличаются от соседних нейронов, которые обеспечивают дыхательный ритмогенез и составляют основу дыхательного центра.
Хемочувствительные клетки реагируют на отклонения в [1-Г ] и Рсо2 во внеклеточной жидкости внутримозгового интерстициального пространства. Ранее измерения в цереброспинальной жидкости использовались для оценки химизма внутри-мозгового интерстициального пространства. Последние исследования с применением рН-чувствительных электродов показали, что увеличение минутной вентиляции тесно связано с повышением [Н+] во внеклеточной, а не в спинномозговой жидкости.
Когда местная [H^J увеличивается, что эквивалентно падению рН, дыхательный центр увеличивает вентиляцию по сигналу от центральных хеморецепторов. Однако отклонения во внеклеточной [ tT j - не единственный стимул для центральных хеморецепторов. Рост вентиляции в ответ на изолированное повышение внеклеточной [Н+] в отсутствие изменений Рсо-, (изокапнический метаболический ацидоз) происходит медленнее. Кроме того, вентиляторная реакция меньше по величине (рис. 16-2), чем наблюдаемая при изолированном повышении Рсо^ (дыхательный ацидоз).
Одной из причин высокой скорости вентиляторного ответа на гииеркапнию является легкость диффузии СО2 через барьерную систему кровь-головной мозг. Однако этот барьер относительно непроницаем для ионов II* и | НСО < ]. Более того, повышенное РС()-г вызывает расширение сосудов, особенно церебральных, способствуя тем самым усилению диффузии СО2 через гемато-энцефалический барьер. Диффузия СО2 представляет собой еще один важный механизм усиления связи отклонений в кислотно-основном состоянии организма с центральными хеморецеп-торами.

Рис. 16-2. Отношение между |11*| но и не клеточной жидкости продолговатого мо.чга и частотой импульсации или "минутной активностью" диаф-рагмалыюго нериа. |1Г| в медуллярной внеклеточной жидкости повышалась при дыхательном ацидозе (кружки) и метаболическом ацидозе путем ипфузии HCI (треугольники). Вентиляторная реакция на гинеркампию сильнее, чем на метаболический ацидоз, несмотря на сходство отклонений в |1Г| медуллярной внеклеточной жидкости. (Из: lildridge I;.L., KileyJ.P., Millhorn D.H. Respiratory responses to medullary hydrogen ion changes in cats: Different effects of respiratory and metabolic acidosis. J. Physiol. 358: 285-297, 1985.)
При дыхательном ацидозе повышенное РаС( )2 вызывает увеличение диффузии СО2 через барьер кровь-головной мозг. Повышенное СО2 приводит к росту [Н+] около центральных хеморецепторов, которые обнаруживают это изменение и сигнализируют в дыхательный центр о повышении вентиляции, компенсирующем дыхательный ацидоз. Поскольку вентиляторный ответ на увеличение [Н+], обусловленное повышением РС()2, больше, чем ответ на идентичное отклонение [ЬГ] в отсутствие роста Рсо, (рис, 16-2), то РС()2 и [Н+] должны представлять независимые стимулы центральных хеморецепторов. Молекулярные механизмы рецепции остаются неизвестными: либо [Н*] и РС()2 образуют различные стимулы для единого сенсорного механизма, либо специфические стимулы для различных сенсорных механиз-
мов.
Поскольку закисление мозговой интерстициальной жидкости является важным этапом центральной хеморецепции, необходимо выделить главные факторы, влияющие на этот процесс.
В отличие от крови, церебральная интерстициальная жидкость содержит очень мало белка. Без белков с их буферной способностью сдвиги рН во внутримозговой внеклеточной жидкости происходят быстрее, чем в крови. Кроме того, компенсаторный вентиляторный ответ на хроническое закисление мозговой внеклеточной жидкости (как при хронической гиперкапнии) наступает быстрее, чем при закисле-нии крови. Перемещение [HCCV] из крови через гемато-энцефалический барьер в мозговую интерстициальную жидкость происходит влечение 24—48 ч. Задержка [ НСО;< ] в почках в ответ на закисление плазмы занимает от 48 до 72 ч.
Карогидные тельца
В то время как мониторинг РС()2 происходит в стволе головного мозга, отслеживание Р( )2 является функцией исключительно каротидныхтелец (рис. 16-3). Они расположены у бифуркации общих сонных артерий на внутреннюю и наружную (рис. 16-3 А). Несмотря на свой миниатюрный размер, каротидные тельца получают огромный кровоток - от 1.4 до 2.0 л/мин на 100 г ткани, что соответствует особой роли этого органа, как главного датчика, чувствительного к колебаниям кислорода в артериальной крови.


Рис. 16-3. Каротидиос тельце. (А) бифуркация правой сонной артерии (вид спереди). Общая сонная артерия (1) делится па наружную (2) и внутреннюю (.4). Каротидное тельце (4) иппсрвирустся чувствительными волокнами, исходящими из каменистого ганглия (5) и проходящими в составе нерва каротидпого синуса (ft). Верхний шейный ганглий (7) тоже интернирует каротидное тельце посредством гапглиогломсрулярных нервов (8). Узловатый ганглий (9) расположен снаружи внутренней сонной артерии. (Б) Каротидиое тельце, состоит из хеморецепторпых (1) и поддерживающих (2) клеток. В цитоплазме хсморецепторпых клеток находятся сииаптические пузырьки (Л), которые тесно соприкасаются с чувствительными окончаниями (4) ветвящихся волокон нерва каротидпого синуса (5). Вся совокупность этих клеток окружена капиллярами (ft). (Из: (ion/ale/. С'., Alinarax L, Obeso Д., Ritual R. Oxygen and acid chemorcccption in the carotid body chemoreceptors. Trends in Neuroscicncc 15: I/I ft-153/1992.)
Типы клеток в каротидном тельце
Каротидные тельца состоят из клеток нескольких типов (рис. 16-ЗБ). Главной из них является гломусная клетка (I тип). Она содержит несколько нейротрансмит-теров, включая большое количество допамина и других катехоламинов, а так же серотонин, ацетилхолин и некоторые нейропептиды. Гломусные клетки являются настоящими хемочувствительными клетками.
Группы гломусных клеток окружены поддерживающими клетками (II тип). На одну поддерживающую клетку приходится от трех до шести гломусных. Физиологическая роль поддерживающих клеток неизвестна. Считается, что эти клетки ультраструктурно и функционально связаны с глией центральной нервной системы. Группы гломусных клеток и окружающие их поддерживающие клетки снабжены богатой сетью капилляров, которые обеспечивают оптимальные условия для их хе-мосенсорной функции относительно кислорода.
Функция каротидных телец
v
Гломусные клетки образуют синапсы с афферентными волокнами нерва каро-тидного синуса. Чувствительная ветвь языкоглоточного нерва и нерв каротидного синуса иннервируют каротидное тельце и барорецепторы каротидного синуса. Афферентные волокна языкоглоточного нерва берут свое начало в чувствительных нейронах каменистого ганглия. В ответ на артериальную гипоксемию гломусные клетки высвобождают допамин пропорционально степени снижения РаО2. Высвобождение допамина модулируется отклонениями рН, вызванными метаболическим или дыхательным ацидозом, и приводит к значительному повышению тонической активности афферентных чувствительных волокон каротидных телец. Эти афферентные волокна проявляют некоторую степень тонической активности в условиях нормок-сии и даже гипероксии. Они "замолкают" только в присутствии выраженной артериальной гипероксии и гипокапнии (рис. 16-4).
Когда РаО2 падает ниже 60 мм рт. ст., активность афферентных нервов каротидного тельца возрастает экспоненциально (рис. 16-4 А). Поскольку частота импульса-ции единичного афферентного волокна каротидного тельца составляет от 5 до 25 импульсов в секунду, каротидное тельце быстро отвечает на изменения РаО2, происходящие в течение одного дыхательного цикла. ,
Важнейшее значение каротидного тельца в регуляции оксигенации подтверждается тем, что после его двустороннего удаления или денервации гипоксический вентиляторный ответ у человека полностью исчезает. У некоторых других биологических видов подобные кислород-чувствительные органы присутствуют также в дуге аорты. Этим аортальным тельцам свойственна реактивность, функционально подобная реактивности каротидных телец.

Рис. 16-4. Активность каротидного тельца как функция Рао2 или Расо2. (А) Активность одиночного афферентного волокна каротидного тельца как функция Paov при трех различных уровнях Расо2. (Б) Активность одиночного афферентного волокна каротидного тельца как функция Расо, при четырех различных уровнях Рао2. (Из: Cherniack N.S, Pack A.I. Control of ventilation. In: Fishman A.P., ed. Pulmonary Diseases and Disorders. New York: McGraw-Hill, 1988: 133.)

В отличие от решающей роли каротидных телец в регуляции оксигенации, их участие в формировании вентиляторного ответа на изменение РаС()2 сравнительно невелико. Несмотря на то, что частота импульсации афферентных нервов каротид-ного тельца четко варьирует в соответствии с изменением РаС()2 (рис. 16-4Б), дополнительная афферентная активность в ответ на метаболические или дыхательные стимулы не влияет на степень повышения минутной вентиляции, вызываемой центральными хеморецепторами. Более того, денервация каротидного тельца снижает вентиляторный ответ на повышение РаС()2 не менее чем на 20 %. Это служит дополнительным доказательством того, что каротидное тельце играет небольшую роль в вентиляторной реакции на ацидоз.
Нервная регуляция дыхания
Дыхательный центр получает также проприоцептивные и болевые импульсы от легких. Эта информация передается легочными афферентными волокнами блуждающего нерва, чьи клеточные тела расположены в узловатом ганглии. Чувствительные окончания этих нервов локализованы в различных местах легких, в то время как центральные окончания — в синапсах ядра солитарного тракта в среднем мозге. Основные типы легочных вагусных афферентов включают: (1) медленно адаптирующиеся рецепторы растяжения, (2) быстро адаптирующиеся рецепторы растяжения и (3) С-волокна.
Медленно адаптирующиеся рецепторы растяжения
Медленно адаптирующиеся рецепторы растяжения являются важной группой легочныхмеханорецепторов. Эти вагусные афферентные структуры состоят из широких миелинизированных волокон, чьи чувствительные окончания лежат в гладких мышцах ВП. Частота импульсов медленно адаптирующихся рецепторов растяжения увеличивается с наполнением легких (рис. 16-5). Во время поддерживаемого на одном уровне наполнения легких активность рецептора сохраняется даже при минимально сниженной частоте разрядов (рис. 16-5А), что обеспечивает дальнейший ввод информации в дыхательный центр об уровне наполненности легких. Медленно адаптирующиеся рецепторы растяжения играют важную физиологическую роль ъ рефлексе Геринга-Бройера, который регулирует окончание вдоха и продление выдоха.
Рис. 16-5. Реакции двух типов легочных вагусных афферентных етруктур на степень наполненности легких. И каждой части рисунка верхнее изображение представляет наполненность легкого, измеренную с помощью внутритрахеалыюго давления, а нижнее — импульсную активность структур. (А) Медленно адаптирующиеся рецепторы растяжения. (Б) 1>метро адаптирующиеся рецепторы растяжения. (Из: Knowlton С.С, Larrabce M.G. A unitary analysis of pulmonary volume receptors. Ain.J. Physiol. 147: 100-IK 19/16.)

Быстрое наполнение легких во время вдоха увеличивает частоту импульсации медленно адаптирующихся рецепторов растяжения, что ведет к прекращению вдоха. В экспериментальных условиях быстрое наполнение легких во время выдоха увеличивает частоту импульсации рецепторов растяжения, тем самым продлевая экспираторную фазу и подавляя начало следующего вдоха. Следовательно, постепенное наполнение легких укорачивает вдох и удлиняет выдох в зависимости от момента возникновения этого наполнения в ходе нервного дыхательного цикла.
Рефлексы Геринга-Бройера включаются, когда дыхательные объемы превышают 1 л (например, у взрослых во время физической нагрузки); при спокойном дыхании они не проявляются. Эти рефлексы, возможно, более важны для координации дыхательного акта у новорожденных, чем у взрослых.
Денервация легких (как при их двусторонней трансплантации) оказывает сравнительно небольшое влияние на регуляцию дыхания, хотя дыхательный объем может возрастать (рис. 16-6). Эти данные согласуются с утратой объемзависимой обратной связи с дыхательным центром.
Быстро адаптирующиеся рецепторы
Быстро адаптирующиеся рецепторы, также известные как ирритантные рецепторы, составляют вторую основную категорию легочных механорецепторов. Чувствительные окончания этих широких миелинизированных вагусных афферентных волокон локализованы между эпителиальными клетками ВП. Быстро адаптирующиеся рецепторы стимулируются при вдыхании таких вредных агентов, как пыль, некоторые газы и холодный воздух. Они также реагируют на раздувание легких, но их частота импульсации быстро падает при сохранении достигнутого объема (рис. 16-5Б) - отсюда название "быстро адаптирующиеся". Помимо этого, стимуляция быстро адаптирующихся рецепторов вызывает бронхоконстрикцию и частое поверхностное дыхание. Она также является важным механизмом кашля и тахикардии и может быть клинически значимой в патогенезе бронхиальной астмы и нарушений реактивности дыхательных путей (гл. 5).

Рис. 16-6. Отношение между дыхательным объемом (выраженным как доля форсированной жизненной емкости легких) и Рсо2 конца выдоха при ингаляции гиперкапни-ческого газа у здоровых людей (открытые кружки), реципиентов сердца (открытые квадраты) и реципиентов трансплантата сердце—легкие (закрытые кружки). Денервация легких при трансплантации сердца и легких влечет за собой увеличение дыхательного объема как во время покоя, так и в периоды увеличенной минутной вентиляции. Это связано с утратой отрицательной обратной связи с дыхательным центром. (Из: Duncan S.R., Kaga-wa F.T., Vaughn A.S., Theodore J. Hypercarbic ventila-tory responses of human heart-lung transplant recepients. Am. Rev. Respir. Dis. 144: 126-130, 1991.)
С-волокна Классификация и активность
Третьей главной группой легочных механорецепторов являются С-волокна — тонкие немиелинизированные волокна, представляющие собой медленно проводящие вагусные афференты. С-волокна оканчиваются в паренхиме легких, ВП и кровеносных сосудах. Следовательно, они доступны для медиаторов, присутствующих в крови капилляров или бронхиальных артерий.
Существуют два типа С-волокон: легочные и бронхиальные. Легочные С-волокна оканчиваются в паренхиме легких; и в эксперименте стимулируются веществами, вводимыми в легочную артерию. Бронхиальные С-волокна оканчиваются в крупных ВП и кровеносных сосудах; в эксперименте стимулируются веществами, вводимыми в бронхиальную артерию. С-волокна могут активироваться экзогенными химическими агентами (например, капсаицином или фенилдигуанидом) или эндогенными субстанциями (например, брадикинином).
Активность С-волокон не зависит от фазы дыхания; им принадлежит небольшая роль при нормальных вдохе и выдохе. Эти волокна стимулируются вдыханием раздражающих агентов (токсичные газы или частицы), а также механическим раздражением ВП. В общем, активация С-волокон приводит к частому поверхностному дыханию, которое ограничивает рассеивание потенциально вредных агентов по трахеобронхиальному дереву. С-волокна могут играть важную роль в передаче ощущения диспноэ в различных клинических ситуациях, таких как отек легких, пневмония или вдыхание токсических веществ. Их стимуляция вызывает брадикардию и секрецию слизи. Последняя может быть важной в патогенезе обструктивной болезни легких.
J-рецепторы
В состав С-волокон входятJ-рецепторы, которые оканчиваются в паренхиме легких, прилегающей к капиллярам (юкстакапилляр), и стимулируются развитием интерстициального отека (гл. 14). Активация J-рецепторов вызывает закрытие гортани и апноэ, за которым следует частое поверхностное дыхание. J -рецепторы также могут иметь важное значение в передаче ощущения диспноэ не только при отеке легких, но и при пневмонии и легочной эмболии.
Дополнительные дыхательные чувствительные структуры
Помимо центральных и периферических хеморецепторов и легочных механорецепторов, поток информации в центральный контроллер (дыхательный центр) обеспечивает широкий ряд других чувствительных структур.
Рецепторы верхних воздухоносных путей
Рецепторы, располагающиеся в носовой полости и верхних ВП, отвечают как на механические, так и химические стимулы. Эти рецепторы сходны с быстро адаптирующимися рецепторами в легочной паренхиме. Их стимуляция приводит к кашлю, чиханию, бронхоконстрикции и спазму гортани.
Проприоцептивные афференты
Проприоцептивные афференты в периферических суставах и мышцах могут играть существенную роль в усилении вентиляции при физической нагрузке. Подобным же образом в регуляции деятельности дыхательных мышц могут участво-
Мышечные веретена
Мышечным веретенам принадлежит главная роль в регулировании силы мышечного сокращения, осуществляемом посредством спинальных рефлексов. Вероятно, мышечные веретена играют такую же роль в регулировании силы сокращения дыхательных мышц, за исключением диафрагмы - главной мышцы вдоха, которая почти, если не полностью, лишена мышечных веретен. Несмотря на то, что асинхро-иия афферентации от мышечных веретен, вполне возможно, является причиной диспноэ, эти веретена могут быть важны в генерировании максимальной силы выдоха для устранения обструкции ВП.
Висцеральные и кожные афференты
Висцеральные и кожные чувствительные структуры также участвуют в передаче информации в центральный дыхательный контроллер, о чем свидетельствует возникающая при боли и повышении температуры кожи гипервентиляция.
Дыхательные нейроны и дыхательный ритмогенез
Во время бодрствования дыхание может сознательно регулироваться, как например во время физических упражнений или речи. Однако когда человек спит или находится в бессознательном состоянии, дыхание осуществляется "автоматически", так же как сокращения сердца и кишечника. Схема нервной регуляции дыхания отличается от структуры управления автономными функциями и двигательной активностью.
Дыхательная нейроанатомия
Обширная сеть дыхательных чувствительных афферентных структур снабжает информацией дыхательный центр продолговатого мозга. В начале XX в. было усга-i ювлено, что перерезка нервной системы по понтомедуллярной границе не устраняет спонтанное дыхание, в отличие от отсечения по медуллоспинальной границе.
Если "автоматическое" дыхание регулируется продолговатым мозгом, то в произвольном или поведенчески регулируемом дыхании участвуют сигналы, нисходящие к нему (продолговатому мозгу) из мозговой коры, промежуточного мозга и других структур головного мозга. Сложные акты, подобные речи, физической нагрузке и "предупреждающему" дыханию (например, дыхание, предшествующее физическому напряжению) являются примерами такого поведенчески .контролируемого дыхания.
Точные представления о нейронах, ответственных за дыхательный ритмогенез, отсутствуют. Идентифицированы, по крайней мере, три группы клеток, каждая из которых включает нейроны, чьи паттерны возбуждения тесно связаны с дыхательным циклом (рис. 16-7).
Первая группа нейронов располагается в ядре Кёлликера-Фузе в клювовидно-латеральной части варолиева моста. Эти нейроны не участвуют в автоматическом дыхании, но, возможно, играют определенную роль в приспособлении дыхательного ритма к физиологической и поведенческой активности.
Вторая группа локализована в латеральном отделе ядра солшпарного тракта на дорзальной поверхности продолговатого мозга. Эта дорзальная дыхательная группа состоит главным образом из нейронов, которые возбуждаются преимущественно во время вдоха.
Третья группа находится в вентролатералъной части продолговатого мол/а вблизи двойного ядра. Она состоит исключительно из экспираторных нейронов.
Рис. 16-7. Паттерны импуль-сации дыхательных нейронов и ходе дыхательного цикла. Представлены типичные пат-термы им пульсации отдельных дыхательных нейронов мо:п*опого ствола. Каждый тип нейрона возбуждается в одну н.ч трех фал дыхательного цикла: начало вдоха, конец вдоха и выдох. Кроме того, паттерн возбуждения может отражать возрастающую или угасающую активность нейрона в течение дыхательного цикла (Из: Keldwan J.I.., Neurophysiology of breathing in mammals. In: Bloom КН., ed. Handbook of Physiology; The Nervous System IV: Intrinsic Regulatory Systems of the Brain. Washington, DC: American Physiological Society, 1986: 4М-Я24.)
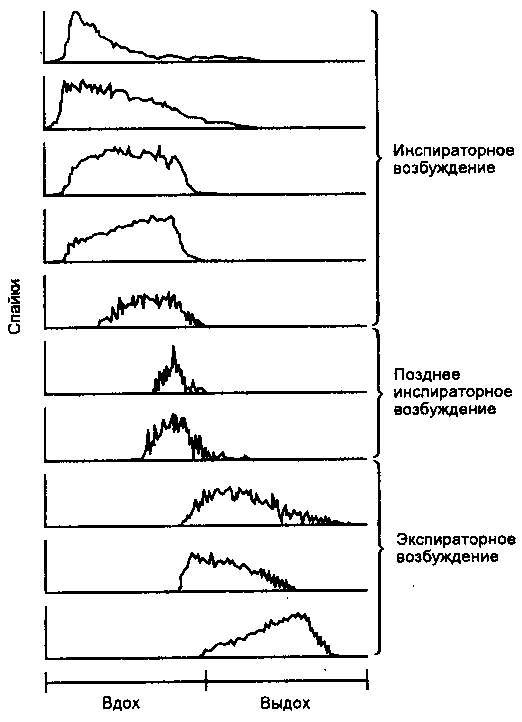
Хотя главные характеристики возбудимости и проводимости этих трех групп известны, представления о точном механизме дыхательного ритмогенеза остаются противоречивыми.
Механизмы дыхательного ритмогенеза
Существуют две основные теории дыхательного ритмогенеза.
Согласно одной из них возбуждение так называемых клеток у слоеного водителя ритма в продолговатом мозге синхронизируется с фазами дыхательного цикла. Ритмическая активность сохраняется в этих клетках в отсутствие каких бы то ни было связей с синапсом, напоминая этим активность клеток проводящей системы сердца.
В соответствии с альтернативной теорией отдельного пейсмекерного ядра или пейсмекериых клеток не существует. Скорее, внутри основных скоплений дыхательных нейронов есть группа клеток, чей объединенный импульсный паттерн вызывает вдох и выдох — колебательный дыхательный контур.
Центральная интеграция афферентных сигналов
Как описано выше, сложная совокупность чувствительных структур обеспечивает информацию о состоянии верхних и нижних дыхательных путей, обмене газов и мышечной активности. Кроме того, дыхательная система реагирует на три клини-
чески важных вентиляторных стимула: отклонения РаСО2, Ра()2 и кислотно-основного равновесия.
Реакция на изменения Расо2
Возможно, наиболее существенным фактором регулирования минутной вентиляции в состоянии покоя является уровень РаС()2, отслеживаемый центральными хеморецепторами. Когда здоровый человек дышит в замкнутом контуре, в котором накапливается выдыхаемая двуокись углерода, вдыхание СО2 приводит к повышению РаС()2 со скоростью приблизительно 4 мм рт. ст. в 1 мин. Если артериальное содержание О2 держится на постоянном уровне, минутная вентиляция возрастает примерно на 2-3 л/мин на каждый 1 мм рт. ст. повышения РаСО2 (рис. 16-8). Понижение концентрации О2 во вдыхаемой смеси газов (снижающее РаО2) повышает не только минутную вентиляцию при заданном уровне РаСО2, но также скорость нарастания минутной вентиляции с повышением РаС()2 (синергическая связь). Дыхательный контроллер отслеживает изменения как Ра()2, так и РаС()2, а сочетание гипоксии с гиперкапнией приводит к большему увеличению минутной вентиляции, чем любой из этих стимулов в отдельности.
Итак, увеличение РаС()2 приводит к возрастанию минутной вентиляции. Однако центральные хеморецепторы отслеживают также и снижение РаС()2, которое приводит к ослаблению центрального влияния на дыхание. Следоэателъно, понижение РаС()2 (например, во время искусственной вентиляции легких) может вызывать уменьшение минутной вентиляции. Несмотря на то, что гипервентиляция не провоцирует апноэ у бодрствующего человека, падение РаС()2 вследствие гипервентиляции может привести к апноэ во время сна (гл. 17). Пониженная центральная хемо-чувствительность в большей степени влияет на уменьшение минутной вентиляции, чем снижение фактического уровня РаС()2. Посредством этого механизма происходит снижение минутной вентиляции в состоянии покоя и при ингаляции обогащен-
Рис. 16-8. Реакция вентиляции на увеличение Расоан ходе вогшратпо-14) дыхания при трех различных уровнях Рао,. Наклон кривой увеличивается с ростом гииоксемии. (Из: Neilson M, Smith II. Studies on the regulation of respiration in acute hypoxia. With an appendix on respiratory control during prolonged hypoxia. Acta Physiol. Scand. 24: 293-313, 1951.)

ной СО2 газовой смеси у пожилых людей, спортсменов и людей, принимающих
наркотики.
При рассмотрении вентиляторных реакций на гипокапнию и гиперкапнию важно учитывать, что "стимул к дыханию" не всегда вызывает увеличение вентиляции. Например, дыхание через соломинку увеличивает работу дыхания. Однако измерения минутной вентиляции в период дыхания гиперкапнической газовой смесью через соломинку показывают пониженную вентиляторную реакцию на СО2, несмотря на усиление гиперкапнического стимула дыхания. Аналогично этому, понижается вентиляторный ответ на гиперкапническую газовую смесь при различных обструк-тивных и рестриктивных болезнях легких, что обусловлено не столько сниженной центральной хемочувствительностью, сколько механическими ограничениями вентиляции (гл. 2-7).
Реакция на изменения Рао2
При нормальном РаС()2 минутная вентиляция не растет до тех пор, пока Ра()2 не упадет ниже 60 мм рт. ст. (рис. 16-9). Этот эффект основан на минимальном изменении активности каротидного тельца при РаО2 выше 60 мм рт. ст. Из описанных ранее исследований интегрального дыхательного ответа на гиперкапнию становится очевидно, что повышение РаС()2 увеличивает минутную вентиляцию при любом Ра()2. У здоровых взрослых людей в обычных условиях гипоксия не играет важной роли в стимулировании минутной вентиляции. Однако при определенных условиях (например, при патологии легких или во время нахождения на больших высотах) вентиляторный ответ на гипоксию приобретает решающее значение в поддержании газообмена и гомеос"газпса.
Реакция на метаболический ацидоз и метаболический алкалоз
Ионы [Н+] и [НСО;{ ] в крови находятся в равновесии с Н2О и СО2(гл. 10). Увеличение [Н*] (например, при лактат-ацидозе) нарушает это равновесие и повышает РаС()2. Следовательно, существуют два независимых стимула к увеличению минутной вентиляции: повышение [ЬГ] и повышение РаС()2.
Рис. 16-9. Реакция вентиляции на гипоксию. При наличии гипокап-||ци (Pauv, - 35.8 мм рт. ст.) исн-i иляторная реакция на гипоксию не ijo.'ui икает пока Рао-,, не снизится до урои и я менее (>0 мм рт. ст. (Из: Loeschcke H.H., (•crt/ К.И. Intracraniclle Chcmo-rc/.eplorcn mil Wirkung auf die Atinun^. Ptliitfcrs Archiv 2(i7: 460-477, 1958.)

Однако в условиях "чистого" метаболического ацидоза повышенное РаС()2 наблюдается только в том случае, если У[)/УТи минутная вентиляция остаются постоянными. Увеличение [НГ] при метаболическом ацидозе вызывает гипервентиляцию как компенсацию изменений рН; РаС()2, следовательно, понижается.
В противоположность метаболическому ацидозу дыхательная компенсация метаболического алкалоза — гиповентиляция — относительно слаба и весьма вариабельна у различных людей.
Избранная литература
Eldridge F.L., Kiley J.P., Millhorn D.E. Respiratory responses to medullary hydrogen ion changes in cats: Different effects of respiratory and metabolic aciddsis. J, Physiol. 358: 285-297,1985.
FeldmanJ.L. Neurophysiology of breathing in animals. In: Bloom F. E., ed. Handbook
of Physiology: The Nervous System IV: Intrinsic Regulatory System of the Brain.
Washington, DC: American Physiological Society, 1986:436—524. Gonzalez C., Almaraz L, Obeso A., Rigual R. Oxygen and acid chemoreception in the
carotid body chemoreceptors. Trends in Neuroscience 15:146—153, 1992. Richter D. W., Ballantyne D., RemmersJ. How is the respiratory rhythm generated?
A model. News in Physiologic Sciences 1: 109—112,1986.
