
3 курс / Патологическая физиология / pochek
.pdfТема: Патофизиология почек
Введение
Почки занимают одно из центральных мест в регуляции постоянства внутренней среды организма. Основные функции почек.
1.Выделительная (экскреторная) функция осуществляется почечными нефронами – удаление продуктов обмена веществ, токсичных веществ.
2.Гомеостатическая – поддержание постоянства внутренней среды организма (водноэлектролитный баланс, КОС, системное АД, ОЦК).
3.Инкреторная – синтез и выделение в кровь БАВ (ренин, эритропоэтин, активная форма витамина D, простагландины, брадикинин и др.).
4.Метаболическая – почки принимают активное участие в метаболизме белков, жиров и углеводов.
Общая этиология и патогенез расстройств функций почек
Причины заболеваний почек
I. По происхождению: первичные (наследственные и врождѐнные) и вторичные (приобретѐнные) факторы.
Первичные (наследственные, врождѐнные).
•Аномалии развития почек (числа, формы, макро- и микроструктуры).
•Тубулопатии (обусловлены преимущественным поражением канальцев почек: почечный диабет, почечный псевдогипоальдостеронизм и др.).
•Энзимопатии эпителия канальцев (например, цистинурия, аминоацидурия).
•Нефропатии (генерализованные поражения почек – семейная нефропатия, семейная почечная дистрофия и др.).
Вторичные (приобретѐнные, симптоматические).
•Инфекционные (микробного, паразитарного, грибкового, протозойного происхождения, например, пиелонефриты, эхинококкоз, актиномикоз почек).
•Иммуноаллергические (нефриты, иммуноаллергические нефропатии и др.).
•Обусловленные прямым повреждением почек (например, травмы, радиационные поражения; токсогенные, лекарственные нефропатии).
•Сопутствующие (сателлитные) нефропатии (при амилоидозе, СД, нефролитиазе, атеросклерозе, гипертонической болезни).
•Опухолевые поражения почек.
II. По природе причинных факторов: инфекционные (например, бактерии, вирусы, риккетсии) и неинфекционные (химические, физические и биологических факторы). Химические (например, соединения свинца, сулемы, ртути, мышьяка, некоторые антибиотики, диуретики). Физические (например, проникающая радиация, продукты радиоактивного распада, низкая температура, травма почек). Биологические (например, нефротоксические АТ и лимфоциты, иммунные комплексы; аллергены; катехоламины, простагландины и другие БАВ).
III. По уровню реализации причинного фактора. 1. Преренальные причины.
• Нервно-психические расстройства: длительный стресс, психические травмы, состояния, сочетающиеся с сильной болью (в частности, рефлекторная «болевая» анурия).
• Эндокринопатии (например, избыток или недостаток АДГ, альдостерона, тиреоидных гормонов, инсулина, катехоламинов).
• Расстройства кровообращения (в виде гипо- и гипертензивные состояния).
2. Ренальные причины. Прямое повреждение почек факторами инфекционного или неинфекционного характера. Нарушения кровообращения в почках.
1
3. Постренальные причины. Нарушение оттока мочи по мочевыводящим путям, сопровождающееся повышением внутрипочечного давления (при камнях и опухолях мочевыводящих путей, их отѐке, аденоме простаты, перегибах мочеточника и т.д.).
Общие механизмы (патогенез) расстройств экскреторной функции почек
Нарушения мочеобразования являются результатом расстройств следующих процессов:
•Фильтрации (образования первичной мочи в почечных тельцах),
•Реабсорбции (транспорта ионов, жидкости, белков, аминокислот, глюкозы и других веществ из просвета почечных канальцев в просвет капилляров вторичной сети),
•Секреции (транспорта ионов, жидкости и ряда других веществ в просвет канальцев).
Причины и механизмы нарушения фильтрации Процесс фильтрации осуществляется в начальной части нефрона – почечных клубочках,
где образуется первичная моча. Движущей силой, обусловливающей процесс фильтрации, является эффективное фильтрационное давление, которое создается в результате разности между гидростатическим давлением в капиллярах клубочка (~ 50-60 мм рт.ст.), способствующим прохождению элементов плазмы крови через фильтрующую мембрану (через стенку капилляра в просвет капсулы Шумлянского-Боумена), и противоположно действующими силами, создаваемыми онкотическим давлением плазмы крови (~ 25 мм рт.ст.) и давлением в капсуле Шумлянского-Боумена (~ 15 мм рт.ст.):
Рф = Ргк – ( Рон + Рм),
Рф – эффективное фильтрационное давление, Ргк – гидростатическое давление крови в капиллярах клубочка, Рон – онкотическое давление плазмы крови,
Рм – давления первичной мочи в капсуле Шумлянского-Боумена.
Гидростатическое давление в капиллярах клубочка является величиной, зависящей главным образом от мышечного тонуса стенок приводящей и отводящей артериол.
Сопротивление приносящей артериолы клубочка меняется в зависимости от системного АД. Онкотическое давление плазмы крови зависит от содержания в ней белков.
Давление в полости капсулы Шумлянского-Боумена определяется проходимостью почечных канальцев и мочевыводящих путей, а также зависит от внутрипочечного давления.
В среднем фильтрационное давление составляет около 20 мм рт.ст. Фильтрующая мембрана состоит из трех слоев: эндотелия капилляров, базальной мембраны и эпителиальных клеток (подоцитов) капсулы Боумена, покрывающих своими ножками наружную поверхность базальной мембраны.
Скорость клубочковой фильтрации устанавливается путем определения клиренса веществ, которые в почках только фильтруются, но не реабсорбируются и не секретируются в почечных канальцах (например, полисахарид инулин).
Клиренс (от англ. clear - очищать) соответствует объему плазмы крови, который полностью очистился от данного вещества за 1 мин.
Для определения клиренса необходимо установить концентрацию используемого вещества, например инулина, в моче (М) и плазме крови (К) и количество мочи (Д), выделившейся за 1 мин:
Клиренс = М/К х Д [мл/мин].
В клинических условиях чаще прибегают к определению скорости клубочковой фильтрации по клиренсу эндогенного креатинина (продукт распада мышечных белков). В норме
2
скорость клубочковой фильтрации по креатинину составляет 125-130 мл/мин для мужчин и 110115 мл/мин для женщин.
Механизмы нарушение клубочковой фильтрации. Нарушение клубочковой фильтрации сопровождаются либо снижением, либо увеличением объѐма фильтрата.
Причины снижение объѐма клубочкового фильтрата.
•Понижение эффективного фильтрационного давления при гипотензивных состояниях (артериальной гипотензии, коллапсе и др.), ишемии почки (почек), гиповолемических состояниях. При падении систолического АД ниже 50 мм рт.ст. фильтрация прекращается полностью.
•Повышение онкотического давления плазмы крови в результате увеличения концентрации белков, что может произойти при повышенном их синтезе (например, при миеломной болезни), введении белковых препаратов или сгущении крови.
•Уменьшение площади фильтрационной поверхности (наблюдается при некрозе почки или еѐ части, миеломной болезни, хронических гломерулонефритах и других состояниях).
•Снижение проницаемости фильтрационного барьера вследствие утолщения или уплотнения базальной мембраны или других еѐ изменений (хронические гломерулонефриты, сахарный диабет, амилоидоз и другие болезни).
•Увеличение давления в полости капсулы Боумена по причине повышения внутрипочечного давления при отеке интерстиция или нарушения проходимости канальцев и мочевыводящих путей.
Причины увеличение объѐма клубочкового фильтрата.
•Повышение эффективного фильтрационного давления при рефлекторном повышении тонуса отводящей артериолы или расслаблении приводящей, что имеет место при возбуждении симпатической нервной системы на начальной стадии лихорадки, при гипертонической болезни и др., а также вследствие гипоонкии крови (например, белково-калорийное голодание, нефротический синдром, разжижение крови при увеличенном приеме жидкости и др.).
•Увеличение проницаемости фильтрационного барьера под действием иммунных комплексов, аутоантител, продуктов ПОЛ, кининов, гистамина.
Изменение клубочковой фильтрации не всегда сопровождается соответствующим изменением диуреза, так как окончательный объем мочи зависит в значительной степени от выраженности процессов реабсорбции жидкости в канальцах.
Причины и механизмы нарушения функции канальцев
(канальцевой реабсорбции и секреции)
Канальцевая реабсорбция (обратное всасывание) – это транспорт необходимых организму веществ из канальцевой мочи в плазму крови околоканальцевых капилляров.
Несмотря на огромный объем клубочкового фильтрата (суточный объем клубочкового фильтрата равен 170-180 л – первичная моча), у человека выделяется за сутки 0,8-1,5 л окончательной мочи, что объясняется тем, что в почечных канальцах происходит процесс усиленной реабсорбции воды, электролитов, глюкозы, аминокислот и других веществ.
Поступление этих веществ через стенку канальцев в интерстиций и затем в околоканальцевые капилляры осуществляется с помощью различных механизмов:
1.активный транспорт веществ с затратой энергии против электрохимического или концентрационного градиента специфическими переносчиками;
2.пассивный транспорт веществ по концентрационному, осмотическому или электрохимическому градиентам (так транспортируются вода, бикарбонаты, мочевина, ионы Cl-);
3.транспорт белков, осуществляемый главным образом путем пиноцитоза.
Различают пороговые и беспороговые вещества. Пороговые вещества (глюкоза, аминокислоты, сульфаты, фосфаты и бикарбонаты) обратно всасываются лишь до тех пор, пока их
3
концентрация в крови не достигнет определенного уровня. Реабсорбция беспороговых веществ не зависит от их концентрации в крови.
Наиболее интенсивно процессы реабсорбции происходят в проксимальном канальце. Здесь всасывается 60-65% профильтровавшихся воды и Na+, а также высокий процент К+, Са2+, Mg2+, SO42-, HPO42-, Cl-, HCO3-, практически полностью реабсорбируются белки, витамины, аминокислоты, глюкоза, в значительном количестве – мочевина и мочевая кислота.
Впроксимальном канальце всасывание электролитов и других веществ происходит с эквивалентным количеством воды, и поэтому содержимое канальца остается изотоничным плазме.
Внисходящем фрагменте петли Генле происходит реабсорбция воды и мочевой кислоты. Восходящий фрагмент петли Генле совершенно непроницаем для воды, но здесь осуществляется активная реабсорбция электролитов (Na+, К+, Mg2+, Cl-).
Вдистальном канальце и собирательной трубочке происходит реабсорбция ионов Na+, Cl-, Са2+, воды и мочевины. Здесь процессы реабсорбции и секреции регулируются гормонами (АДГ, альдостерон) и зависят от потребностей организма (т.е. факультативная реабсорбция, в отличие от облигатного типа реабсорбции в проксимальном отделе нефрона).
Канальцевая секреция – это перемещение веществ в просвет канальца, с помощью активного и пассивного транспорта. В канальцах нефрона осуществляется секреция веществ из крови околоканальцевых капилляров, а также веществ, образующихся в клетках канальцевого эпителия.
Впроксимальном отделе канальцев нефрона происходит секреция: ионов Н+, NH3, щавелевой, мочевой и жѐлчных кислот, адреналина, ацетилхолина, гистамина, серотонина, тиамина, а также диодраста, парааминогиппуровой кислоты, различных ЛС (пенициллин, индометацин, атропин, салициловая кислота, фуросемид и др.).
Вдистальном отделе канальцев происходит секреция ионов Н+, К+, NH3.
Одной из важных особенностей функционирования почек является их способность к разведению и концентрированию мочи в зависимости от потребностей организма. Процессы разведения и концентрирования совершаются при участии петли Генле, собирательных трубочек, интерстиция и сосудов мозгового слоя почек в присутствии антидиуретического гормона (АДГ). Объем и плотность мочи у здорового человека могут колебаться в широких пределах в зависимости от количества поступившей в организм жидкости. Способность почек к концентрированию и разведению мочи устанавливается путем проведения пробы Зимницкого, а также проб с сухоядением и водной нагрузкой.
Механизмы нарушение функции канальцев. Нарушение процессов реабсорбциии и секреции в канальцах почек может сопровождаться расстройствами водно-электролитного обмена, кислотно-основного состояния, обмена глюкозы, аминокислот, гормонов.
Основные причины нарушение функции почечных канальцев:
•ферментопатии,
•дефекты систем трансэпителиального переноса веществ,
•мембранопатии (дистрофические изменения канальцевого эпителия),
•расстройства эндокринной регуляции.
Тубулопатии – это заболевания, обусловленные нарушением транспортных функций эпителия почечных канальцев.
По этиологии тубулопатии бывают: первичные (наследственные) и вторичные (приобретенные: действие ЛС (например, тетрациклина с истекшим сроком годности), отравление солями лития, висмута, ртути, свинца, кадмия; обширные ожоги, гиперпаратиреоз, опухоли различных органов, миелома, пиелонефрит и др.).
В зависимости от локализации различают тубулопатии проксимальные и дистальные.
1. Проксимальные тубулопатии. Обусловлены нарушением функции проксимальных канальцев. Нарушается реабсорбция органических соединений (глюкозы, аминокислот, белка, мочевины, лактата), а также бикарбонатов, фосфатов, Cl-, К+.
4
К этой группе относятся фосфатурия, почечная глюкозурия, аминоацидурия и проксимальный почечный ацидоз.
Фосфатурия возникает вследствие нарушения реабсорбции фосфатов, сопровождается гипофосфатемией, рахитоподобными изменениями в костях (семейная гипофосфатемия, витамин D-резистентный рахит). Патогенетический механизм: нарушение реабсорбции фосфатов (отсутствие транспортного белка) в проксимальных канальцах почек и недостаток рецепторов для связывания кальцитриола (активный витамин D).
Почечная глюкозурия возникает при нормальном уровне глюкозы в крови в случае нарушения процессов реабсорбции (может быть первичной (врождѐнной) или вторичной (приобретенной – при хронических гломерулонефритах, нефротическом синдроме и др.).
Почечная аминоацидурия обусловлена отсутствием транспортных белков-переносчиков, участвующих в реабсорбции аминокислот. Примером почечной аминоацидурии является цистинурия (наследственное заболевание). Возникает при нарушении обратного всасывания цистина (цистинурия может приводить к образованию цистиновых почечных камней).
2. Дистальные тубулопатии. Расстраиваются процессы реабсорбции Na+, К+, Mg2+, Са2+, воды.
Почечный водный диабет (наследственное заболевание), в основе развития которого лежит отсутствие реакции почек на АДГ, что ведет к нарушению реабсорбции воды в дистальных канальцах и собирательных трубочках (полиурия до 30 л/сутки). При этом содержание АДГ в крови нормально.
Псевдогипоальдостеронизм – снижение чувствительности клеток собирательных трубочек к альдостерону.
Почечный канальцевый ацидоз (метаболический ацидоз). Нарушение способности к реабсорбции бикарбоната и секреции ионов Н+ лежит в основе развития почечного канальцевого ацидоза (ПКА).
Существуют тубулопатии, характеризующиеся комбинированным дефектом процессов канальцевой реабсорбции. К их числу относится синдром де Тони-Дебре-Фанкони
(наследственные и приобретенные формы), проявляющийся нарушением реабсорбции глюкозы, различных аминокислот, фосфатов и бикарбонатов. Основные проявления синдрома: метаболический ацидоз, глюкозурия, рахитоподобные изменения в костях, остеопороз; при наследственной форме – задержка роста и развития.
Проявления почечной патологии (мочевой синдром)
Заболевания почек сопровождаются нарушениями образования и выделения мочи. Они могут выражаться в виде: изменения количества мочи, ритма мочеиспускания, относительной плотности и состава мочи (мочевой синдром).
1. Изменение количества выделяемой мочи (диуреза).
Полиурия (polys - много, uron - моча) — выделение за сутки более 2000 мл мочи независимо от объема выпитой жидкости. Причины: увеличение клубочковой фильтрации или уменьшение канальцевой реабсорбции.
Олигурия (olygos - малый) — выделение в течение суток менее 500 мл мочи. Обычно является следствием уменьшения фильтрации или увеличения реабсорбции.
Анурия (an - отсутствие) – характеризуется прекращением мочеотделения или выделением мочи в количестве менее 200 мл/сутки. По механизму развития различают анурию преренальную,
ренальную и постренальную.
Примером преренальной анурии является прекращение мочеотделения в результате рефлекторного торможения функции почек при сильных болевых ощущениях (механизм – спазм приносящих артериол почечных клубочков, стимуляция секреции АДГ).
Ренальная анурия возникает на определенной стадии острой почечной недостаточности в связи с резким снижением объема клубочковой фильтрации.
5
Постренальная анурия имеет место при наличии препятствия для оттока мочи на какомлибо уровне мочевого тракта (например, аденома простаты у мужчин), а также при параличе мочевого пузыря.
2. Изменение ритма мочеиспускания.
Превалирование ночного диуреза над дневным – никтурия (от nictos - ночь), тогда как у здорового человека объем дневного диуреза составляет 65-80% от общего объема суточной мочи. Причины: нарушение кровоснабжения почек, аденома простаты, поражения почек (амилоидоз) или мочевыводящих путей (уретрит, цистит).
Частота мочеиспускания может увеличиваться (поллакиурия, от греч. pollakis - часто) или снижаться (оллакизурия, от греч. ollakis - редко). Причины: полиурия или раздражение мочевыводящих путей (при воспалении, прохождении мелких конкрементов — «песка» и др.).
3.Изменения относительной плотности мочи. Относительная плотность мочи является показателем концентрационной способности почек (у здорового человека составляет от 1002 до 1035 в зависимости от количества поступившей в организм жидкости). В условиях патологии относительная плотность мочи может изменяться независимо от поступления в организм жидкости.
Гиперстенурия (hyper - много, sthenos - сила) — увеличение относительной плотности мочи выше нормы (более 1030). Как правило, является следствием увеличения реабсорбции.
Гипостенурия (hypo - мало) — снижение относительной плотности мочи (1002–1009). Возникает при нарушении концентрационной функции почек.
Изостенурия (isos - равный) — относительная плотность мочи очень мало колеблется в течение суток и соответствует плотности плазмы крови (1009-1012).
Гипо- и изостенурия свидетельствуют о нарушении концентрационной способности почек (например, при хронической почечной недостаточности, гипофункции надпочечников, недостаточной секреции АДГ).
4.Изменения состава мочи характеризуются появлением в ней белка (протеинурия), глюкозы (глюкозурия), аминокислот (аминоацидурия), крови (гематурия), лейкоцитов (лейкоцитурия), цилиндров (цилиндрурия), клеток эпителия почечных канальцев или мочевыводящих путей, кристаллов различных солей (кристаллурия), микроорганизмов (бактериурия).
Протеинурия. В норме проникновению белков плазмы крови в клубочковый фильтрат препятствуют гломерулярный фильтр (эндотелий, базальная мембрана, подоциты) и электростатический заряд этих структур, который отталкивает отрицательно заряженные молекулы белков.
У здорового человека в клубочках из плазмы крови фильтруется 0,5 г белка/сутки (преимущественно альбумина). Значительная часть поступившего в клубочковый фильтрат белка реабсорбируется в проксимальных канальцах посредством пиноцитоза. Некоторая часть поступающего в мочу белка образуется в эпителии петли Генле и дистальных канальцев – это уропротеин (белок Тамма-Хорсфалля).
Общее количество белка, выделяющегося с суточной мочой, в норме составляет около 50 мг и не обнаруживается обычными лабораторными методами. Выделение с мочой более 150 мг белка/сутки называется протеинурией.
По механизму развития различают клубочковую (связана с повышенной проницаемостью клубочкового фильтра) и канальцевую протеинурию (нарушение реабсорбции белка в проксимальном канальце).
Выделяют функциональную (может быть у здоровых людей) и патологическую протеинурию.
Функциональная протеинурия: ортостатическая, напряжения, лихорадочная, застойная и идиопатическая. Ортостатическая протеинурия возникает у некоторых людей при длительном стоянии или ходьбе; при смене положения тела на горизонтальное она исчезает. Протеинурия напряжения наблюдается у здоровых людей после тяжелой физической нагрузки. Лихорадочная
6
протеинурия возникает чаще у детей и стариков (при нормализации температуры тела исчезает). Застойная протеинурия наблюдается при застойной недостаточности кровообращения. Идиопатическая протеинурия обнаруживается иногда у здоровых людей при медицинском обследовании, имеет преходящий характер. Общей особенностью всех видов функциональной протеинурии являются ее небольшие размеры – обычно не более 1 г белка/сутки.
Патологическая протеинурия связана с различными заболеваниями. Она подразделяется на преренальную, ренальную и постренальную.
Преренальная протеинурия возникает при повышенном содержании в плазме крови низкомолекулярных белков (миоглобина, гемоглобина, лизоцима и др.). Эти белки легко проходят через клубочковый фильтр, но не полностью реабсорбируются канальцевым эпителием. Такой вид протеинурии развивается при миеломной болезни (белок Бенс-Джонса), рабдомиолизе, внутрисосудистом гемолизе и др. Размер преренальной протеинурии может достигать 20 г белка/сутки.
Ренальная протеинурия может быть связана с поражением как клубочков, так и канальцев. Она развивается при гломерулонефритах, пиелонефрите, амилоидозе, остром канальцевом некрозе, тубулопатиях и некоторых других заболеваниях. Выделение белка с мочой колеблется в пределах 1-3 г белка/сутки и выше.
Постренальная протеинурия регистрируется при заболеваниях мочевыводящих путей, она обусловлена поступлением в мочу экссудата.
Патологическая ренальная протеинурия подразделяется на селективную и неселективную протеинурию.
Селективная протеинурия – в моче появляются низкомолекулярные белки (мол. масса менее 70 кДа) – альбумины и трансферрин. Развитие селективной протеинурии связано с утратой клубочковым фильтром способности отталкивать отрицательно заряженные молекулы белка и, таким образом, препятствовать их прохождению в ультрафильтрат. Поскольку диаметр пор фильтра (70 нм) превышает размер молекул альбумина и трансферрина, то эти белки свободно проходят через незаряженный фильтр.
Неселективная протеинурия – в моче определяются высокомолекулярные и низкомолекулярные белки. Неселективная протеинурия возникает при утрате гломерулярным фильтром способности регулировать прохождение молекул белка в зависимости от их размера. В связи с этим в ультрафильтрат поступают не только альбумины и трансферрин, но и крупнодисперсные белки плазмы (например иммуноглобулины G1, а2-макроглобулин и β- липопротеины).
Виды протеинурии по количеству выделенного белка: минимальная (до 1,0 г белка
/сут), умеренная (1,0 – 3,0 г белка/сут), массивная (более 3,0 г белка/сут) протеинурия.
Гематурия (от греч. haima - кровь) – присутствие крови в моче. Различают микро- и макрогематурию.
Микрогематурия не изменяет цвета мочи, ее можно выявить только при микроскопии осадка или с помощью индикаторной полоски. Макрогематурия придает моче цвет мясных помоев.
Причины гематурии: заболевания почек (гломерулонефрит, тубулоинтерстициальный нефрит, поражение почек при системной красной волчанке, и др.); повреждения мочевыводящих путей (нефролитиаз, уролитиаз, травмы, опухоли и др.). Гематурия иногда может обнаруживаться при больших физических нагрузках.
В моче эритроциты могут быть неизменѐнные (содержащие гемоглобин) и изменѐнные (лишѐнные гемоглобина, «выщелоченные»). Появление в моче «выщелоченных» эритроцитов имеет диагностическое значение, т.к. они чаще всего имеют почечное происхождение и встречаются при гломерулонефритах и другой почечной патологии. Свежие неизменѐнные эритроциты характеры для повреждения слизистых оболочек мочевыводящих путей (мочекаменная болезнь, цистит, уретрит).
7
Цилиндрурия – появление в моче цилиндров – белковых «слепков» почечных канальцев,
вкоторых они формируются.
Взависимости от состава различают цилиндры гиалиновые, зернистые, эпителиальные, жировые, восковидные, гемоглобиновые, эритроцитарные и лейкоцитарные. Матрицей цилиндров являются белки.
Гиалиновые цилиндры состоят почти исключительно из уропротеина (белка ТаммаХорсфалля), иногда они обнаруживаются в моче здоровых людей. В состав других цилиндров также входят белки почечного или плазменного происхождения. Присутствие цилиндров, как правило, свидетельствует о заболевании почек (гломерулонефриты, острый некроз почек, амилоидоз, пиелонефрит и др.).
Лейкоцитурия – присутствие в моче лейкоцитов в количестве более 5 в поле зрения микроскопа. Выявляется при пиелонефрите, воспалительных процессах в мочевыводящих путях.
Глюкозурия и аминоацидурия наблюдаются как при заболеваниях почек (тубулопатиях), так и при заболеваниях других органов (сахарный диабет, заболевания печени).
Глюкозурия – выделение глюкозы с мочой зависит от еѐ концентрации в крови, от процессов фильтрации и реабсорбции глюкозы в нефроне. Внепочечная глюкозурия возникает при повышении уровня глюкозы в крови выше 10 ммоль/л (сахарный диабет).
Почечная глюкозурия возникает при нормальном уровне глюкозы в крови в случае нарушения процессов реабсорбции. Бывает врождѐнной и приобретенной (при хронических гломерулонефритах, нефротическом синдроме и др.).
К изменениям состава мочи, не связанным с заболеваниями почек, относятся билирубинурия, гемоглобинурия, кетонурия.
Нефритический синдром
Нефритический синдром — симптомокомплекс, обусловленный диффузным поражением почечной ткани воспалительного генеза с вовлечением в патологический процесс всех отделов нефронов, интерстициальной ткани и сосудов.
Одной из наиболее распространѐнных форм патологии этой категории являются гломерулонефриты.
Острый гломерулонефрит — заболевание, как правило, инфекционно-аллергического или иммуноаутоагрессивного генеза.
Хронический гломерулонефрит у 10–20% пациентов он является исходом острого гломерулонефрита, а у 80–90% — первично-хроническое заболевание.
Этиология. Причинами острого гломерулонефриты могут быть инфекционные и неинфекционные факторы.
Инфекционные агенты: стрептококки (чаще β-гемолитический стрептококк группы А), вирусы (например, гепатита, кори, краснухи), токсоплазмы.
Неинфекционные факторы: эндогенные (например, Аг опухолей; Аг, образующиеся в результате массированного повреждения тканей – например, при ожоговой болезни, синдроме длительного раздавливания тканей и т.п.); экзогенные (например, некоторые антибиотики, ненаркотические анальгетики, вакцины, сыворотка крови, алкоголь, органические растворители).
Патогенез. Основные звенья патогенеза постстрептококкового гломерулонефрита.
•Попадание в организм стрептококков обусловливает образование к ним АТ.
•Воздействие АТ на Аг стрептококков приводит к образованию иммунных комплексов, которые циркулируют в крови и оседают на базальной мембране клубочков.
•Кроме того, антистрептококковые АТ воздействуют на мембраны почечных телец (капсулы Шумлянского-Боумена), которые имеют сходные Аг со стрептококковыми, что приводит
кдополнительному образованию иммунных комплексов.
•Иммунные комплексы вызывают гибель клеток почек и развитие диффузного воспаления почечной ткани.
8
•повреждение структур нефрона сопровождается образованием аутоантигенов, что запускает реакции иммунной аутоагрессии (выработку нефротоксических аутоантител и лимфоцитов).
•Образующиеся иммунные комплексы на базальной мембране клубочков и сосудов микроциркуляторного русла почек потенцируют и расширяют масштаб повреждения почечной ткани, делая его диффузным (отсюда и название – диффузный гломерулонефрит).
Проявления. Классическая «триада» клинических проявлений острого диффузного гломерулонефрита: гематурия, артериальная гипертензия, отѐки на лице (под глазами).
Пиелонефрит — инфекционно-воспалительное заболевание почек с преимущественным поражением почечных лоханок и интерстиция почек.
Этиология. Причина: вирусы и микробы (в большинстве случаев — кишечная палочка, клебсиеллы, энтерококки, протеи)
Важным условием возникновения пиелонефрита является нарушение оттока мочи, вызванное сдавлением или обтурацией мочеточников, лоханок почек.
Патогенез. Возбудители достигают слизистой лоханок, чашечек и паренхимы почек гематогенным или лимфогенным («нисходящим») путем либо попадают из мочеиспускательного канала, мочевого пузыря, мочеточников («восходящий» путь инфекции).
Микроорганизмы, попавшие в почку, вызывают воспаление слизистых оболочек чашечек, лоханок и интерстиция почек. В результате инфицирования нередко формируются участки некроза слизистой оболочки и абсцессы почек. Эпителий канальцев может подвергнуться деструкции. Отторжение погибших клеток эпителия вызывает обтурацию просвета канальцев клеточным детритом. Указанные изменения сопровождаются нарушением процессов фильтрации, реабсорбции и секреции.
Острое течение процесса чревато развитием острой почечной недостаточности, хроническое — хронической почечной недостаточности, нефросклероза, артериальной гипертензии.
Нефротический синдром
Нефротический синдром – это симптомокомплекс, характеризующийся массивной протеинурией (более 3 г белка/сутки), гипо- и диспротеинемией, гиперлипидемией, гиперхолестеринемией, распространенными отеками и водянкой серозных полостей.
Причины.
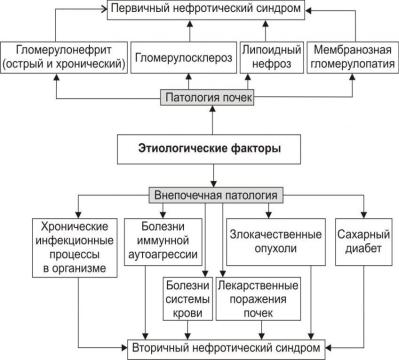
Первичный нефротический синдром обусловлен патологией почек: гломерулонефрит (острый и хронический), гломерулосклероз, липоидный нефроз, мембранозная гломерулопатия, лекарственные поражения почек.
Вторичный нефротический синдром развивается при внепочечной патологии: хроническая инфекция (туберкулѐз, сифилис, вирусные гепатиты и др.), болезни системы крови (лейкозы, лимфогранулематоз и др.), опухоли, болезни иммунной аутоагрессии (ревматоидный артрит, склеродермия, васкулиты и др.), сахарный диабет, интоксикации (золото, ртуть, висмут, НПВС, яды насекомых и змей), нефропатии беременных, тромбоз почечных сосудов и др.
Патогенез обусловлен повышением проницаемости базальной мембраны капилляров клубочков для белка. Это может быть связано с повреждающим действием иммунных комплексов, лизосомальных ферментов, активных форм кислорода (выделяемых нейтрофилами и моноцитами).
При любом механизме повреждения происходит повышенное поступление белков плазмы крови (преимущественно альбуминов) в клубочковый фильтрат, развивается резко выраженная протеинурия (более 3 г белка/сутки, в отдельных случаях - до 50 г белка/сутки). Следствием этого является гипопротеинемия (менее 60 г белка/л), главным образом за счет снижения содержания альбуминов.
9
Гипопротеинемия → вызывает снижение коллоидно-осмотического давления крови → усиленный выход жидкости из сосудов в межклеточное пространство → развитие гиповолемии
→ повышение активности РААС → усиление продукции альдостерона → снижение экскреции ионов Na+ с мочой, ↑ концентрации Na+ в крови → ↑ осмотического давления крови → стимуляция секреции АДГ → задержка воды в организме → развитие отека.
Стимуляция секреции АДГ под действием гипернатриемии сопровождается увеличением объема плазмы крови, происходит ее разжижение, гипопротеинемия и гипоонкия возрастают. Вследствие этого избыточная вода не задерживается в кровеносном русле, а перемещается в ткани, что способствует дальнейшему нарастанию отеков, т.е. возникает «порочный круг».
Гипопротеинемия сочетается с диспротеинемией, так как наряду с альбуминами нередко снижается содержание в крови γ-глобулинов, которые также могут поступать в мочу.
Рис. 1. Этиологические факторы нефротического синдрома.
Развивается гиперлипидемия за счет повышения содержания липопротеинов низкой и очень низкой плотности (ЛПОНП) при нормальном или пониженном уровне липопротеинов высокой плотности (ЛПВП). В плазме крови повышается содержание холестерина и
триацилглицеролов.
Развитие гиперлипидемии обусловлено двумя механизмами: повышение продукции липопротеинов в печени и нарушение катаболизма ЛПОНП. Предполагается, что пониженный катаболизм липопротеинов может быть обусловлен потерей с мочой некоторых субстанций
(например, липопротеиновой липазы).
При нефротическом синдроме многие транспортные белки теряются с мочой. В связи с этим в плазме крови понижен уровень ряда микроэлементов (Fe, Cu и Zn), метаболитов витамина D, тиреоидных и стероидных гормонов.
Опасность при нефротическом синдроме представляют тромбоэмболические осложнения. Гиперкоагуляции обусловлена повышением содержания прокоагулянтов – фибриногена и плазменных факторов V (проакцелерин) и VIII (антигемофильный глобулин А), снижением содержания антитромбина III, ослабление активности фибринолитической системы (снижения содержания плазминогена, повышение активности а2-антиплазмина).
10
