

Министерство здравоохранения Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
«Саратовский государственный медицинский университет имени В.И. Разумовского» Министерства здравоохранения Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава России)
Элементы химической термодинамики
и кинетики химических реакций
учебно – методическое пособие для студентов 1 курса медицинского университета
Саратов
2013
1
УДК 542.9: 544.3: 544.4 (075.8)
ББК 24.2 + 24.53/54 я 73
Автор. знак К903
Учебно-методическое пособие адресовано студентам, обучающимся на I курсе Саратовского государственного медицинского университета по специальностям: лечебное дело, педиатрия, медико-профилактическое дело, стоматология.
Форма изложения материала адаптирована к рабочим программам соответствующих специальностей. По каждой теме представлены цель изучения, план подготовки, теоретический материал, вопросы для самоконтроля, тренировочные тесты и ситуационные задачи. Это позволяет студентам планомерно готовиться к лабораторно-практическим занятиям, переходя от теории к практическому применению полученных знаний.
Авторы - составители: Л.Н. Куликова, кандидат химических наук, старший преподаватель кафедры общей и биоорганической химии СГМУ; С.Б. Орлов, проф. РАЕ, старший преподаватель кафедры общей и биоорганической химии СГМУ; П.В. Решетов, доктор химических наук, заведующий кафедрой общей и биоорганической химии СГМУ; Р.Т. Куцемако, кандидат биологических наук, доцент кафедры общей и биоорганической химии СГМУ; М.И. Скуратова, кандидат химических наук, старший преподаватель кафедры общей и биоорганической химии СГМУ.
© Саратовский государственный медицинский университет, 2013.
© Л.Н. Куликова, С.Б. Орлов, П.В. Решетов, Р.Т. Куцемако, М.И. Скуратова.
2
Тема занятия : ЭЛЕМЕНТЫ ТЕРМОДИНАМИКИ
Цель занятия:
формирование представлений о физико-химических аспектах как о важнейших биохимических процессах в организме.
Исходные знания студентов:
Понятие о тепловом эффекте химической реакции из школьного курса химии.
Экзотермические и эндотермические реакции.
Студент должен знать: Первое начало термодинамики. Понятия: энтальпия,
энтропия. Закон Гесса. Применение первого начала термодинамики к биосистемам. Второе начало термодинамики. Энергия Гиббса.
Студент должен уметь: рассчитывать стандартную энтальпию химической реакции по стандартным энтальпиям образования и сгорания химических соединений, по закону Гесса, энтропию химической реакции, энергию Гиббса.
3
План подготовки к занятию:
1)Ознакомиться с вопросами для подготовки к занятию
2)Осмыслить краткий теоретический материал и лекцию по рассматриваемой теме.
3)Если определѐнные участки теории трудны для понимания, то необходимо обратиться к следующим учебникам:
№п/п |
Авторы |
Название |
Страницы |
|
|
|
|
|
|
|
Ершов Ю.А., |
Общая химия. Биофизическая химия. |
|
|
|
Попков А.С., |
|
||
1 |
Химия биогенных элементов.- М.: |
10-31 |
||
Берлянд А.С., |
||||
|
Высш. шк.-2000.-560 с. |
|
||
|
Книжник А.З. |
|
||
|
|
|
||
|
|
|
|
|
|
Глинка Н.Л. Под |
|
|
|
2 |
редакцией |
Общая химия. - М.: Юрайт.-2011.-886 |
221-247 |
|
Попкова В.А., |
с. |
|||
|
|
|||
|
Бабкова А.В. |
|
|
|
|
|
|
|
|
3 |
Глинка Н.Л. |
Общая химия. - Л.: Химия.-1978.-720 |
166-204 |
|
с. |
||||
|
|
|
||
|
|
|
|
|
|
Равич-Щербо |
Физическая и коллоидная химия.-М.: |
|
|
4 |
М.И., Новиков |
10-20 |
||
Высш. шк.-1975.-255 с. |
||||
|
В.В. |
|
||
|
|
|
||
|
|
|
|
|
|
|
Введение в бионеорганическую и |
|
|
5 |
Ленский А.С. |
биофизическую химию.- М.: Высш. |
6-54 |
|
|
|
шк.-1989.-256 с. |
|
|
|
|
|
|
4)Ответить на вопросы для самоконтроля.
5)Выполнить тренировочный тест и проверить правильность выполнения.
6)Решить ситуационную задачу.
4
Вопросы для подготовки к занятию
1)Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики.
2)Основные понятия термодинамики. Интенсивные и экстенсивные
параметры. Функция состояния. Внутренняя энергия. Работа и теплота -
две формы передачи энергии.
3)Типы термодинамических систем (изолированные, закрытые,
открытые).
4)Типы термодинамических процессов (изотермические, изобарные,
изохорные).
5)Первое начало термодинамики.
6)Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
7)Закон Гесса.
8)Применение первого начала термодинамики к биосистемам.
9)Второе начало термодинамики. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия.
10)Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов. Термодинамические условия равновесия.
11)Стандартная энергия Гиббса реакции.
12)Понятие экзергонических и эндергонических процессов, протекающих в организме.
5
Краткий теоретический материал
Уже в конце 18 века было известно, что жизнедеятельность человека – это взаимосвязанные процессы химических превращений (окисление продуктов питания и т.д.) и энергетического обмена в организме (А. Лавуазье, П. Лаплас).
Химическая термодинамика – это раздел физической химии, изучающий явления передачи и превращения энергии при протекании химической реакции.
Термодинамика основана на ряде понятий: система, состояние системы, параметры состояния системы, функции состояния системы, внутренняя энергия системы и т. д.
Термодинамическая система – это любой материальный объект, отделѐнный от окружающей среды реальной или воображаемой поверхностью раздела, выбранный для рассмотрения.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией.
Примером открытой системы является живая клетка.
Состояние системы – это набор свойств системы, позволяющих описать систему с точки зрения термодинамики.
Например, для оценки состояния человеческого организма, как термодинамической системы, врач должен оценить некоторые его характеристики (температура, давление, концентрация биологических жидкостей).
Физические свойства, характеризующие состояние системы, называют
параметрами состояния системы.
6
Взаимодействие системы с окружающей средой заметно по изменению параметров системы.
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем
(объѐм, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура,
давление, концентрация, плотность, поверхностное натяжение).
Параметры состояния связаны уравнением состояния.
Переход системы из одного состояния в другое с изменением хотя бы одного параметра называется термодинамическим процессом.
Если процесс идет при постоянном давлении, он называется изобарным
процессом. При постоянном объѐме - изохорным, при постоянной температуре
- изотермическим.
Функция состояния - это характеристика системы, которая не поддается прямому измерению, а рассчитывается через параметры состояния. Значение функции состояния не зависит от способа его достижения, а только от начального и конечного состояния системы.
Внутренняя энергия является одной из таких функций.
Внутренняя энергия - сумма всех видов энергий движения и взаимодействия частиц, составляющих систему.
U[ Дж ]
ВXIX веке немецкий судовой врач Майер Ю.Р. и английский ученый Джоуль Д. показали, что теплота и работа пригодны к взаимопревращениям,
являясь разными способами передачи энергии.
7
Теплота - форма передачи энергии путем хаотического движения микрочастиц.
Q [ Дж ]
Работа – упорядоченная форма передачи, связанная с преодолением внешнего сопротивления.
A [ Дж ]
Наблюдая за людьми в разных климатических зонах, Майер сделал вывод, что теплота сгорания пищи используется на поддержание постоянной температуры тела и на выполнение мускульной работы. Это наблюдение легло в основу 1 закона термодинамики.
Первый закон термодинамики (первое начало термодинамики):
в любом процессе приращение внутренней энергии системы равно теплоте, полученной системой, минус работа, совершенная системой (или плюс работа,
совершенная над системой).
∆U=Q-A
∆U - внутренняя энергия Q - теплота
A - работа
Теплота, полученная системой, и работа, совершенная системой, считаются положительными. Теплота, отданная системой, и работа, совершенная над системой со стороны окружающей среды, считаются отрицательными. Т.о., при подстановке числовых значений, 1 закон термодинамики может быть записан как через «-», так и через «+».
На основе 1 закона термодинамики, являющегося фундаментальным законом природы, простыми расчетами получают ценные сведения о процессах обмена веществ и энергии в организме.
8
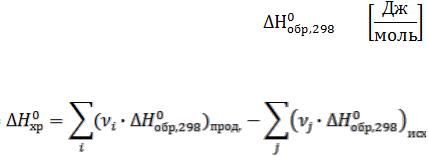
Термохимия – это раздел термодинамики, изучающий теплоты протекания химических реакций.
Закон Гесса: теплота химической реакции, протекающей при постоянном давлении или объѐме, не зависит от пути процесса, а только от начального и конечного состояний системы.
Если из одних веществ можно получить другие разными путями, то суммарный тепловой эффект по первому пути равен суммарному тепловому эффекту по второму пути. Закон Гесса позволяет на практике рассчитывать тепловые эффекты реакций, которые сложно отслеживать или на это требуется длительное время. Например, суммарная теплота биологического окисления продуктов питания в организме, равна теплоте их прямого сгорания.
Энтальпия – это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении.
H [ Дж/моль ]
Способы расчета стандартной энтальпии химической реакции
1)По стандартным энтальпиям (теплотам) образования веществ
Стандартная теплота образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=298 К, Р=1 атм=101325 Па.
Теплоты образования простых веществ равны нулю.
9
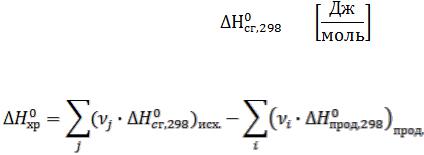
νi, νj – стехиометрические коэффициенты перед соответствующими веществами
вуравнении реакции.
2)По стандартным энтальпиям (теплотам) сгорания веществ
Стандартная теплота сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
Теплоты сгорания высших оксидов (в том числе СО2 и Н2О) приняты равными нулю.
Второй закон термодинамики устанавливает возможность, направление и
глубину протекания самопроизвольного процесса.
Самопроизвольный процесс - процесс, протекающий без каких-либо воздействий извне, и приближающий систему к состоянию
равновесия.
Термодинамически обратимый процесс– процесс, протекающий в прямом и в обратном направлении без изменений в системе и в окружающей среде, т.е. при переходе из начального состояния в конечное все промежуточные состояния являются равновесными.
При наличии неравновесных промежуточных состояний процесс считают
термодинамически необратимым.
В природе устойчивы системы, обладающие минимальной энергией.
Тогда самопроизвольными должны быть лишь экзотермические процессы. Но это не так. Значит, имеется другой критерий самопроизвольного протекания процесса – энтропия (S).
10
