
а) реакции, которые сложно понять;
б) реакции, протекающие в несколько стадий;
в) реакции, протекающие в одну стадию;
г) реакции, которые идут с малой скоростью.
3.Схема, описывающая метаболизм лекарства в организме в фармакокинетике.
а) моча→желудок→кровь б) кровь→желудок→моча в) желудок→кровь→моча г) желудок→ моча
4.Что такое субстрат?
а) это продукт реакции;
б) это вещество, образующееся в промежуточных стадиях;
в) это вещество, вступающее в реакцию;
г) это вещество, вступающее в реакцию только при наличии химической индукции.
5.Что такое параллельные реакции? Схема их записи.
а) это сложные реакции, в которых продукт первой стадии вступает в реакцию второй стадии и т.д. до образования конечного продукта. А→В→С
б) это сложные реакции, которые протекают в прямом и обратном направлении с соизмеримыми скоростями 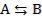 в) это реакции, одна из которых вызывает протекание другой реакции, не осуществляемой в отсутствие первой
в) это реакции, одна из которых вызывает протекание другой реакции, не осуществляемой в отсутствие первой
г) это сложные реакции, в которых одно и то же вещество участвует в нескольких одновременно протекающих реакциях 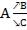 .
.
Ответы 1а, 2б, 3в, 4в, 5г
41
Ситуационные задачи
Задачи на правило Вант-Гоффа
kT |
T2 T1 |
|
|
|
|
2 |
10 |
|
kT1
Задача №1.
С помощью правила Вант-Гоффа вычислить при какой температуре реакция закончится через 15 минут, если при температуре 293 К реакция идѐт в течение 2 часов. Температурный коэффициент Вант-Гоффа реакции равен 3. Константа скорости обратно пропорциональна времени.
Ответ: 312 К.
Задача №2.
Температурный коэффициент реакции равен 3,5. Константа скорости kI при температуре ТI=15°С равна 0,2 с-1. Найти kII при температуре TII=40°С.
Ответ: 0,009 с-1.
Задачи на уравнение Аррениуса
ln |
k2 |
|
Ea |
|
T2 T1 |
. |
|
ln k |
2 |
ln k |
Ea |
|
T2 |
T1 |
|||
|
|
|
|
|
|
|
|
|
|
||||||||
|
k1 |
|
R T2 T1 |
|
|
|
1 |
R T2 |
T1 |
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
R T1 |
T2 ln |
k2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
Ea |
k1 |
. |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
T2 |
T1 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Задача №3.
Скорость бактериального гидролиза мышц рыб удваивается при переходе от Т1= -1,1°С до Т2= 2,2°С. Рассчитать энергию активации этой реакции.
Ответ: 130,6 кДж.
Задача №4.
42
Константа скорости гидролиза новокаина при Т=313 К равна 6,6∙10-7 с-1.
Энергия активации этой реакции 55,2 кДж/моль. Сколько процентов новокаина разложится при Т=293 К за 10 дней?
Ответ: 12,5%.
Задача №5.
Срок годности лекарственного препарата при 40°С составляет 1 год. Определить срок годности при температуре 20°С, если предположить, что разложение является реакцией первого порядка, а температурный коэффициент Вант-Гоффа равен 2.
Ответ: 4 года.
Задача №6.
Для определения срока годности порошка папаверина гидрохлорида проведено исследование по методике «ускоренного старения» при температурах 50 и 80°С. Рассчитаны следующие константы: k50=0,52∙10-3сут-1 k80=1∙10-3сут -1.
Определите срок годности порошка при температуре 20°С. Ответ: 342,8 суток.
Задачи для решения на занятии.
1)Константа скорости гидролиза новокаина при 313 К равна 0,66 мин-1, энергия активации реакции равна 55,2 кДж/моль. Какая массовая доля (%) новокаина разложится за 10 дней хранения при 193К?
2)Появление изотопа йода  имеет место при авариях на АЭС. Период его полураспада 8 суток. За какое время этот изотоп распадается на 99% ?
имеет место при авариях на АЭС. Период его полураспада 8 суток. За какое время этот изотоп распадается на 99% ?
43
3)Во сколько раз увеличится скорость реакции взаимодействия водорода и кислорода 2H2 + O2 = 2H2O, если концентрации исходных веществ увеличить в два раза?
4)Константа скорости химической реакции при 200С равна 1 моль/(л∙сек).
Вычислите константу скорости при 600С, если температурный коэффициент
реакции равен 3. По размерности Константы скорости определить порядок
реакции.
5)Константа скорости распада радиоактивного вещества составляет 0, 00507 (день)−1. Определите по размерности константы скорости, порядок химической реакции и, воспользовавшись соответствующим кинетическим уравнением, определите время (в днях), в течение которого вещество расходуется на 90%.
6)Во сколько раз увеличится скорость реакции при увеличении температуры на
250С, если γ = 3?
7)Вычислите по правилу Вант-Гоффа, во сколько раз увеличится скорость химической реакции при увеличении температуры на 200С, если γ = 2,8.
8)Константа скорости реакции при 300К равна 0,02, а при 350К равна 0,6.
Определите энергию активации этой реакции?
44
9) Для реакции:
C5H5N + CH3I → [C5H5NCH3] I
При 315К k = 0,035 (моль /л)−1 мин−1
При 323К k = 0,059 (моль /л)−1 мин−1
Вычислите энергию активации?
10) Константа скорости необратимой реакции 1-го порядка равна k = 2,06 ∙10−3
мин−1. Определите, сколько % исходного вещества разложится за 25 минут?
11) Для реакции разложения N2 O5 при разных температурах получены следующие данные:
T0C |
45 |
65 |
kI, с-1 |
4, 98 ∙10-4 |
4,87 ∙ 10-3 |
Рассчитайте величину kI при t = 500С.
12) Константа скорости реакции |
|
|
При t1 = 9,40с |
k1 |
= 2,37; |
При t2 = 14,40С |
k2 |
= 3,204. |
Рассчитайте температурный коэффициент скорости реакции.
13) Для необратимой реакции 2-го порядка:
CH3COOC2H5 + CH3COONa + C2H5OH
KII = 5,4 (моль/л)-1 * мин-1. Исходные концентрации эфира и щелочи одинаковы и равны 0,02 моль/л. Какова будет концентрация исходных веществ через 10 минут после начала опыта?
45
14)При хранении таблеток амидопирина было установлено, что при 80°С и
90°С константы скорости разложения соответственно равны 1,61∙10-6с-1,
4,2∙10-6с-1. Определите срок хранения таблеток (время разложения 10-ти %
вещества) при 20°С.
15)Константа скорости химической реакции при 200С равна 1 моль/л∙сек.
Вычислите константу скорости при 600С, если температурный коэффициент реакции равен 3. По размерности Константы скорости определить порядок реакции.
16)Для определения срока годности порошка папаверина гидрохлорида проведено исследование по методике «ускоренного старения» при температурах 50 и 80°С. Рассчитаны следующие константы: k50°С=5,2∙10-4
сут -1, k80°С. =1,0∙10-3 сут -1. Определите срок годности порошка при температуре 23°С.
17)Для реакции разложения N2O5 при разных температурах получены следующие данные:
T0C |
45 |
65 |
kI, с-1 |
4, 98 ∙10-4 |
4,87 ∙ 10-3 |
Рассчитайте величину kI при t = 500С.
18) Константа скорости реакции при 300К равна 0,02, а при 350К равна 0,6.
Определите энергию активации этой реакции?
46
19)Вычислите по правилу Вант-Гоффа, во сколько раз увеличится скорость химической реакции при увеличении температуры на 200С, если γ = 2,8.
20)Для реакции:
C5H5N + CH3I → [C5H5NCH3] I
При 315К k = 0,035 (моль /л)−1 мин−1
При 323К k = 0,059 (моль /л)−1 мин−1
Вычислите энергию активации?
21) Константа скорости реакции |
|
при t1 = 9,40С |
k1 = 2,37; |
при t2 = 14,40С |
k2 = 3,204. |
Рассчитайте температурный коэффициент скорости реакции.
22) При температуре 0°С гранула железа растворяется в соляной кислоте за 20
минут. Если температурный коэффициент γ = 2, то такой же кусочек железа растворится при t=20°С за ______минут.
47
Тема занятия: ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цель занятия:
формирование у студентов представлений о факторах, влияющих на смещение равновесия биохимических процессов.
Исходные знания студентов:
Закон действующих масс. Принцип Ле-Шателье.
Студент должен знать: понятие «химическое равновесие». Термодинамические условия химического равновесия в изолированных и закрытых системах.
Константа химического равновесия. Уравнения изотермы и изобары химических реакций.
Студент должен уметь: прогнозировать результаты физико-химических процессов, протекающих в живых системах, опираясь на теоретически положения, в зависимости от изменения температуры и давления (расчеты по уравнениям изотермы и изобары химической реакции).
План подготовки к занятию:
1)Ознакомиться с вопросами для подготовки к занятию.
2)Осмыслить краткий теоретический материал и текст соответствующей лекции.
3)Если определѐнные участки лекции трудны для понимания, то необходимо обратиться к следующим учебникам:
48
№п/п |
Авторы |
Название |
Страницы |
|
|
|
|
|
|
|
Ершов Ю.А., |
Общая химия. Биофизическая химия. |
|
|
|
Попков А.С., |
|
||
1 |
Химия биогенных элементов.- М.: |
32-41 |
||
Берлянд А.С., |
||||
|
Высш. шк.-2000.-560 с. |
|
||
|
Книжник А.З. |
|
||
|
|
|
||
|
|
|
|
|
|
Глинка Н.Л. Под |
|
|
|
2 |
редакцией |
Общая химия. - М.: Юрайт.-2011.-886 |
247-264 |
|
Попкова В.А., |
с. |
|||
|
|
|||
|
Бабкова А.В. |
|
|
|
|
|
|
|
|
3 |
Глинка Н.Л. |
Общая химия. - Л.: Химия.-1978.-720 |
184-201 |
|
с. |
||||
|
|
|
||
|
|
|
|
|
|
Равич-Щербо |
Физическая и коллоидная химия.-М.: |
|
|
4 |
М.И., Новиков |
17-19 |
||
Высш. шк.-1975.-255 с. |
||||
|
В.В. |
|
||
|
|
|
||
|
|
|
|
|
|
|
Введение в бионеорганическую и |
|
|
5 |
Ленский А.С. |
биофизическую химию.- М.: Высш. |
80-92 |
|
|
|
шк.-1989.-256 с. |
|
|
|
|
|
|
4)Ответить на вопросы для самоконтроля.
5)Выполнить тренировочный тест и проверить правильность выполнения по ключу.
6)Решить ситуационную задачу.
Вопросы для подготовки к занятию
1)Химическое равновесие.
2)Обратимые и необратимые по направлению реакции.
3)Термодинамические условия равновесия в изолированных и закрытых системах.
4)Константа химического равновесия.
Уравнения |
изотермы |
и |
изобары |
химической |
реакции. |
49
Краткий теоретический материал
Химическое равновесие – это такое состояние системы, при котором скорости прямой и обратной реакций равны между собой.
В равновесии изменения изобарно-изотермического потенциала (∆G) и изохорноизотермического потенциала (∆F) равны нулю.
∆G=0 |
∆F=0 |
Закон действующих масс:
скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов.
aA + bB ↔ сС + dD
wпрям = СAa ∙СBb wобрат = СDd ∙СCc
Для химического равновесия скорости прямой и обратной реакций равны. Отношение скоростей реакции прямой и обратной реакций даѐт уравнение для константы скорости, выраженное через равновесные концентрации реагирующих веществ
КС = (СDd ∙СCc) /( СAa ∙СBb)
а, b, c, d - стехиометрические коэффициенты
Константа равновесия может быть выражена не только через парциальные давления газообразных участников реакции, но и через молярные концентрации и мольные доли исходных веществ и продуктов реакции.
КР= КС (RT)∆n = Кχ (Pобщ) ∆n
КС – константа равновесия, выраженная через концентрации участников реакции
R- газовая постоянная, R=8,314 Дж/(моль К)
∆n-разность количеств вещества конечных и исходных газообразных участников реакции
Кχ– константа равновесия, выраженная через мольные доли участников реакции
Робщ – общее давление.
50
