

2-й способ (правило смешения или правило «креста»)
|
|
10 % |
∕∕ |
4 |
доли всего 10 долей. |
||
|
|
\ |
4% |
+ |
|||
|
|
0 % ∕∕ |
|
\ 6 |
долей |
||
|
|
|
|
|
Решение: |
|
|
1. Рассчитаем массу одной доли раствора: |
|
||||||
m |
mp 2 |
|
800 |
80г. |
|
|
|
общаясуммадолей |
|
10 |
|
|
|
||
|
|
|
|
|
|||
2.Определяем массу 10 % - ного раствора:
mp |
80 4 320 г . |
1 |
|
3.Рассчитываем объѐм раствора:
mp |
320 |
290мл ; |
||
Vp |
|
|
|
|
1 |
|
|
|
|
1 |
1,1 |
|
|
|
|
|
|
|
|
4. Рассчитываем необходимый объѐм воды:
V H2O 80
80  6 480 г мл .
6 480 г мл .
Ответ: Чтобы приготовить 800 г 4 % - го раствора новокаина, из 10 %-го раствора, необходимо отмерить 290 мл 10 % - го раствора новокаина и 480 мл воды и весь раствор смешать в подходящем сосуде.
Решение задач на приготовление растворов с молярной и нормальной
концентрацией.
Растворы М и Н концентрации готовятся в мерных колбах.
Задача 4. Приготовьте 250 мл 0,5 М раствора CuSO4 из безводного CuSO4
Дано: |
|
Решение: |
|
Cм(CuSO4) = 0,5 М |
|
См=n(CuSO4)/V |
|
V (CuSO4) = 0,25 л |
Находим количество молей раствора CuSO4 по |
||
Найти: |
формуле |
n(CuSO4)=См∙V, |
тогда |
m (CuSO4)=? |
n(CuSO4)=0,5моль/л∙0,25л=0,125моль. |
|
|
|
М(CuSO4)=160 г/моль |
|
|
|
30 |
|
|
Согласно формуле n=m/M, находим массу
CuSO4
m (CuSO4)= n∙ M=0,125 моль ∙160 г/моль=20 г
Ответ: Для того, что бы приготовить 250 мл CuSO4 из безводного, нужно взвесить на аналитических весах 20 г CuSO4, перенести в мерную колбу объемом 250 мл и довести объем водой до метки.
Задача 5. Как приготовить 25 мл 0,1М раствора ZnSO4 |
из 5М раствора |
|||||
ZnSO4? |
|
|
|
|
||
Дано: |
|
|
|
|
||
V2 = 25 мл |
|
|
|
|
||
M2 = 0,1 моль/л |
|
|
|
|
||
M1 |
= 5 моль/ |
л |
|
|
|
|
Найти V1 =? |
|
|
|
|
||
|
|
|
Решение: |
|
|
|
Из следствия из закона эквивалентов |
следует, что |
при |
разведении |
|||
растворов изменения |
объемов обратно |
пропорционально |
изменению |
|||
концентраций и V1∙М1 = V2∙М2 , где V1∙М1-количество вещества в исходном |
||||||
растворе, а V2∙М2 – после разбавления. |
|
|
|
|||
Определяем объем исходного раствора: |
|
|
|
|||
V1∙5 М = 25 мл∙0,1 М отсюда V1 = 0,5 мл. |
|
|
|
|||
Ответ: Для приготовления 25 мл 0,1М раствора ZnSO4 из 5М |
необходимо |
|||||
отмерить в мерную колбу на 25 мл из бюретки 0,5мл 5М раствора ZnSO4 и
довести объем водой до метки колбы.
Примечание: бесцветные растворы отмечают по нижнему мениску, а
окрашенные по верхнему.
Задача 6. Как приготовить 200мл 0,2н раствора CuSO4 из СuSO4∙5H2O?
Дано:
Vраствора (CuSO4) = 200мл
СN раствора (CuSO4)= 0,2 мол экв./л.
31

Найти m СuSO4∙5H2O.
Решение:
1) Определяем количество моль эквивалентов СuSO4∙5H2O. В
растворе.
СN= ;
;
nэкв = CN ∙ V =0,2х0,2 =0,04 моль
2).Находим Мэкв (СuSO4∙5H2O); М СuSO4∙5H2O =250г/моль Мэкв (СuSO4∙5H2O) = М СuSO4∙5H2O/ 1∙2 =250г/моль/2 = 125г/моль
3). Находим массу СuSO4∙5H2O, необходимую для приготовления
раствора.
m (СuSO4∙5H2O.)= n∙ Mэкв =0,04∙125 = 5г.
Ответ:
Для приготовления 200 мл 0,2N раствора CuSO4 необходимо взвесить на аналитических весах 5 г СuSO4∙5H2O , перенести навеску в мерную колбу на
200 мл и довести объем водой до метки.
Задача 7. Приготовьте 50 мл 0,025 N раствора NaOH разбавлением 1 N
раствора NaOH. |
|
Дано: |
Решение |
(NaOH)=1 N |
Определяем объем исходного 1N раствора |
(NaOH)=0,025 N |
NaOH по формуле |
|
|
V2(NaOH)=50 мл |
|
Найти: |
тогда |
|
|
V1(NaOH)= ? |
= 1,3 мл. |
|
Ответ: Для того, что бы приготовить 50 мл 0,025N раствор NaOH из 1N,
нужно с помощью пипетки отобрать 1,3 мл 1N раствора NaOH, перенести в мерную колбу объемом 50 мл и довести до метки водой.
32

Задача 8. Определите эквивалентную концентрацию раствора сульфата
алюминия (нормальность раствора), если 250 мл раствора содержит 27,36 г
соли.
Решение:
1.Определим массу соли, содержащейся в 1 литре раствора сульфата алюминия
Al2(SO4)3 = 27,36 ∙ 4 = 109,44 г.
2.Находим Mэкв Al2(SO4)3
Mэкв Al2(SO4)3 = 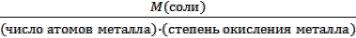
Mэкв Al2(SO4)3 |
342 |
57 г/ моль - экв; |
||
|
|
|||
2 3 |
||||
|
|
|||
3. Определяем число моль-экв., содержащихся в 109,44 г Al2(SO4)3 :
nэ |
|
m |
|
109 .44г |
1.92 моль - экв; |
||||
|
|
|
|
|
|
|
|||
M экв( Al2 (SO 4 )3 |
57 г / моль экв |
||||||||
|
|
||||||||
4.Находим Сн раствора ( Al2(SO4)3) |
|
|
|||||||
Сн= |
; Сн |
1.92 моль - экв |
1.92 моль - экв/л; |
||||||
|
|
|
|
|
|||||
|
1 л |
|
|
||||||
|
|
|
|
|
|
|
|||
Ответ: концентрация раствора ( Al2(SO4)3 равна 1,92н.
Задача 9. Вычислите массу глюкозы, необходимую для приготовления 0,2
моляльного раствора, содержащего 300 г воды.
Решение
Молярная масса глюкозы составляет 180 г/моль. Следовательно, растворив 180 г глюкозы в 1000 г воды, мы получили бы одномолярный раствор. Для приготовления 0,2 моляльного раствора, содержащего 300 г воды потребуется взять глюкозы:
m (глюкозы) =  = 10,8 г глюкозы
= 10,8 г глюкозы
или можно составить пропорцию и решить еѐ:
на 1000 г воды в 0,2 молярном растворе приходится (0,2∙ 180) г глюкозы, на 300 г воды в 0,2 молярном растворе приходится (х) г глюкозы
Х = m(глюкозы) = 10,8 г.
Ответ: Для приготовления 0,2 моляльного раствора необходимо 10,8г
глюкозы растворить в 300 мл воды.
33

Задача 10. Рассчитайте мольную долю йода в растворе, содержащем 20 г
йода в 500 г ССl4.
Решение
1. Определим число молей каждого компонента:
Na = |
= 0,079 моль; |
Nb = |
= 3,25 моль |
2. Находим мольную долю йода в растворе: |
|
||
N(I2) = |
= |
0,024 |
|
Мольная доля ССl4 равна : 1-0,024 = 0,976.
Ответ: Мольная доля йода в растворе равна 0,024.
34
5. ТИТРИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Методы аналитической химии широко реализуются в фармацевтической
промышленности при получении и контроле лекарственных препаратов, в
санитарно-гигиенической практике для анализа объектов окружающей среды.
Необходимо так же постоянно анализировать продукты пищевого производства, особенно на присутствие ядохимикатов, тяжелых металлов,
канцерогенных веществ.
Огромное значение имеет химический анализ для наук биологического цикла. Например, выяснение природы белка - задача, в сущности,
аналитическая, поскольку требуется выяснить, какие аминокислоты входят в состав белка и в какой последовательности они связаны. В медицине методы аналитической химии широко применяют для определения кислотности желудочного сока, содержание мочевой кислоты, аммиака в моче, сахара в
крови и т.д.
Измерение количества (концентрации или массы) составных частей
анализируемого объекта или |
их количественных соотношенийизучает |
соответствующий раздел аналитической химии - количественный анализ. |
|
В основе количественного |
анализа лежит точное измерение величины |
интенсивности аналитического сигнала, исходящего от объекта при
определенном воздействии на него. В простейшем случае аналитическим сигналом может быть интенсивность окраски, изменение рН раствора.
Задачей современной аналитической химии является разработка новых,
более чувствительных, точных, быстрых и специфичных метода анализа.
А так же совершенствование существующих методов. конструирование новых приборов, синтез новых реактивов, автоматизация и компьютеризация
методов анализа.
Очень важно для количественного анализа понятие «точность», она имеет
собирательный характер и характеризует суммарную погрешность
определения, включающую случайную погрешность (воспроизводимость) и
систематическую (правильность).
35
Результаты анализа называются точными, если они хорошо воспроизводимы и не имеют существенной систематической погрешности.
Сравнение возможностей различных методов анализа показывает, что точность аналитических определений является одним из самых мало изменившихся за последние 50 лет параметров. Так, наименьшую относительную погрешность на уровне 0,001% имеет кулонометрический анализ, далее в этом ряду стоит гравиметрия (0,01%), титриметрия (0,1%), а
затем все физические методы, погрешность определений в которых может доходить до нескольких процентов. Уменьшения случайной погрешности,
обусловленной сходимостью результата определения, добиваются обычно применением компьютеров, позволяющих измерять сигнал сотни и тысячи раз и затем проводить его статистическую обработку.
Одним из наиболее распространенных и доступных методов аналитической химии является титриметрический, предложенный в 1880 году Гей-Люссаком.
Титрование – процесс непрерывного добавления одного раствора (точно известной концентрации небольшими порциями (каплями) к другому
(концентрацию которого необходимо установить) до достижения точки эквивалентности (т.э.). Момент, при котором к титруемому компоненту добавлено эквивалентное количество титранта (раствора с известной концентрацией вещества), отвечающий стехиометрическому уравнению взаимодействия, называется точкой эквивалентности.
В точке эквивалентности количества реагирующих веществ равны:
nЭ1 = nЭ2
Титриметрические методы анализа служат для определения основных компонентов и примесей. Титрование применяют в анализе органических и неорганических соединений, а так же биологических жидкостей. В основе титриметрического метода лежит химическая реакция.
36

В процессе титрования обычно добавляют вещество, количество которого можно точно измерить, т.е. концентрация которого точно известна. Такой раствор называется стандартным раствором.
При титровании после добавления каждой порции титранта изменяются равновесные концентрации всех компонентов реакции.
Концентрация определяемого вещества уменьшается, а продуктов реакции увеличивается.
За этими изменениями наблюдают.
В конце титрования измеряют количество добавленного вещества. Обычно измеряют объем или другую характеристику (масса, электропроводность,
потенциал, оптическую плотность).
Зная количество добавленного компонента, рассчитывают количество определяемого вещества по закону эквивалентов.
Математическое выражение этого закона:
Следствие закона: Объемы реагирующих растворов обратно пропорциональны их нормальным и молярным концентрациям:
V1N1= V2N2
Основная формула для расчета в титриметрическом анализе.
Таким образом, независимо от типа реакций, используемых в титровании,
необходимо знание точных объемов растворов реагирующих веществ и точно известной концентрации одного из них.
Способы фиксирования точки эквивалентности
В химических методах анализа различают:
1. Безиндикаторный. Один из растворов выступает в роли индикатора,
например, в перманганатометрии, рабочий раствор - перманганат калия имеет интенсивную малиновую окраску.
2. Индикаторный, который предполагает использование интенсивно окрашенных индикаторов.
37
В инструментальных или физико-химических методах анализа точку эквивалентности определяют по изменению показания прибора
(потенциометрическое, кулонометрическое, кондуктометрическое титрование)
в ходе титрования. Физико-химические методы анализа используют для определения значительно меньших концентраций определяемы компонентов в исследуемых объектах.
Индикаторы в кислотно-основном титровании представляют собой интенсивно окрашенные слабые органические кислоты или основания, цвет которых зависит от их различного состояния (ионизированного, молекулярного и пр.) в растворе.
Теория индикаторов Оствальда.
1. Индикатор, используемый в кислотно-основном титровании, является слабой кислотой или основанием, способным к диссоциации. Индикатор кислотного типа Ind H диссоциирует в растворе:
Ind H
Причем Ind H, молекулярная (недиссоциированная форма) и Ind- -ионная
(диссоциированная форма) имеют разную окраску. Причиной изменения окраски является изменение структуры индикатора.
По характеру окрашенных форм индикаторы могут быть двухцветные и одноцветные. У одноцветных индикаторов окрашена только одна форма
(вторая бесцветная, например, фенолфталеин).
У двухцветных индикаторов окрашены обе равновесные формы
(например, метиловый оранжевый).
Каждый индикатор имеет свою область значения рН, внутри которой он существует в виде двух форм (молекулярной и ионной), находящихся в состоянии равновесия. В этой области рН индикатора имеет переходную окраску (наложение двух форм). Так, у лакмуса молекулярная форма красная,
38
ионная - синяя, молекулярно - ионная форма фиолетовая и сохраняется она при рН 5-8.
Индикаторы применяемые для кислотно-основного титрования
|
окраска |
|
|
Преобладающая |
форма |
||
индикатор |
|
|
ИПИ |
Окраска |
индикатора |
|
|
|
В кислой |
В |
(рН) |
при ИПИ |
молеку- |
ионная |
|
|
среде |
щелочной |
|
|
лярная |
|
|
|
|
среде |
|
|
|
|
|
Метиловый |
красная |
желтая |
4,2- |
оранжевая |
рН ‹4,2 |
рН ›6,3 |
|
красный |
|
|
6,3 |
|
|
|
|
фенолфталеин |
Бесцветная |
малиновая |
8,2- |
Бледно- |
рН ‹8,2 |
рН ›10 |
|
|
|
|
10 |
розовая |
|
|
|
лакмус |
красная |
фиолетовая |
5,0- |
синяя |
рН ‹5 |
рН ›8 |
|
|
|
|
8,0 |
|
|
|
|
Феноловый |
желтая |
красная |
6,8- |
оранжевая |
рН ‹6,8 |
рН ›8,4 |
|
красный |
|
|
8,4 |
|
|
|
|
Требования к индикаторам в титриметрии:
1.Равновесие между обеими формами индикатора должно достигаться быстро, т.е. реакция должна идти быстро в обоих направлениях.
2.Чувствительность индикатора должна быть достаточно высокой. Если речь идет об изменении цвета, то индикатор должен быть интенсивно окрашенным соединением.
3.Необходимо, что бы реакция измеряемого соединения с индикатором не отражалась на его концентрации, т.е. чтобы можно было прибавлять индикатор
вочень малом количестве.
4.Принцип выбора индикаторов. Гидролиз солей.
Титранты, их приготовление и стандартизация.
Способы титрования.
Реагент, добавляемый к анализируемому веществу с точно известной концентрацией называют титрантом. Часто такой раствор называют рабочим раствором. Титранты должны удовлетворять ряду требований. Они должны: а)
легко и быстро приготавливаться; б) анализироваться простыми и
39
