

Степень диссоциации (ионизации) α называется отношение числа
молекул, распавшихся на ионы, к общему числу молекул этого вещества в
растворе:
α = n/N,
где n – число распавшихся на ионы молекул электролита,
N – общая концентрация молекул.
Степень диссоциации измеряется в % или в долях единицы.
α ≤ 1,тогда
число продиссоциировавших молекул 100% общее число молекул
По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, α > 30 %. У слабых электролитов α ≤ 3 %. К слабым относят некоторые минеральные кислоты
(HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
В промежутке при значениях α от 3 до 30% электролиты считаются средней силы.
α - зависит от температуры, концентрации и природы электролита.
Важнейшей характеристикой слабого электролита служит константа диссоциации (Кд).
Рассмотрим равновесную реакцию диссоциации слабого электролита НАn:
HAn H An - .
An - .
Константа равновесия Кс этой реакции и есть Кд:
[H ] [An- ] KД [HAn] .
10

Кд – это отношение произведения концентрации диссоциированных
ионов к концентрации непродиссоциированных молекул.
Кд показывает, во сколько раз скорость диссоциации больше скорости ассоциации.
Кд зависит от природы электролита и растворителя, температуры и не
зависит от концентрации.
Если выразить равновесные концентрации через концентрацию слабого электролита С и его степень диссоциации α, то получим
|
C |
C |
|
C |
2 |
|
KД |
|
|
. |
|||
|
|
|
|
|
||
C (1 |
) |
1 |
|
|||
|
|
|
||||
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:
KД C  2 .
2 .
Тогда


 KД
KД  C 1 .
C 1 .
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице. Тогда закон Оствальда может быть сформулирован так: Степень диссоциации слабого электролита возрастает
с разбавлением раствора
Рассмотрим диссоциацию N моль электролита, диссоциирующего на
n ионов. Тогда зависимость изотонического коэффициента от степени диссоциации можно записать в виде
i |
(1 ) N |
n N |
. |
|
|
|
N |
|
|
|
|
||
|
|
|
|
|
|
|
Решая уравнение относительно α, получим |
|
|
i |
1 |
. |
|
|
|
|
|
|||
|
|
|
|
n |
1 |
|
|
11 |
|
|
|
|
|

Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента.
Следует иметь в виду, что в случае сильных электролитов найденное таким способом значение α выражает «кажущуюся» степень диссоциации,
поскольку в растворах сильные электролиты диссоциированы полностью.
Ионное произведение воды. Водородный и
гидроксильный показатели.
Важное значение имеет диссоциация воды, поскольку она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
Н2О Н+ + ОН‒
Ее константа при 295 К (22 оС) равна
K |
|
[H ] [OH- ] |
1,8 10 |
16 . |
||
Д |
[H |
2O] |
|
|||
|
|
|
|
|||
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
[H2O] |
1000 |
55,6 |
моль∙л-1, |
||
|
|
||||
18 |
|||||
|
|
|
|||
Отсюда произведение постоянных величин
KД [H2O] [H ] [OH- ] const .
Численная величина произведения ионов, на которые диссоциирует вода,
называемое ионным произведением воды Кв, равна
KB [H ][OH- ] KД [H2O] |
1000 1,8 10-16 |
1 10 14 . |
||
|
18 |
|||
|
|
|||
Таким образом, в пределах 15-25°С ионное произведение воды Kв=10 14
Равенство [H ] и [OH- ] соответствует нейтральной среде:
12

[H ] = [OH- ] = 1 ∙ 10‒7 моль-ион/л,
при [H ] > 1 ∙ 10‒7 моль-ион/л – кислой,
при [H ] < 1 ∙ 10‒7 моль-ион/л – щелочной.
Для удобства характеристики кислотности среды было предложено использовать отрицательный логарифм от ионного уравнения воды.
Очевидно,
−lg( [H+][OH‒] )=(−lg 1·10‒14 ).
Отсюда
(-lg[Н+]) + (-lg[ОН-]) =(−lg 1·10‒14 ).
Величину отрицательного логарифма концентрации ионов водорода называли водородным показателем и обозначили рН, отрицательный логарифм концентрации ионов гидроксила гидроксильным показателем и обозначили его рОН.
Так как рН = -lg[Н+], рОН = -lg[ОН-], тогда рН+ рОН = 14.
Величина рН впервые была введена датским химиком С. Серенсоном.
Буква «р» - начальная от датского слова potenz (степень), |
«Н»- символ |
водорода. |
|
Вкислых растворах рН <7, в нейтральных =7, в щелочных >7.
Вобычной лабораторной практике рН измеряют с погрешностью 0,02.
Величины рН и рОН можно рассчитать используя значения ионного произведения воды.
Если [Н+ ] = 10 -3 моль-ион/л ; рН = -lg[Н+], рН = -lg[10-3 моль-ион/л]= 3,
а рОН = 14 – рН = 14 – 3=11, тогда рН + рОН =14.
13

Гидролиз солей
Кроме реакции диссоциации, в растворе происходят реакции обмена между растворенным веществом (протолитом) и растворителем (для водных растворов – гидролиз, для неводных – сольволиз).
Гидролиз – реакция взаимодействия соли с водой, приводящая к
образованию слабого электролита с изменением характера среды.
Гидролизу подвергаются соли, образованные слабым основанием и сильной кислотой и наоборот. Соли, образованные сильным основанием и сильной кислотой гидролизу не подвергаются.
Пример:
1. Взаимодействие соли, образованной слабой кислотой и сильным основанием.
СН3СООNa+ HOH  СН3СООH+NaOH
СН3СООH+NaOH
СН3СОО-+ HOH  СН3СООH+OH- , рН > 7, среда щелочная.
СН3СООH+OH- , рН > 7, среда щелочная.
2. Взаимодействие соли, образованной сильной кислотой и слабым основанием.
|
NH4Cl+HOH NH4OH+HCl |
|
||
|
NH4++ HOH |
NH4OH+H+, рН<7, среда кислая. |
||
3. Взаимодействие соли, |
образованной слабой |
кислотой и слабым |
||
основанием. |
|
|
|
|
|
СН3СООNH4 |
СН3СОО-+ NH4+ |
|
|
|
СН3СОО-+HOH СН3СООH+OH- |
|
||
|
NH4++ HOH |
NH4OH+H+. |
|
|
СН3СОО |
NH4+HOH |
NH4OH+ СН3СООH, рН~7, среда нейтральная. |
||
Механизм |
гидролиза |
солей |
заключается |
в поляризационном |
взаимодействии ионов соли с их гидратной оболочкой. Чем сильнее это взаимодействие, тем интенсивнее протекает гидролиз.
Все рассмотренные случаи гидролиза касались солей, образованных
однокислотными |
основаниями и одноосновными кислотами. Соли |
|
14 |
многоосновных кислот |
и многокислотных оснований гидролизуются |
ступенчато, образуя при |
этом кислые и основные соли. |
Например, соли Na2CO3, К3РО4 гидролзуются ступенчато, образуя кислые соли.
Соли AlCl3, Cu(NO3)3, CrCl3 гидролизуются ступенчато с образованием на промежуточных стадиях основных солей.
Процесс гидролиза характеризуется константой гидролиза (Кгидр) и
степенью гидролиза (α). Константа гидролиза отвечает за глубину протекания
процесса. |
|
|
|
|
|
Рассмотрим взаимодействие хлорида аммония с водой: |
|
||||
|
NH4Cl+H2O NH4OH+HCl |
|
|||
|
NH4++ H2O NH4OH+H+, рН<7, среда кислая |
|
|||
Запишем |
константу |
равновесия, |
характеризующую |
процесс |
|
взаимодействия хлорида аммония с водой: |
|
|
|||
|
Kравн |
|
NH4OH H |
Kгидр . |
|
|
|
NH4 H2O |
|
||
|
|
|
|
|
|
Степень гидролиза представляет собой отношение концентраций гидролизуемой соли к общей концентрации соли и выражают в долях единицы или в процентах:
α = .
.
Степень гидролиза зависит от природы соли, ее концентрации и температуры.
Согласно закону действующих масс, степень гидролиза возрастает с разбавлением раствора. Качественно влияние температуры на степень гидролиза можно прогнозировать на основе принципа Ле Шателье. Так,
реакция экзотермична (∆Н0 = – 56,5 кДж /моль), то противоположный ей процесс гидролиза является эндотермическим.
Поэтому в соответствии с принципом Ле Шателье с повышением температуры степень гидролиза растет.
15
Гидролиз характерен для многих классов неорганических и органических соединений. Гидролиз неорганических соединений важен для оценки их токсичности, а гидролиз органических соединений применяют для получения ценных продуктов из древесины, жиров, эфиров и т.п., но особенно важную роль гидролиз играет в жизнедеятельности живых организмов.
Роль гидролиза в биохимических процессах трудно переоценить. Прежде всего, необходимо отметить ферментативный гидролиз, благодаря которому три основных компонента пищи - жиры, белки, углеводы - в желудочно-
кишечном тракте расщепляются водой на более мелкие фрагменты. В общем виде гидролиз пищевых компонентов описывается
R1 – O – R2 + H2O→ R1 – OH + R2 – OH,
где R1, R2 – фрагменты биоорганической молекулы, связанные через кислород.
Без этого процесса не было бы возможно усвоение пищевых продуктов,
так как всасываться в кишечнике способны только относительно небольшие молекулы.
Так, усвоение полисахаридов и дисахаридов становится возможным послетолько полного их гидролиза ферментами до моносахаридов.
Точно так же белки и липиды гидролизуются до веществ, которые лишь потом могут усваиваться.
16

2. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Количественной характеристикой раствора служит его концентрация, то есть количество растворенного вещества в определенном количестве раствора или растворителя. Различают массовую долю, молярную и нормальную концентрации. В аналитической химии наряду с общими химическими понятиями широко используют ряд таких понятий, которые присуще только ей и помогают характеризовать состав раствора. К ним относятся титр,
эквивалент, титр по определяемому веществу. Рассмотрим каждый из способов определения концентрации вещества.
Массовая доля (ω) - отношение массы соответствующего компонента в растворе m(x) к общей массе этого раствора. Выражается в единицах или процентах.
ω (х)= |
; ω (х) %= |
∙ 100%, |
|
где m раствора = m растворенного вещества + m растворителя; |
|
||
Согласно формуле |
ρ= m/V, где ρ- плотность раствора, m-масса, |
V- |
|
объем, тогда m раствора = Vраствора∙ ρ.
Численно массовая доля равна числу граммов вещества, растворенного в
100г раствора. Массовая доля всегда рассчитывается на безводное вещество.
Масса растворенного вещества рассчитывается с точностью до третьего знака-
0,00Х.
Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора.
Численно (См) равна количеству молей растворенного вещества,
содержащегося в 1 л. раствора). Выражается она в моль/л. Сокращенно пишут М. Например, 2М (NaOH).
См= ,
,
где 1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
17
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
0,001М – милимолярный раствор.
Концентрация веществ в биологических жидкостях измеряется в
миллимолях растворенного вещества содержащего в литре раствора (мМ/л).
Так, содержание глюкозы в крови у здорового человека должно быть 5,8
мМ/л.
Молярная концентрация эквивалента (Нормальная концентрация СN
или Н)- количество моль эквивалентов вещества, содержащегося в 1 л раствора СN= .
.
Единица измерения моль эквивалентов/л, Сокращенно обозначается буквой N. Если раствор 1Н раствор – в 1 л раствора содержится 1 эквивалент или 1 эквивалентная масса вещества; 0,1Н –О,1мольэквивалента растворенного
вещества, раствор деценормальный.;
0,01М – сантинормальный раствор; Например, 0.1Н HCL означает, что в 1
литре такого раствора содержится 0,1моль эквивалент НСl. Если эквивалентная масса соляной кислоты равна 36,5г, то в 1 л 0,1Н раствора содержится 3,65г
НС1. Эквивалентом вещества называется такое количество его, которое взаимодействует с одним моль атомов водорода или вообще с одним
эквивалентом любого другого вещества. Обозначается эквивалент |
Э (Х), |
выражается в молях. |
|
Масса одного эквивалента вещества называется эквивалентной |
массой, |
обозначается Мэкв, выражается в г/моль (экв). Эквивалент в большинстве случаев – величина переменная и зависит от типа реакции.
Если раствор 1Н раствор – в 1 л раствора содержится 1 эквивалент или 1
эквивалентная масса вещества; 0,1Н –О,1мольэквивалента растворенного вещества, раствор деценормальный.;
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
18

0,001М – милимолярный раствор.
Способы расчета Мэкв. Для кислот, оснований и солей:
1.
2.
3.
Понятие эквивалентов в окислительно-восстановительных реакциях то же,
что в реакциях обмена. Однако способ расчета различен:
4.
5.
Закон эквивалентов предложен в 1814г. И.Рихтером: «Вещества взаимодействуют и получаются в массовых количествах прямо пропорционально их эквивалентам».
Математическое выражение этого закона:
m1, m2- массы веществ, Э1, Э2- эквиваленты веществ.
Пропорция не изменится, если поменять местами m2 с Э1. Тогда получим
 =
=
 =
=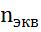
Следствия закона:
1. Объемы реагирующих растворов обратно пропорциональны их нормальным и молярным концентрациям:
 =
= ; для молярной концентрации
; для молярной концентрации 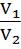 =
= ;
;
19
