
КОЛЛИГАТИВНЫЕ СВОЙСТВА
РАСТВОРОВ
Учебное пособие
1

Федеральное государственное бюджетное образовательное учреждение высшего образования
«Саратовский государственный медицинский университет имени В.И. Разумовского»
Министерства здравоохранения Российской Федерации
КОЛЛИГАТИВНЫЕ СВОЙСТВА
РАСТВОРОВ
Учебное пособие
Издательство
Саратовского государственного медицинского университета
2019
2
УДК 544.352(075.6)(075.8) ББК 24.5 я73
К607
Авторы-составители:
С.Б. Орлов, Р.Т. Куцемако, Т.О. Рябухова, П.В. Решетов
Коллигативные свойства растворов: учеб. пособие / авт.-сост.: С.Б. Орлов, Р.Т.
К607 Куцемако, Т.О. Рябухова, П.В. Решетов; Сарат. гос. мед. ун-т. – Саратов: Изд-во Сарат. гос. мед. ун-та, 2019. – 32 с.
В учебном пособии вопросы теории и практики соединены в единую форму занятия. Рассматриваются примеры решения задач по теме. Последовательность расположения заданий служит установлению логической связи между основными понятиями и раскрытию обобщающих закономерностей.
Предназначено для студентов по специальностям «лечебное дело», «педиатрия» и «стоматология» в соответствии с рабочими программами дисциплин.
УДК 544.352(075.6)(075.8) ББК 24.5 я73
Рецензенты:
доктор химических наук, профессор Е.Г. Кулапина; доктор медицинских наук, профессор В.Б. Бородулин
Одобрено к изданию ЦКМС СГМУ Текст печатается в авторской редакции
© Орлов С.Б., Куцемако Р.Т., Рябухова Т.О.,
Решетов П.В., 2019
© Саратовский государственный
медицинский университет, 2019
3
ВВЕДЕНИЕ
Растворы играют важную роль как в живой, так и в неживой природе.
Сложные физико-химические процессы в организме человека и других живых организмах протекают в растворах. В человеческом организме содержится много разнообразных биологических жидкостей: от простых растворов солей и кислот, до таких сложных дисперсных систем, как кровь. Все реакции обмена веществ в живом организме протекают в растворах. Активность ферментов,
чувствительность рецепторов и электрофизиологические явления на мембранах клеток зависят от водно-электролитного состава окружающих биологических жидкостей. Установлено, что некоторые свойства разбавленных растворов зависят от количества частиц растворенных веществ и не зависят от химического состава этих частиц. Поскольку такие свойства обусловлены коллективным влиянием растворѐнных частиц, их принято называть
коллигативными – от латинского colligatus, что означает собирать.
3

КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Коллигативными называются свойства растворов, зависящие от числа
кинетических единиц системы (молекул, ионов).
К ним относят понижение давления пара растворителя над раствором,
повышение температуры кипения и понижение температуры замерзания
растворов, диффузию, осмос. Разберем этот вопрос подробнее.
При внесении в растворитель некоторого вещества меняются термодинамические свойства не только растворяемого вещества, но и свойства растворителя. Эти изменения связаны с характером взаимодействия молекул вещества и растворителя, а также с уменьшением концентрации молекул растворителя и пропорциональны числу растворенных частиц, поэтому для
свойств растворителя удобно использовать понятие идеального раствора.
Идеальным раствором называется раствор, образование которого не сопровождается химическим взаимодействием, изменением объѐма и тепловым
эффектом 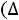
 Французский ученый Ф. М. Рауль первый сформулировал законы,
Французский ученый Ф. М. Рауль первый сформулировал законы,
описывающие влияние растворенного вещества на физические свойства растворителя. Эти законы выведены на основе второго начала термодинамики
из условия термодинамического равновесия 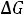

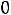 для физических процессов.
для физических процессов.
Например, если в замкнутый сосуд поместить чистый растворитель,
можно воду, то в этой системе будут протекать два процесса: испарение молекул воды с поверхности жидкости и обратный процесс – конденсация молекул из газовой фазы на поверхности жидкости. Через некоторое время в
системе установится динамическое равновесие 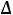
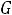
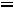
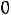 , т.е. такое состояние системы, когда число частиц, испаряющихся с поверхности жидкости за единицу времени, равно числу частиц, переходящих в жидкость из газовой фазы.
, т.е. такое состояние системы, когда число частиц, испаряющихся с поверхности жидкости за единицу времени, равно числу частиц, переходящих в жидкость из газовой фазы.
Пар, находящийся в равновесии с жидкостью, называют насыщенным.
Давление такого пара р0 называют давлением или упругостью насыщенного пара чистого растворителя.
4

При данной температуре давление насыщенного пара чистого растворителя – величина постоянная и является термодинамической характеристикой растворителя. При повышении температуры р0 над растворителем возрастает в соответствии с принципом Ле Шателье, так как испарение – процесс эндотермический 


 ).
).
Если в летучий растворитель (спирт, вода и т. д.) внести нелетучее растворимое вещество, например, сахарозу или хлористый натрий, то концентрация растворителя в образовавшемся растворе уменьшится, а,
следовательно, уменьшится число частиц растворителя, переходящих в газовую фазу, соответственно уменьшится химический потенциал растворителя. При этом давление насыщенного пара над раствором нелетучего вещества станет меньше, чем над чистым растворителем, следовательно, чем более концентрированный раствор, тем ниже давление пара растворителя над раствором. Эти эксперименты позволили Раулю в 1886 г. сформулировать первый закон:
Давление пара, содержащего нелетучее растворенное вещество,
прямо пропорционально молярной(мольной) доле растворителя.
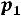

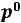

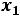 ,
,
где 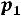 – давление пара над раствором,
– давление пара над раствором, 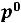 – давление насыщенного пара над чистым растворителем, а
– давление насыщенного пара над чистым растворителем, а 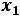 – молярная (мольная доля) растворителя – это отношение количества растворителя к общему количеству растворѐнного вещества и растворителя).
– молярная (мольная доля) растворителя – это отношение количества растворителя к общему количеству растворѐнного вещества и растворителя).
где |
количество |
молей растворителя и |
растворенного |
вещества |
соответственно. |
|
|
|
|
На |
практике для |
характеристики давления |
насыщенного |
пара над |
раствором наиболее часто используют величину относительного понижения давления пара над раствором. Тогда первый закон Рауля формулируется
следующим образом:
5
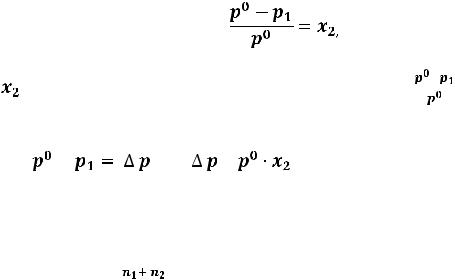
Относительное понижение давления насыщенного пара растворителя над
раствором, содержащим нелетучее растворенное вещество равно
молярной доле растворенного вещества.
где |
– молярная доля |
растворенного веществ, а |
|
|
|
– относительное |
|||
|
|
|
|||||||
понижение давления пара над раствором. |
|
|
|
||||||
Так как |
|
|
, то |
= |
. |
|
|
|
|
|
|
|
|
|
|
||||
(Мольная доля растворѐнного вещества – это отношение количества растворѐнного вещества к общему количеству растворѐнного вещества и
растворителя 
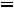
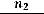 ).
).
В соответствии с законом Рауля давление насыщенного пара для раствора любого нелетучего вещества при любой температуре всегда меньше, чем для чистого растворителя.
ТЕМПЕРАТУРЫ КИПЕНИЯ И ОТВЕРДЕВАНИЯ РАСТВОРОВ
Из первого закона Рауля вытекает, что растворы нелетучих веществ должны кипеть при более высокой температуре и отвердевать при более низкой по сравнению с чистым растворителем.
При нагревании жидкости давление насыщенного пара увеличивается.
Жидкость кипит тогда, когда давление насыщенного пара становится равным внешнему давлению. Температура кипения жидкости – это температура, при которой давление насыщенного пара над жидкостью равно внешнему давлению.
Из-за понижения давления пара раствора последний должен быть нагрет до более высокой температуры, чем растворитель. В этом случае давление пара
6

раствора достигнет внешнего давления и раствор закипит. Чем выше концентрация раствора, тем выше температура его кипения.
Любое чистое вещество, находящееся в жидком состоянии,
характеризуется определѐнной температурой замерзания, при которой оно полностью отвердевает. Температурой начала кристаллизации раствора называется температура, при которой при охлаждении начинается образование кристаллов. Температуру начала кристаллизации принято называть температурой замерзания в тех случаях, когда эта температура ниже комнатной. При замерзании давление насыщенного пара над твѐрдым веществом и над жидкостью одинаково.
Второй закон Рауля формулируется так:
повышение температуры кипения или понижение температуры
отвердевания разбавленных растворов неэлектролитов пропорциональны
числу частиц растворѐнного вещества и не зависят от его природы.
Математически это выражается следующими формулами:
и
где Е и К – коэффициенты пропорциональности, соответственно
эбуллиоскопическая и криоскопическая константы, зависящие только от природы растворителя, а b – моляльность раствора. (Напомним, что моляльность раствора – это количество растворѐнного вещества,
приходящееся на 1 кг растворителя). Эбуллиоскопические и криоскопические константы численно равны повышению температуры кипения или понижению температуры замерзания одномоляльного раствора (моль вещества в 1000 г
растворителя) по сравнению с чистым растворителем. Эта величина для каждого растворителя постоянна. Для воды К = 1,86 (К∙кг∙моль-1), Е = 0,52
(К∙кг∙моль-1).
Для растворов электролитов изменение температуры замерзания и повышение температуры кипения может быть рассчитано только после
7

введения коэффициента, учитывающего увеличение числа частиц, вызванное диссоциацией молекул на ионы – с учетом изотонического коэффициента – i.
и
Значения изотонического коэффициента увеличиваются по мере разбавления, т. к. уменьшается взаимодействие между ионами и увеличивается степень диссоциации. Так, для разбавленных растворов NaCl i = 2, а CaCl2 i = 3.
Рассчитывается изотонический коэффициент по формуле

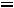
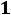

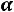
 –
–  ,
,
где 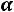 – степень диссоциации, а
– степень диссоциации, а 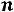 – число ионов.
– число ионов.
Законы Рауля находят важное практическое применение. Одно из них – возможность определять молекулярные массы растворѐнных веществ.
1. Учитывая определение мольной доли и обозначая через х1 и х2
соответственно число молей растворителя и число молей растворѐнного вещества можно записать следующее
|
|
|
|
|
= |
|
, а |
|
|
|
|
|
|||||||
|
Если раствор состоит из |
|
граммов растворителя с молярной массой |
||||||
М1 и |
граммов растворенного вещества с молярной массой М2, то получаем |
||||||||
и 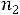

Учитывая полученные формулы, приведѐнное уравнение принимает вид
= |
|
|
. |
|
|
|
|||
|
|
|
|
|
Поскольку раствор разбавлен, число молей n2 мало по сравнению с n1. Поэтому можно упростить полученное выражение
=
или
8

|
|
|
|
|
|
|
= |
|
|
. |
||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||
Физические константы |
|
|
и М1 |
растворителя известны (они приводятся в |
||||||||
справочниках), массы |
|
|
и |
|
|
определяются при приготовлении раствора. |
||||||
Чтобы вычислить неизвестную молярную массу М2 какого-либо вещества,
остаѐтся измерить давление пара раствора |
(точнее уменьшение давления |
||
пара |
|
). |
|
|
|
||
2. Зная, что моляльным повышением температуры кипения, или эбуллиоскопической константой 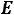 , называется повышение температуры кипения, которое происходит при растворении 1 моля вещества в 1000 г
, называется повышение температуры кипения, которое происходит при растворении 1 моля вещества в 1000 г
растворителя, можно определять неизвестные молярные массы различных веществ, степень диссоциации электролита.
Так, если известны эбуллиоскопическая константа растворителя и повышение температуры кипения раствора Ткип= Т – Т0 (где Т – температура кипени раствора, Т0 – температура кипения растворителя), то можно определить молярную массу М2 растворѐнного вещества, используя формулу:
или
Эбуллиоскопический метод определения молекулярной массы применяется для веществ, которые не могут быть превращены в пар и для которых,
следовательно, нельзя использовать метод плотности пара.
3.Зная, что молярным понижением температуры плавления, или
криоскопической константой 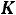 , называется понижение температуры замерзания раствора, обусловленное 1 молем вещества, растворѐнного в 1000 г
, называется понижение температуры замерзания раствора, обусловленное 1 молем вещества, растворѐнного в 1000 г
растворителя, можно определять неизвестные молярные массы веществ. Для этого используют следующие формулы
9
