
РОЛЬ ОСМОСА И ОСМОТИЧЕСКОГО ДАВЛЕНИЯ
ВБИОЛОГИЧЕСКИХ СИСТЕМАХ
1.Осмос регулирует поступление воды в клетки и межклеточные
структуры. Если бы вода просачивалась в ткани, то это вызывало бы отек различных органов и подкожной живой клетки. Это наблюдается при механических повреждениях различных органов.
2.Упругость клеток (тургор), эластичность тканей, сохранение определенной формы органов обусловлены осмотическим давлением. Клетки некоторых растений развивают давление 4–20 атм. Прорастающие ростки деревьев поднимают асфальт.
3.В медицинской практике широко применяются изотонические
(физиологические) и гипертонические растворы.
Осмотическое давление крови человека при 37 0С составляет около 740– 780 кПа (7,7–7,8 атм), это давление создает электролитный состав крови: 60%
этого давления создает NaCl, затем глюкоза и др. Часть осмотического давления 2,5–4,0 кПа (около 0,03 атм) обусловлено белками (альбуминами и глобулинами). Это давление называется онкотическим.
Величина онкотического давления соизмерима с гидростатическим давление крови. В артериальной крови гидростатическое давление больше онкотического, а в венозной – меньше, поэтому жидкость из артериальных капилляров перемещается в межклеточную жидкость тканей, а венозные капилляры, наоборот, втягивают межклеточную жидкость. При уменьшении концентрации белков (голодание, выделение с мочой) соотношение между гидростатическим и онкотическим давлением нарушается и жидкость устремляется в ткани – возникают онкотические отеки.
4. Помещая клетку в дистиллированную воду, наблюдается эндосмос
(молекулы воды проникают вовнутрь клетки), происходит набухание, а затем разрыв оболочки и вытекание клеточного содержимого. Это явление называется лизисом, в случае эритроцитов – гемолизом.
20
В клинической практике с диагностической целью определяют устойчивость эритроцитов по отношению к гипотоническим растворам.
Эритроциты, помещенные в гипотонические растворы, способны противодействовать их гемолитическому действию, что свидетельствует об их осмотической устойчивости (резистентности). Молодые эритроциты обладают более высокой осмотической устойчивостью. Они разрушаются в 0,32–0,28%
растворе NaCl. Это максимальная устойчивость эритроцитов или нижняя граница резистентности. Она характеризует «прочность» зрелых и молодых эритроцитов. Старые эритроциты легче подвергаются гемолизу уже в растворах
0,48–0,42% растворе NaCl. Это минимальная устойчивость или верхняя граница резистентности. При заболеваниях, сопровождающихся появлением в крови большого количества молодых форм эритроцитов, осмотическая устойчивость крови повышается.
Для определения готовят растворы NaCl в убывающей концентрации с
0,5 до 0,28%. Та концентрация раствора, в которой появляются признаки гемолиза (розовое окрашивание раствора над оседающими эритроцитами),
соответствует верхней границе устойчивости (резистентности). А та пробирка,
где происходит гемолиз всех эритроцитов (раствор полностью окрашен в красный цвет), соответствует нижней границе устойчивости.
В концентрированных растворах солей отмечается сморщивание клеток –
плазмолиз, связанный с потерей воды, или экзосмосом.
5. Человеческий организм характеризуется постоянством осмотического давления, колебания его незначительны. Поэтому при различных процедурах в кровь человека в больших количествах можно вводить только изотонические растворы. При больших потерях крови (операции, травмы) больным вводят большое количество изотонического раствора NaCl (0,9%) для возмещения потери жидкости с кровью. Все растворы, использующиеся в качестве кровезаменителей, должны быть изотоничны крови. Обязательно изотонируют глазные капли. Но следует помнить, что изотонический раствор кровь не заменяет.
21

6.В хирургии применяют гипертонические растворы, например, 10%-й
раствор NaCl. Смоченную в таком растворе повязку накладывают на рану для очистки от гноя, микроорганизмов и продуктов распада. При гипертонических кризах вводят 25%-й раствор сульфата магния.
7.Горькая соль 




 и глауберова соль
и глауберова соль 





 являются сильными слабительными средствами. Это их свойство основано на осмосе: эти соли плохо всасываются желудочно-кишечном тракте,
являются сильными слабительными средствами. Это их свойство основано на осмосе: эти соли плохо всасываются желудочно-кишечном тракте,
гипертонические растворы |
и |
заставляют |
устремляться в просвет кишечника большое количество воды, что приводит к
послабляющему эффекту.
8.Почка – эффективный осмотический аппарат. Основная функция ее заключается в удалении продуктов обмена из крови: в более концентрированный раствор – мочу – через полупроницаемую мембрану.
9.Одним из основных механизмов поступления минеральных веществ в эмаль зубов следует считать осмотическое давление. Если эмаль покрыть высококонцентрированным раствором сахара, то осмотическое давление достигает 50 атм, поэтому малые по размеру ионы, включая Н+, будут интенсивно проникать в эмаль, что в конечном итоге приведет к кариесу.
22

ПЕРЕЧЕНЬ ЗАДАЧ С ЭТАЛОНАМИ РЕШЕНИЯ
Задача 1. Найти давление насыщенного пара над 5%-м водным раствором мочевины при 25 0С, если давление насыщенного пара воды при этой температуре составляет 3,166 кПа.
Решение. Для расчета по формуле
р1 = р0х1,
(где р1 – давление пара над раствором, р0 – давление насыщенного пара над чистым растворителем, а х1 – молярная (мольная) доля растворителя необходимо найти мольную долю растворителя. Раствор 5%-й. Это значит,
что в 100 г раствора мочевины содержится 5 г мочевины и 95 г воды.
 мочевины(CO(NH2)2) = 60 г/моль, а
мочевины(CO(NH2)2) = 60 г/моль, а 
 = 18 г/моль. Отсюда n1 = 95 / 18 = 5,278 моль и n2 = 5 / 60 = 0,083 моль.
= 18 г/моль. Отсюда n1 = 95 / 18 = 5,278 моль и n2 = 5 / 60 = 0,083 моль.
Находим мольную долю растворителя по формуле
x1 |
|
n1 |
|
, |
х1 |
|
|
= |
. |
|
|
|
|
|
|||||
n1 |
|
|
|||||||
|
|
n2 |
|
|
|
|
|
||
Следовательно, |
р1 = 0,985∙3,166 кПа = 3,119 кПа. |
||||||||
Ответ: р1 = 3,119 кПа.
Задача 2. При какой температуре будет кристаллизоваться раствор глюкозы (С6Н12О6), содержащий 54г глюкозы в 250 г воды? М глюкозы = 180 г/моль.
Решение. Для этого используют следующую формулу
Для воды |
= 1,86 (К∙кг∙моль-1), тогда |
|||||
|
|
|
|
|
|
= 2,23 К. |
Температура замерзания воды 0 0 |
|
|||||
. Следовательно, раствор будет замерзать |
||||||
при температуре |
|
|
–2,23 0 . |
|||
|
||||||
Ответ: |
–2,23 0 . |
|
|
|||
23

Задача 3. Раствор, содержащий 8 г вещества в 100 г диэтилового эфира, кипит при 36,86 0С. Определите молекулярную массу растворенного вещества, если температура кипения чистого эфира 35,6 0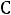 , а
, а  = 0,52 (К∙кг∙моль-1).
= 0,52 (К∙кг∙моль-1).
Решение.
Находим 
 = 36,86 0
= 36,86 0 – 35,6 0
– 35,6 0 = 1,26 0
= 1,26 0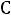 . Подставляем значения из условия задачи в формулу
. Подставляем значения из условия задачи в формулу
Отсюда молярная масса растворенного вещества  = 33 г/моль.
= 33 г/моль.
Ответ:  = 33 г/моль.
= 33 г/моль.
Задача 4. При отеке легкого для внутривенного введения используют 20%-й раствор глюкозы (Мглюкозы = 180 г/моль; ρ = 1,08 г/мл). Рассчитайте осмотическое давление этого раствора. Каким будет этот раствор по отношению к крови (гипо-, гиперили изотоническим)?
Решение.
Осмотическое давление неэлектролитов рассчитывается по формуле
|
осм |
= |
|
|
|
|
|
где |
– молярная концентрация |
вещества |
в растворе, |
(моль/л); |
– |
||
универсальная газовая постоянная, |
равная |
8,31 |
|
; |
– абсолютная |
||
|
|||||||
температура, К.
Переход от массовой доли к молярной концентрации осуществляется по
формуле: м = |
|
|
= |
|
1,2моль/л; = 273 + 37 = 310 К; |
|
|
|
|||
Тогда осм = 1,2 ∙ |
8,31 ∙ |
310 = 3091,3 кПа. Осмотическое давление крови |
|||
равно 740–780 кПа. Следовательно, это гипертонический раствор. Если 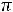 осм
осм
рассчитывается в Па, тогда  =
=  м ∙ 103 моль/м3.
м ∙ 103 моль/м3.
24

Ответ:  осм = 3091,3кПа. По отношению к крови это гипертонический раствор.
осм = 3091,3кПа. По отношению к крови это гипертонический раствор.
Задача 5. 0,15 М раствор хлорида натрия является изотоническим по отношению к раствору крови. Определите его кажущую степень диссоциации,
если осмотическое давление крови при 37 0С равно 740 кПа.
Решение.
Для растворов электролитов осмотическое давление крови рассчитывают по формуле
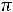 осм
осм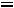
Изотонические растворы имеют одинаковое осмотическое давление.
Тогда, при |
0 |
|
|||
|
|
||||
Отсюда |
= |
|
= 1,92. |
||
|
|||||
Так как |
|
|
– |
||
где |
|
|
степень диссоциации, а – число ионов, то |
||
|
|||||
отсюда |
|
|
или 92%. |
||
Ответ: |
|
|
или 92%. |
||
Задача 6. Осмотическое давление крови в норме равно 740–780 кПа. Вычислите осмолярность крови при 310 К.
Решение.
По уравнению Вант-Гоффа
 осм =
осм = 

– осмолярная концентрация.
Ответ: |
0,287 – 0,303 |
25

Задача 7. При несахарном диабете выделяются большие объемы разбавленной мочи, осмолярность которой снижается до 0,06 осмоль/л. Вычислите осмотическое давление такой мочи при 310 К.
Решение.
 осм =
осм = 
 = 0,06
= 0,06 


 8,31
8,31 







 154,6 кПа.
154,6 кПа.
Ответ: осмотическое давление разбавленной мочи значительно ниже осмотического давления плазмы крови.
26
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1.Перечислите коллигативные свойства раствора.
2.Какой раствор называется идеальным.
3.Сформулируйте первый закон Рауля и приведите его математическое выражение.
4.Сформулируйте второй закон Рауля.
5.Приведите формулы для определения понижения температуры замерзания и повышения температуры кипения для растворов. Укажите смысл входящих в них величин.
6.Как можно определить молярную массу и степень диссоциации на основании первого и второго закона Рауля?
7.Приведите сущность криоскопического и эбуллиоскопического метода определения молекулярной массы веществ в растворах.
8.Что такое осмос?
9.Сформулируйте закон Вант-Гоффа и приведите его математическое выражение для электролитов и неэлектролитов. Дайте пояснения.
10.Что называется осмотическим давлением?
11.Какие растворы называются гипо-, гипер- и изотоническими?
Приведите примеры таких растворов.
12.Что называется экзо- и эндоосмосом?
13.Что произойдет с эритроцитами, если их поместить в гипертонический раствор?
14.Роль осмоса и осмотического давления в биологических системах.
15.100 г воды содержат 4,57 г сахарозы (М = 342 г/моль). Найти
а) осмотическое давление при 25 оС;
б) температуру замерзания;
в) давление насыщенного пара над раствором, если р0 воды при этой температуре составляет 3,166 кПа, а ρ = 1,02 г/мл.
27
16. Какова степень диссоциации раствора уксусной кислоты, содержащем
0,01 моль вещества в 500 мл раствора, если осмотическое давление этого раствора при 300 К равно 86,6 кПа?
17. Раствор, в 100 мл которого содержится 2,3 г вещества, обладает при
298 К осмотическим давлением 618,5 кПа. Определите М вещества.
18.На сколько градусов повысится температура кипения воды, если в 100 г
воды растворить 9 г глюкозы (М = 180 г/моль)?
19.Что произойдет с эритроцитами при 37 0С в 2%-ом растворе глюкозы (ρ
=1,006 г/мл; М = 180 г/моль)?
20.Рассчитайте осмотическое давление 0,01 М раствора КСl при 310 К,
если степень диссоциации его в этом растворе равна 96%. Каким будет этот
раствор по отношению к плазме крови?
28
ТЕСТЫ ДЛЯ САМОКОНТРОЛЯ
1.Коллигативные свойства растворов зависят:
а) от размера частиц;
б) объема раствора;
в) числа частиц в единице объема.
2.Каково осмотическое давление в кПа раствора пиридина (М = 80 г/моль),
содержащего 4 г вещества в 2 л раствора (t = 0 0С):
а) 28,37;
б) 40,12;
в) 48,24;
г) 56,74?
3.Температура замерзания 5% раствора глюкозы а) больше;
б) меньше;
в) равна температуре замерзания 5% раствора сахарозы.
4.Осмотическое давление 0,5 М раствора глюкозы а) больше;
б) меньше;
в) равна осмотическому давлению 0,5 М раствора сахарозы.
5.Плазмолиз наблюдается в клетке, если ее поместить:
а) в изотонический раствор;
б) гипертонический раствор;
в) гипотонический раствор.
6.Давление насыщенного пара над 5% раствором сахарозы:
а) больше;
б) меньше;
в) равно
давлению насыщенного пара 5% раствора сахарозы.
7. 0,5 М раствор глюкоза будет:
29
