
2 курс / Нормальная физиология / Методические_рекомендации_по_курсу_экспериментальной_физиологии
.pdfМЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
по курсу экспериментальной физиологии для студентов биологического отделения биолого-химического факультета
Иваново Издательство "Ивановский государственный университет"
2005
Составители:
кандидат медицинских наук А. Ф. Богомолов; кандидат биологических наук И. Ю. Лукьянов кандидат биологических наук Л. Р. Горбачева;
Включает рекомендации к выполнению лабораторных работ по всем основным темам курса. Издание предназначено студентам специальности «Биология»
Печатается по решению методической комиссии биолого-химического факультета Ивановского государственного университета
Рецензент кандидат медицинских наук А. Н. Булыгин (ИГМА)
Ó Издательство «Ивановский государственный университет», 2005
ВВЕДЕНИЕ
Экспериментальная физиология - отрасль физиологии, занимающаяся использованием, разработкой и внедрением методов экспериментального изучения функций организма.
В настоящее время эксперимент является основным эмпирическим методом познания, посредством которого физиология получает, расширяет и углубляет сведения о жизнедеятельности органов и систем организма человека и животных. Исследование по
своему характеру должно дать полезные результаты на благо общества и не должно быть случайным или бесполезным.
Роль экспериментального метода в естествознании философски осмыслена родоначальником всей современной экспериментирующей науки английским философом Ф. Бэконом (1561-1626). Научный прогресс биологии в 17 веке заключался преимущественно в накоплении и систематизации материала, но главным достижением столетия все же следует считать распространение и утверждение эксперимента как основного и решающего метода познания истины. Уже в 18 веке экспериментальный метод прочно утвердился в России. Об этом свидетельствует работа первого русского гистолога A.M. Шумлянского "О строении почки" (1782). Любая научная теория прежде всего должна опираться на данные опыта. Исходя из этого F. Magendie (1783-1855) написал первое руководство по экспериментальной физиологии (1816-1817), а в 1821 году организовал первый журнал по экспериментальной физиологии. Дальнейшее совершенствование методов изучения функции внутренних органов, но уже с использованием графических методов регистрации проводилось в лаборатории К. Ludwig (1816-1895), создателя крупнейшей физиологической школы, где работали ученые из многих стран, в том числе И.М. Сеченов, И.П. Павлов и др...
Во второй половине 19 века центр основных событий в области экспериментальной физиологии постепенно перемещается в Россию. Это связано с деятельностью целой плеяды выдающихся ученых, работавших в различных городах страны. Среди них ученик F. Magendie И.Т. Глебов, который не только широко пропагандировал методы экспериментальной физиологии, но и впервые перевел на русский язык основные труды своего учителя. Киевский анатом и физиолог А.П. Вальтер в 1842 г., на 11 лет раньше С. Bernard обнаружил сосудодвигательную реакцию симпатической нервной системы. В 1842 г. В.А. Басов впервые осуществил в эксперименте создание фистулы желудка. В 1877 г. русский военный врач Н.В. Экк разработал метод выключения печени из портального кровотока.
Следует подчеркнуть, что эти и другие успехи стали возможны после того, как в 1842-1847 годах С. Long, J. Simpson, W. Morton. Ф.И. Иноземцевым и Н.И. Пироговым был разработан ингаляционный наркоз.
В биологии и медицине эксперимент прошел путь от рассечения трупов животных, через вивисекцию в донаркозную эпоху, острый опыт в период, предшествующий внедрению асептики и антисептики, до хронического наблюдения за оперированными животными, что дало в руки экспериментатора неограниченную возможность познания закономерностей жизни. В широком понимании, эксперимент можно определить как метод познания, при помощи которого в контролируемых, управляемых условиях исследуются явления действительности.
Таким образом, можно сформулировать задачи курса экспериментальной физиологии.
Разработка, усовершенствование и апробация на животных новых методов и приемов исследования функций организма.
Обеспечение в остром или хроническом эксперименте доступа к внутренним органам с целью изучения их функции.
Обучение основам хирургии и методике проведения эксперимента на животных. В определенной степени, моделирование патологических процессов для
получения более достоверной информации о структуре и функции того или иного органа.
ЭВТАНАЗИЯ ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ
Euthanasia в переводе с латинского – легкая (хорошая) смерть. Главные критерии эвтаназии следующие:
БЕЗБОЛЕЗНЕННОСТЬ ДОСТИЖЕНИЕ БЫСТРОЙ ПОТЕРИ СОЗНАНИЯ И СМЕРТИ
СВЕДЕНИЕ К МИНИМУМУ БЕСПОКОЙСТВА И СТРЕССА СКОРОСТЬ И ЭФФЕКТИВНОСТЬ МЕТОДА ПРОСТОТА ПРИМЕНЕНИЯ БЕЗОПАСНОСТЬ ДЛЯ ОПЕРАТОРА ЭТИЧНОСТЬ
Наиболее приемлемыми в наших условиях следует считать следующие.
Введение внутривенно или внутрибрюшинно нембутала. При этом для грызунов смертельная доза должна превышать наркозную в три раза.
Цервикальная дислокация. Применяется для некрупных грызунов с массой до 150 г. Сотрясение мозга (оглушение) путем удара по черепу с последующей декапитацией
большими ножницами.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №1
ОБЩИЕ МЕТОДЫ РАБОТЫ С ЖИВОТНЫМИ РАБОТА 1. Фиксация животных
Цель работы
Овладеть различными методами фиксации животных.
Методика работы
Фиксация крысы рукой.
Поставьте клетку с животными на стол и снимите верхнюю крышку. Положите правую кисть на спину животного как можно ближе к лопаткам. Подведите большой палец под левую переднюю лапу, а остальные под правую. Сила захвата животного должна соответствовать силе его сопротивления. Произведите перекрест передних лап животного. Это предохранит Вас от укуса
крысы.
При агрессивности животного примените раскачивания животного по широкой дуге в руке, разогнутой в локтевом суставе.
Фиксация крысы на операционном столике.
Возьмите крысу по вышеприведенной методике и держите ее вертикально, головой кверху.
Приготовьте 4 тряпичные петли-удавки.
Наложите петли на задние лапы выше голеностопных суставов, и туго затяните их. Наложите удавки на передние лапы и затяните их выше стопы.
Удерживая животное за удавки, положите его на живот на операционный столик. Завяжите удавки на гвоздях боковых поверхностей столика.
Фиксация лягушки на препаровальном столике.
Возьмите лягушку так, чтобы задние лапы животного лежали у Вас на ладони. Пока один экспериментатор удерживает животное за задние лапы брюшком кверху,
второй - вводит булавки в передние лапы и препаровальный столик. Повторите процедуру для задних лап.
Фиксация кролика в станке.
Возьмите кролика и посадите его в станок головой по направлению к узкому концу станка.
Оденьте на шею металлический ошейник и затяните его болты. Возьмите сетку и оденьте ее на выступающие шпильки станка.
Переноска животных.
Переноска крыс и мышей осуществляется либо за хвост, либо хваткой под брюшко. Последнее является более предпочтительным. Переноска кролика осуществляется двумя руками: одной за кожу шеи, а другой за кожу спины. Нельзя переносить кролика хваткой за уши.
РАБОТА 2. Маркировка животных
Цель работы Освоить методику маркировки крыс.
Методика работы
Фиксируйте животное одним из |
|
перечисленных способов. |
|
Возьмите краситель и кисточку. |
|
Промаркируйте крысу в соответствии |
|
с присвоенным номером. |
|
Краска наносится на шерсть до корня волос. |
|
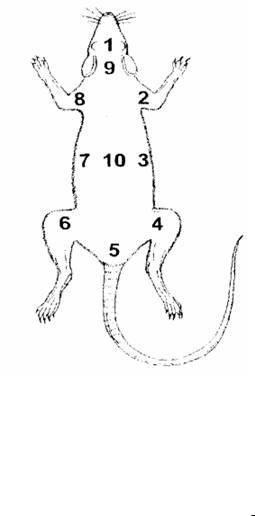
Схема маркировки крысы с помощью |
|
красителя (рис.1): |
|
лоб - 1, плечо правой передней |
|
лапы - 2, правый бок - 3, бедро правой |
|
задней лапы - 4, основание хвоста - 5, |
|
бедро левой задней лапы – 6, левый бок - 7, |
Рис.1. Схема маркировки крысы с |
плечо левой передней лапы - 8, шея - 9, |
помощью красителя. |
середина спины - 10, середина спины и |
|
лоб - 11, середина спины и плечо правой передней лапы - 12 и т. д.
РАБОТА 3. Методы введения растворов
Цель работы
Овладеть различными методами введения растворов в организм крысы. Методика работы
Введение растворов через рот (per os) no обычной методике.
Возьмите шприц на 10 мл и наберите 1 мл физиологического раствора. Рукой зафиксируйте крысу вертикально.
Наденьте на шприц иглу с напаянной булавой.
Введите иглу в полость рта крысы и осторожно продвигайте ее по задней стенке глотки в пищевод на глубину 5-7 см.
Введите раствор в желудок животному.
Остановите введение в случае поперхивания животного или кашля.
Введение растворов per os no Г. Селье.
Повторите п. п. 1 и 2 предыдущей работы.
Наденьте на канюлю шприца гибкий пластиковый катетер длиной 8-9 см.
Окуните его в подсолнечное масло и, используя естественное положение головы крысы, введите его в полость желудка по предыдущей методике.
Повторите п.п.5 и 6.
!!! В желудок крысам вводится не более 1.5 мл жидкости.
Введение растворов через прямую кишку (per rectum ).
Возьмите шприц и наберите 1 мл физиологического раствора. Наденьте на канюлю шприца пластиковый катетер длиной 6-7 см. Возьмите крысу и посадите ее на стол, на лапы, фиксируя ее рукой. Поднимите хвост и найдите anus.
Введите катетер на глубину 5-6 см и введите раствор.
!!! Per rectum вводится не более 1 мл раствора.
ПАРЕНТЕРАЛЬНОЕ (минуя желудочно-кишечный тракт) ВВЕДЕНИЕ РАСТВОРОВ.
Накожное введение, (н/к)
Возьмите крысу и выстригите шерсть на правом боку на площади примерно 2 см2. Острым концом скальпеля произведите скарификацию (царапины) на коже. Нанесите на поврежденную кожу несколько капель физиологического раствора.
Внутрикожное введение, (в/к)
Возьмите крысу и выстригите шерсть на спине на площади примерно 1 см2. В инсулиновый шприц наберите 0,5 мл физиологического раствор Удерживая крысу одной рукой другой введите иглу внутрикожно, примерно на
глубину 0,5 мм.
Введите 0,01 мл раствора так, чтобы на коже образовалось шарообразное вздутие.
!!! Внутрикожно водится не более 0,04 мл раствора.
Подкожное ведение, (п/к)
Наберите в шприц 5 мл раствора.
На спине, на боку или на бедре задней лапы большим и указательным пальцами левой руки возьмите в складку кожу животного.
В основание складки и параллельно ей введите иглу и выпустите из шприца 2-3 мл раствора.
!!! Взрослой крысе подкожно вводится до 10 мл раствора.
Внутримышечное введение, (в/м)
Наберите в шприц 1 мл физиологического раствора.
Левой рукой вытянув заднюю лапу, под углом 45° введите иглу в мышцы бедра и введите раствор.
!!! Допускается введение в мышцы до 5 мл раствора.
Внутрибрюишнное введение, (в/б)
Наберите в шприц 1 мл физиологического раствора.
Пусть помощник удерживает крысу в вертикальном положении одной рукой за кожу шеи, а другой за хвост.
Мысленно проведите линию от середины паховой складки до середины расстояния от лобка до мечевидного отростка крысы.
Экспериментатор в среднюю точку соединительной линии вводит под прямым углом к плоскости живота иглу до ощущения "проваливания" в брюшную полость.
Введите раствор.
!!! Внутрибрюшинно вводится до 5 мл раствора.
Внутривенное введение, (в/в)
Посадите кролика в станок.
Выстригите шерсть на наружной поверхности уха кролика. Наберите в шприц 1 мл физиологического раствора.
Интенсивно помассируйте ухо кролика до появления выраженности сосудов. Под острым углом введите иглу в просвет вены краевой зоны уха.
Введите раствор.
!!!Внутривенно вводится до 20 мл раствора кроликам и до 5 мл крысам
РАБОТА 4. Эвтаназия мелких лабораторных животных
Цель работы

Познакомиться с эвтаназией мелких лабораторных животных.
Методика работы
Возьмите крысу в левую руку, а в правую молоток средних размеров.
Нанесите удар средней силы в область затылка с целью "оглушения" животного. Быстро возьмите большие ножницы и над раковиной произведите декапитацию
(отсечение головы).
После декапитации держите краниальный конец крысы как можно ниже над раковиной с тем, чтобы слить кровь из туловища.
Эвтаназия путем помещения животных в закрытый сосуд с большой концентрацией медицинского эфира с точки зрения биоэтики считается недопустимой.
Каждый этап выполнения лабораторной работы обязательно показывается преподавателю, ведущему занятие для контроля за правильностью ее выполнения.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №2
ХИРУРГИЧЕСКИЕ ИНСТРУМЕНТЫ, УЗЛЫ, ШВЫ РАБОТА 1. Основные хирургические инструменты
Цель работы
Освоить методы удержания и пользования хирургическими инструментами.
Методика работы
ИНСТРУМЕНТЫ ДЛЯ РАЗЪЕДИНЕНИЯ ТКАНЕЙ.
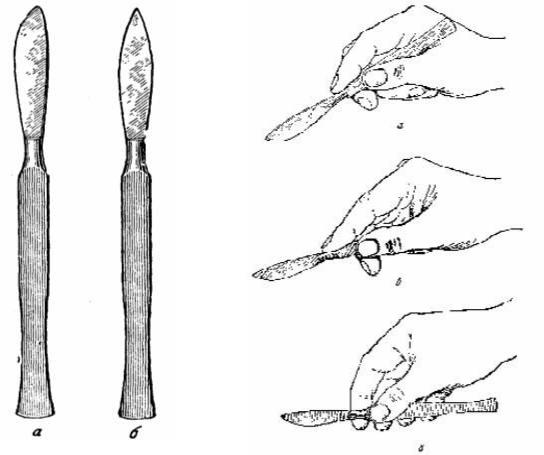
Скальпели (рис. 2.):
Возьмите скальпель в кисть в позицию писчего пера (рис. 3). Поставьте его острие на модель кожи (х/б ткань).
Сделайте быстрый разрез с минимумом давления и максимумом тяги. Разрез должен быть достаточно глубоким, с ровным краями.
Рис. 2. Виды скальпелей. |
Рис. 3. Способы удержания скальпелей. |
Слева – брюшистый; |
а –- нож в позиции писчего пера; |
справа – остроконечный |
б – нож в позиции столового ножа, |
|
в – кисть в позиции смычка |
Хирургические ножницы (рис. 4.):
Ощущение положения и контроля ножниц в движении достигается следующим образом (рис. 5).
Ногтевая фаланга 4-го пальца заводится в правое кольцо ножниц. 3-ий палец ложится на это же кольцо сверху.
2-ой палец ложится на замок (или винт), скрепляющий бранши ножниц. Ногтевая фаланга первого пальца заводится в левое кольцо.
Сделайте разрез х/б ткани.
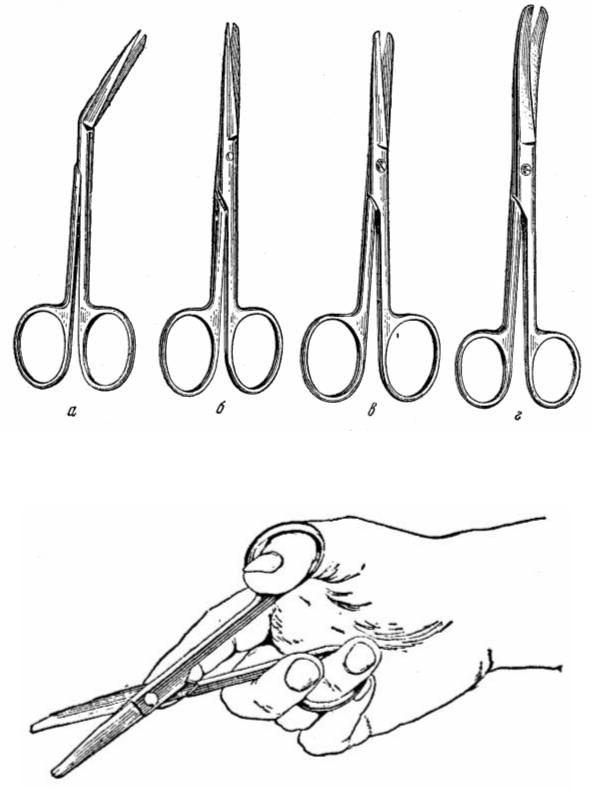
Рис. 4. Виды ножниц.
а – ножницы, изогнутые по оси (Рихтера); б – ножницы прямые остроконечные; в – ножницы прямые тупоконечные; г – ножницы, изогнутые по плоскости (Купера)
Рис. 5. Положение пальцев при пользовании ножницами.
Примечание: Ножницы более подходят для рассечения тонкослойных образований. Разрез делается быстро и четко. Вялое кромсание приводит к излишней травматизации, образованию лоскутов лишенных питания и, как следствие, ухудшению заживления послеоперационных ран.
