
2 курс / Нормальная физиология / Методические_рекомендации_по_курсу_экспериментальной_физиологии
.pdf
ХИРУРГИЧЕСКИЕ ИГЛЫ И ИГЛОДЕРЖАТЕЛИ (рис.6) Взять иглу пинцетом.
Захватить иглу иглодержателем так, чтобы не менее 2/3 иглы- (считая от острия) были свободными.
Положите иглодержатель в кисть так, чтобы 2-ой палец лежал на замке иглодержателя (рис. 7).
Приготовьте хирургическую нить.
Поместите ее по длинной оси иглодержателя, зажимая между 1-ой и 2-ой фалангами 3-его пальца.
Проведите нить под длинным концом иглы, затем между концом иглодержателя и телом иглы. Длина остатка нити в игле должна составлять около 1,5 см.
В качестве модели возьмите кусочек х/б ткани и соедините её края. Вкалывая иглу, ее ставят перпендикулярно поверхности так, чтобы потом
вращательным движением кисти из положения пронации в положение супинации продвигать ее в ткани.
Для подхватывания иглы используется анатомический пинцет.
Рис. 6. Иглодержатели и хирургические иглы.
1 - иглодержатель с изогнутыми ручками (Матье); 2 - иглодержатель Троянова: 3 - иглодержатель с прямыми кольцевыми ручками (Хегара); аа - поперечное сечение режущей хирургической иглы; бб -поперечное сечение круглой хирургической иглы; в - ушко хирургической иглы.

Рис. 7. Положение кисти при пользовании иглодержателем.
а - кисть в положении пронации; б - кисть в положении супинации.

ПИНЦЕТЫ (рис. 8)
Пинцет удерживается с одной стороны большим пальцем, а с другой -указательным и третьим (т.е. в виде писчего пера). В этом случае пинцет является как бы продолжением пальцев и обеспечивается высокая точность и чувствительность в движении (рис. 9).
Рис. 8. Виды пинцетов. а - анатомический; б - хирургический; в - лапчатый
Рис. 9. Неправильное (а) и правильное (б) держание пинцета.

КРОВООСТАНАВЛИВАЮЩИЕ ЗАЖИМЫ (рис. 10).
Их удержание и работа производится также как и у ножниц. При захватывании сосудов нужно стремиться чтобы в зажим попало по возможности меньше окружающих тканей. Попробуйте сделать это на краешке х/б ткани.
Рис. 10. Виды кровоостанавливающих зажимов.
а – зажим с овальными губками (Пеана); б – зажим зубчатый (Кохера); в – зажим с длинными губками без зубцов (Бильрота); г – зажим типа «москит».
РАБОТА 2. Хирургические швы и узлы
Цель работы
Освоить основные хирургические узлы и способы их вязания.
Методика работы
Примечание: для этой работы используйте металлический цилиндр и кусочек хлопчатобумажной ткани.
УЗЛОВАТЫЙ ШОВ Возьмите иглодержатель с иглой и заправленной нитью.
Произведите вкол и выкол на одинаковом расстоянии от краев разреза Затяните хирургический узел до соприкосновения краев раны так, чтобы они не
подвертывались и плотно соприкасались по всей толщине соединяемой поверхности.
Следите чтобы узлы располагались не на линии разреза, а сбоку на одной стороне. Швы накладываются на расстоянии 1-2 см друг от друга.
НЕПРЕРЫВНЫЙ ШОВ Возьмите длинную нить и заведите ее в иглу.
Сделайте вкол и выкол и завяжите узел.
В дальнейшем, делая вколы и выколы, произведите ушивание раны. Завяжите узел после ушивания.
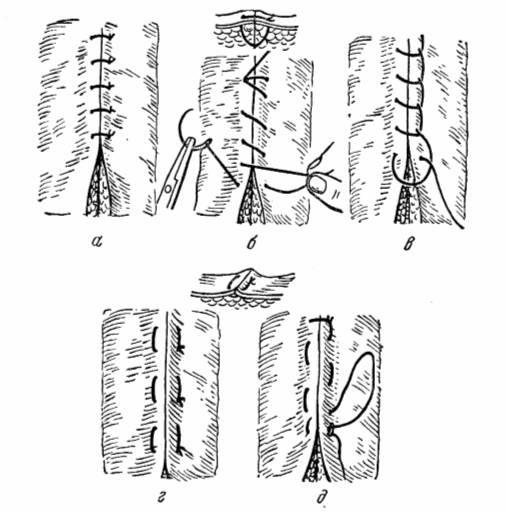
МАТРАЦНЫЙ ШОВ Произведите вкол и выкол и завяжите узел.
Произведите вкол и выкол и на этой же стороне вкол и выкол на противоположной. После ушивания раны завяжите узел. Для этого в одну руку возьмите конец нити, а
в другую сложенную вдвое нить из последнего шва.
Рис. 11. Виды швов.
а – узловатый шов; б – непрерывный шов; в – шов Мультаиовского; г – одиночный матрацный шов; д – непрерывный матрацный шов.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №3
АНЕСТЕЗИОЛОГИЯ. ПРОБНАЯ ЛАПАРАТОМИЯ РАБОТА 1. Расчёт дозы наркотического вещества для неингаляционного наркоза
Цель работы
Определить дозу наркозного вещества и стадии наркоза.
Методика работ
Возьмите крысу и определите ее массу.
В соответствии с приведенными в конце этого занятия данными рассчитайте дозу гексенала.
Разведите наркозное вещество, введите крысе, отметьте время его введения. Запишите время наступления и продолжительности каждой из стадий наркоза. Запишите данные обследования животных в таблицу, отмечая характер дыхания,
подвижность, реакцию зрачков на свет, роговичный рефлекс, болевую чувствительность, акт дефекации и мочеиспускания.
Сделайте вывод из полученных результатов.
РАБОТА 2. Расчёт эффективной дозы эфира для общей анастезии
Цель работы
Определить дозу эфира необходимую для эффективной дачи наркоза крысе.
Методика работы
Измерьте объем эксикатора. Посадите крысу в эксикатор.
Шприцем введите в эксикатор 3 мл эфира и отметьте время от момента введения до момента наступления наркотического сна.
Повторите процедуру с 5 и 10 мл эфира.
Выберите наиболее эффективную дозу, произведя соответствующие расчеты. Сделайте вывод.
РАБОТА 3. Пробная лапаратомия
Цель работы
Освоить методику лапаратомии у крыс.
Методика работы
На операционном столике зафиксируйте на спине наркотизированную крысу из предыдущей работы.
Ножницами с изогнутыми браншами выстригите шерсть по срединной линии живота.
Дважды обработайте кожу раствором йода.
Вымойте дважды руки теплой водой и обработайте их 70% спиртом.
Возьмите скальпель и одним движением произведите разрез кожи от мечевидного отростка до лонного сочленения.
Рассеките скальпелем мышцы и брюшину.
Осмотрите брюшную полость, обращая внимание на взаиморасположение органов. Послойно ушейте брюшную полость, накладывая кетгут на мышцы и брюшину
непрерывным швом, а на кожу - шелк прерывистым узловатым швом. Обработайте ушитую рану йодом.
Освободите животное и положите его в клетку. Проследите за наличием в клетке воды, пищи, опилок.
На 8-ой день после операции снимите швы после их повторной обработки раствором йода.

Примечание. В ходе операции необходимо следить за постоянным поддержанием III-ей стадии наркоза. Это осуществляется путем наложения ваты, смоченной эфиром, на мордочку животного.
Таблица. Дозы наркотических веществ для белых крыс
Вещество
гексенал
барбамил
уретан
хлоралгидрат
барбитал Na (мединал)
этаминал Na
Доза (по литературным источникам) в/б - внутркбрюшинно; п/к -подкожно
250 мг/кг, в/б
50 мг/кг, п/к
1200 мг/кг, п/к
300 мг/кг, п/к
200 мг/кг, п/к
40 мг/кг, в/бр
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №4
МЕТОДЫ ВЗЯТИЯ КРОВИ У ЛАБОРАТОРНЫХ ЖИВОТНЫХ РАБОТА 1. Взятие крови из кончика хвоста
Цель работы
Овладеть методом взятия крови из кончика хвоста у крысы.
Методика работы
На операционном столике зафиксируйте на спине наркотизированную крысу. Разогрейте хвост животного путем погружения его в теплую (+35ºС) воду. Приготовьте меланжер и ножницы.
Извлеките хвост из воды, обсушите его чистой тряпочкой и обработайте спиртом. Возьмите ножницы и отсеките 5-10 мм кончика хвоста.
Сожмите основание хвоста двумя пальцами и таким образом проведите по коже хвоста до его кончика.
Появившуюся каплю быстро наберите в меланжер до нужной отметки. Примечание. Свешивание хвоста за край стола обязательное условие для всех пунктов данной работы. В связи с этим, кровь в меланжер должна поступать самотеком, а наличие пузырьков воздуха в капиллярной части меланжера недопустимо.
РАБОТА 2. Взятие крови из сердца крысы
Цель работы
Освоить методику взятия крови из сердца крысы.
Методика работы
Исходя из данных работы 2 Лабораторного занятия № 3, дайте крысе эфирный наркоз.
Наркотизированную крысу фиксируйте к операционному столу на спину. Выстригите шерсть в области сердца и продезинфицируйте кожу. Пальпаторно определите место верхушечного толчка сердца.
Наденьте иглу на шприц и введите ее в точку лежащую на 10мм краниальнее от установленного верхушечного толчка и на 1-2 мм латеральнее от левого края грудины.
Вводите иглу перпендикулярно плоскости грудной клетки одновременно вытягивая поршень шприца на себя.
При появлении крови в шприце остановите продвижение иглы и наберите 3-5 мл крови.
РАБОТА 3. Взятие крови из ретробульбарного синуса глаза
Цель работы
Освоить методику взятия крови из ретробульбарного синуса глаза.
Методика работы
Наркотизированную крысу из предыдущего опыта отвяжите и зафиксируйте в левой руке таким образом, чтобы захватить кожу шеи как можно ближе к ушам 1-ми 2-м пальцами.
Возьмите пастеровскую пипетку и под прямым углом проколите конъюнктиву у внутреннего угла глаза.
Проведите пипетку на глубину 1-2 мм за глазное яблоко.
При правильном введении, кровь поступает в пипетку самотеком, а для взятия большого количества крови, необходимо натянуть кожу в области век, чтобы сдавить яремные вены и повысить давление в синусе.
РАБОТА 4. Взятие крови при декапитации животных
Цель работы
Освоить методику взятия крови у крысы путем декапитации.
Методика работы
Приготовьте центрифужную пробирку с вставленной в нее воронкой. Наркотизированную крысу из предыдущего опыта возьмите в левую руку, а в
правую "портновские" ножницы.
Одним движением произведите декапитацию животного и соберите вытекающую кровь в пробирку.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №5
МЕТОДИКА ВСКРЫТИЯ ЛАБОРАТОРНЫХ ЖИВОТНЫХ И ИЗЪЯТИЕ ОРГАНОВ ДЛЯ ИССЛЕДОВАНИЯ
РАБОТА 1. Вскрытие трупа крысы и изъятие органов для исследования
Цель работы
Овладеть методикой вскрытия трупа крысы и изъятия органов для исследования.
Методика работы
Возьмите крысу и определите ее массу.
Проведите эвтаназию животного путем передозировки наркоза –введите крысе анестетик в летальной дозе (дозировка для наркоза × 3) и дождитесь наступления смерти.
Фиксируйте труп животного на операционный столик брюшком кверху. Возьмите скальпель и произведите разрез кожи по средней линии от нижней
челюсти до лонного сочленения.
На шее разведите мышцы пинцетом, найдите трахею и щитовидный хрящ, ниже его, непосредственно на трахее, найдите узкую полоску ярко-красного цвета. Это щитовидная железа. С помощью пинцета и остроконечных ножниц осторожно отделите ее от трахеи и поместите в чашку Петри в физиологический раствор. Вам потребуется две чашки. В одну следует помещать все непарные и левые органы, в другую - все правые. Стеклографом пометьте их соответствующим образом.
Вскройте скальпелем брюшную полость.
Тупой браншей ножниц войдите в брюшную полость и произведите разрез брюшной стенки параллельно реберным дугам. То же самое сделайте в области лонного сочленения.

Вскройте ножницами диафрагму, после чего от середины реберной дуги ножницами пересеките ребра по направлению к плечевому суставу.
Откиньте грудину с остатками ребер к краниальному концу животного.
Захватите пинцетом трахею, аорту и прилежащие ткани, ножницами пересеките их выше захвата. Потяните все это кверху и ножницами осторожно отделите комплекс "сердце-легкие" от задней грудной стенки.
Поместите комплекс в чашку Петри и отделите сердце от легких и каждый орган от прилежащих тканей. Поместите легкие и сердце в соответствующие чашки.
Найдите в жировой клетчатке в области верхнего полюса левой почки плотное образование дискообразной формы серо-желтого цвета. Это - надпочечник. Осторожно отделите его от окружающих тканей и поместите в чашку Петри.
Проделайте ту же процедуру с правым надпочечником. Выделите почки, печень, а также селезенку.
Если это самка, в области лонного сочленения найдите тело матки и ее рога. На конце рога, примерно на уровне почки, найдите темно-красное, бугристое
образование, окруженное жировой клетчаткой. Отсеките яичник от окружающих тканей и поместите его в чашку Петри. Повторите процедуру для правого яичника.
Пересеките тело матки у основания и возьмите для исследования.
РАБОТА 2. Определение абсолютной массы органов и расчёт их относительной массы
Цель работы
Освоить методику определения абсолютной и относительной массы органов крысы.
Методика работы
Отмойте органы от крови в чашках Петри и осушите их фильтровальной бумагой. Определите массу щитовидной железы, надпочечников, яичников на торсионных
весах, а остальные органы - на аптекарских.
Вычислите относительную массу каждого органа по формуле:
где m - масса органа, М - масса тела животного.
Полученные Вами и вашими сокурсниками данные запишите в таблицу, где в первой графе будет номер животного, во второй - масса, а в последующих вначале абсолютная, а затем относительная масса каждого органа. Сравните полученные данные с литературными и сделайте вывод.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №6
МЕТОДЫ ИССЛЕДОВАНИЯ ОСНОВНЫХ ФИЗИОЛОГИЧЕСКИХ ФУНКЦИЙ В ЭКСПЕРИМЕНТЕ
ДОПОЛНИТЕЛЬНЫЕ УКАЗАНИЯ Для успешного выполнения данной работы, необходимо знать следующие разделы
по учебнику Физиология человека / Под ред. Г. И. Косицкого / -М. Медицина, 1985. 544 с. Электрокардиограмма (с.245-248), внешнее дыхание (с.292-298), температура тела и изотермия (с.396-398), возбудимость и возбуждение мышечных волокон (с. 47).
В качестве усилителя биопотенциапов на данном занятии используется электроэнцефачограф.
РАБОТА 1. Пневмография у крыс
Цель работы
Запись и анализ пневмограммы у лабораторных животных.
Методика работы
Возьмите крысу и определите ее массу.
Дайте ей эфирный наркоз по известной методике. Положите крысу на брюшко на операционный столик. Наложите петли-удавки на все лапы.
Оденьте на грудную клетку дыхательную манжетку и закрепите ее зажимом. Фиксируйте крысу к столику.
Поддерживайте у животного II-III стадию наркоза. Включите в сеть электроэнцефалограф. Включите кнопку "Сеть".
Нажмите кнопку "Регистратор" и с помощью регулятора "Центровка" выведите перо самописца в его среднее положение.
Ручкой "Усиление" добейтесь оптимальных осцилляции пера.
Включите кнопку "Запись" и произведите запись пневмограммы на скорости 3.75 мм/с и 60 мм/с. Длина записи должна быть такой, чтобы в протокол можно было подклеить ленту с 3-4 дыхательными движениями для каждого участника эксперимента.
Выключите прибор и освободите животное, выполняя п.п. 1-6 в обратном порядке. По записи дыхания рассчитайте частоту дыхания (дых/мин), амплитуду
дыхательной волны в мм. длительность одного дыхательного цикла в сек, длительность фазы вдоха и выдоха в сек.
Запишите результаты в протокол опытов.
Зарисуйте в протокол функциональную схему установки. Сделайте вывод.
